Hartwig Klinker, Würzburg
Interaktionen – Was ist klinisch relevant?
Hohe Heilungsraten, kürzere Therapiezeiten und günstige Nebenwirkungsprofile haben die Therapie mit direkt antiviralen Substanzen (DAA = direct acting antivirals) nicht nur einfacher gemacht. In Anbetracht der vielfältigen Behandlungsoptionen sind für die individuelle Therapieentscheidung verschiedene Faktoren zu berücksichtigen. Dazu gehören neben dem HCV-Geno (Sub-)typ, dem Stadium der Lebererkrankung, dem Ansprechen auf eine vorangegangene Therapie, der aktuellen Datenlage aus Studien, den bestehenden Zulassungen der Substanzen und den Nutzenbewertungen des Gemeinsamen Bundesausschusses (G-BA) auch pharmakologische Wechselwirkungen der verschiedenen Substanzen.
Hintergrund
Zu Wechselwirkungen kommt es insbesondere dann, wenn gleichzeitig eingenommene Medikamente dieselben Transportersysteme und/oder Metabolisierungsenzyme benötigen oder diese in ihrer Funktion modulieren.
Im Metabolismus diverser Phamaka spielt das Cytochrom P450-System (CYP) eine herausragende Rolle. Ca. 50 % aller Medikamente werden allein über die Cytochrom-Subfamilie 3A4 verstoffwechselt. Arzneistoffe können Substrate, Inhibitoren oder Induktoren von CYP sein. Zu berücksichtigen sind auch Genussmittel und pflanzliche Stoffe. So ist z.B. Johanniskraut ein potenter Induktor des CYP3A4, Naringin (ein Bestandteil in Grapefruitsaft) ein potenter Inhibitor.
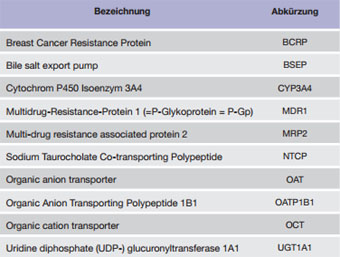
Tabelle 1:Wichtige Metabolisierungs-Enzyme und Arzneimittel-Transporter
Eine Enzyminduktion führt zu einem rascheren Abbau von Substanzen mit der möglichen Folge eines Therapieversagens, eine Inhibition zu einem verzögerten Abbau mit der möglichen Folge einer Akkumulation der Substanz und vermehrter Toxizität.
Die Verteilung von Pharmaka in die einzelnen Kompartimente des Organismus hängt wesentlich von der Nutzung und Aktivität verschiedener Transporter ab, die als Influx-oder Efflux-Pumpen fungieren (Übersicht in Tab. 1).
Ein wichtiges zelluläres Transportprotein stellt z.B. das Multidrug Transport-System MDR1 (P-Glykoprotein/P-Gp) dar. Im Gastrointestinaltrakt bewirkt P-Gp eine verminderte Absorption durch Zurückpumpen von Pharmaka in das Darmlumen, in der Leber führt es zu einer verstärkten Elimination in die Galle. Substrate des P-Gp sind z.B. diverse Zytostatika, Digoxin, Ciclosporin A, Tacrolimus, Erythromycin, Levofloxacin, Dexamethason, Atorvastatin, Verapamil, Terfenadin, Ranitidin, Morphin, Phenytoin und Rifampicin. P-Gp wird, wie auch andere Transporter, von verschiedenen HCV-DAA intensiv genutzt und moduliert (Tab. 2).
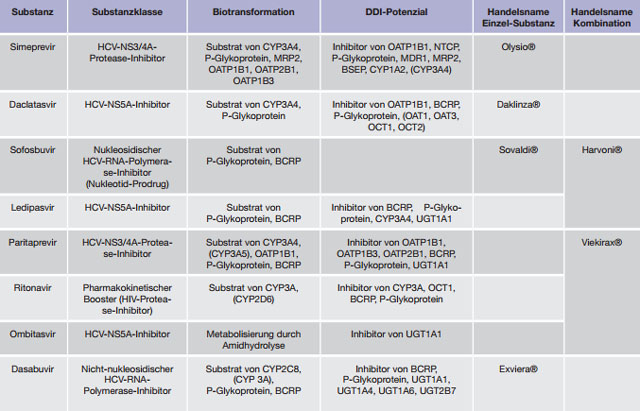
Tabelle 2:Biotransformation und Wechselwirkungspotenzial von HCV-DAAs
P-Gp kann induziert oder inhibiert werden. Eine Aktivierung der P-Gp-Expression kann zu einer reduzierten Aufnahme, eine Hemmung der P-Gp-Expression zu toxischen Konzentrationen führen.
Generell ist mit einer klinischen Relevanz einer Interaktion zu rechnen, wenn die Substanzexposition um ca. > 30 % verändert wird.
Für praktische Belange ist es sinnvoll, die klinische Bedeutung von Interaktionen konkreter Substanzkombinationen in Kategorien einzuteilen. Bewährt hat sich dabei folgende Bewertung:
- Es ist mit erheblichen, klinisch in der Regel relevanten Wechselwirkungen zu rechnen, sodass eine Kombination vermieden werden soll
- Es ist mit deutlichen, klinisch evtl. relevanten Wechselwirkungen zu rechnen, die eine besondere Beobachtung und Kontrolle des Patienten erfordern
- Es sind keine relevanten Wechselwirkungen zu erwarten
Das Interaktionspotenzial ist unter den HCV-DAA am größten bei den HCV-NS3/4A-Protease-Inhibitoren. Geringer ist es bei den HCV-NS5A-Inhibitoren, am geringsten bei den HCV-RNA-Polymerase-Inhibitoren. Jedoch müssen auch bei dieser Substanzklasse einige klinisch bedeutsame Wechselwirkungen berücksichtigt werden (s. u.)!
Dieser Beitrag stützt sich auf die Fachinformationen der Medikamente, Interaktions-Datenbanken und – überwiegend in Abstractform – publizierte Daten. Nicht zuletzt aufgrund der raschen Abfolge neuer Publikationen erhebt die Auflistung von Interaktionen keinen Anspruch auf Vollständigkeit.
Einfluss auf DAA
Wechselwirkungen sind immer dann zu erwarten, wenn als Begleitmedikation eingenommene Pharmaka die Aktivität von CYP-Enzymen und/oder die Aktivität von Arzneimittel-Transportern verändern und DAA Substrate dieser Systeme sind.
Klassische Antiepileptika wie Carbamazepin, Phenobarbital oder Phenytoin sind starke Induktoren sowohl von CYP-Enzymen (3A4) als auch P-Gp, woraus sich diverse, ausgeprägte Interaktionen und Kontraindikationen ergeben. Alternativen stellen neuere Substanzen wie Pregabalin oder Levetiracetam dar. Eine ähnlich ausgeprägte Induktion von CYP3A4 und P-Gp verursacht Johanniskraut. Johanniskraut (in viele Kombinations-Phytopharmaka enthalten!) ist daher bei einer DAA-Therapie kontraindiziert, da ein Wirkverlust der Virustatika droht.
Weitere CYP-Induktoren stellen die Tuberkulostatika Rifampicin, in geringerem Ausmaß Rifabutin und Rifapentin, das Glucocorticoid Dexamethason und die in der HIV-Therapie eingesetzten Nicht-Nukleosidischen Reverse Transkriptase-Inhibitoren Efavirenz, Etravirin und Nevirapin dar.
Wichtige Inhibitoren von CYP3A4 sind Makrolidantibiotika (Erythromycin, Clarithromycin, Telithromycin) mit der Ausnahme von Azithromycin, systemisch eingesetzte Antimykotika (Itraconazol, Ketoconazol, Posaconazol, Voriconazol) und antiretrovirale Therapieregime, die Ritonavir oder Cobicistat als pharmakokinetische Booster enthalten. Zu beachten ist eine mögliche Inhibition von CYP-Enzymen auch bei einer Komedikation mit Tyrosinkinaseinhibitoren und Mariendistel-haltigen Präparaten.
Durch eine CYP-Inhibition können die Konzentrationen einiger DAAs ansteigen mit der Folge einer faktischen DAA-Überdosierung und konsekutiv erhöhtem Nebenwirkungsrisiko. Eine individuelle Dosisanpassung ist bislang allein für Daclatasvir möglich.
Das Ausmaß pharmakokinetischer Interaktionen ist für die vielfältig möglichen Substanzkombinationen unterschiedlich ausgeprägt. Ausgewählte Kombinationen sind in den Tabellen 3-7 dargestellt und nach o. g. Schema bewertet.
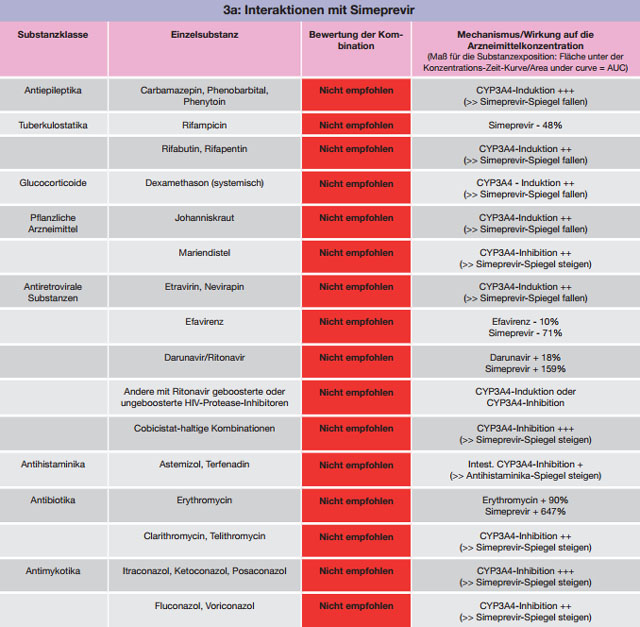
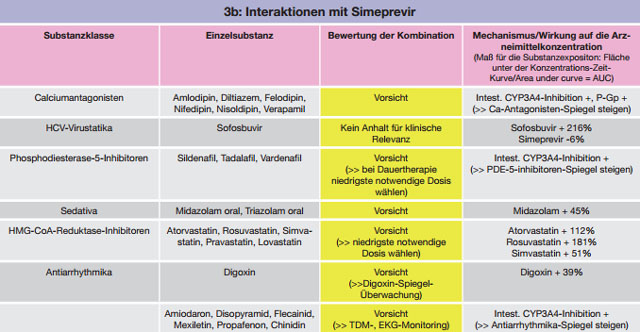
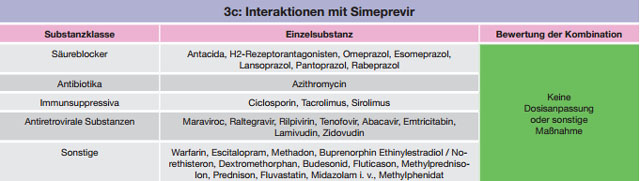
Tabelle 3 a-c:Kombinationen mit Simeprevir – Daten und Beurteilungen zu Wechselwirkungen
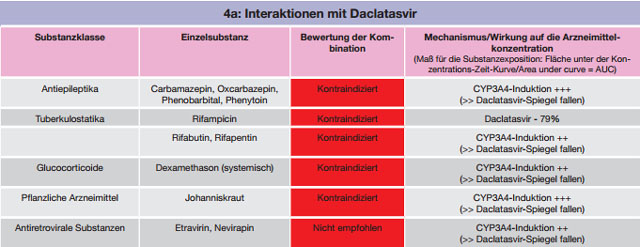
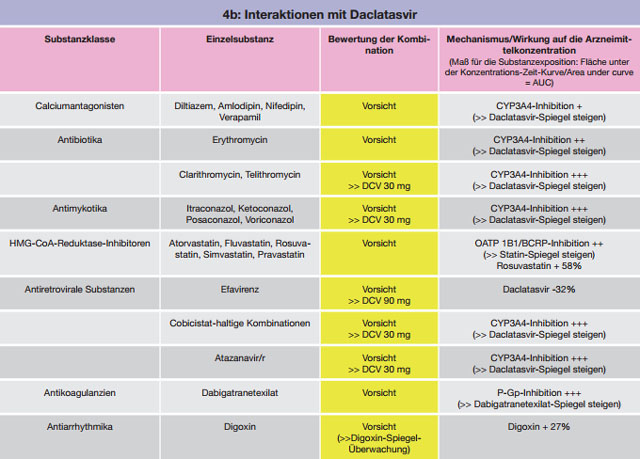
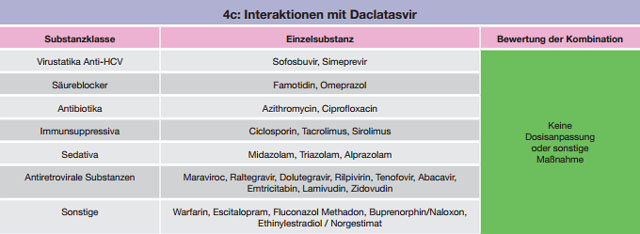
Tabelle 4 a-c:Kombinationen mit Daclatasvir – Daten und Beurteilungen zu Wechselwirkungen
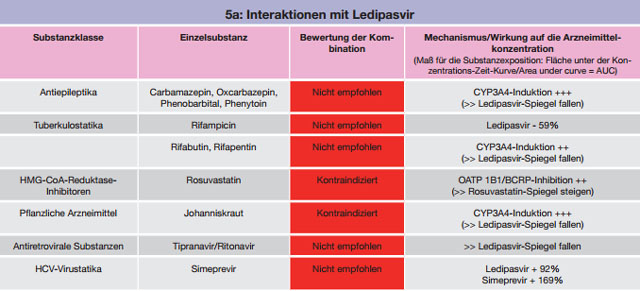
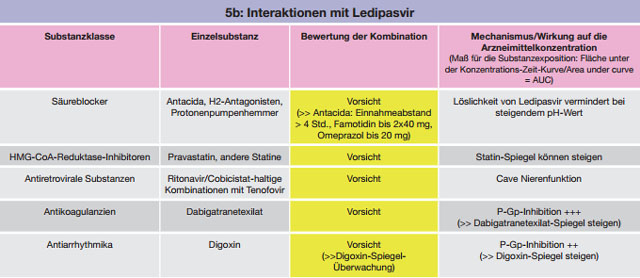
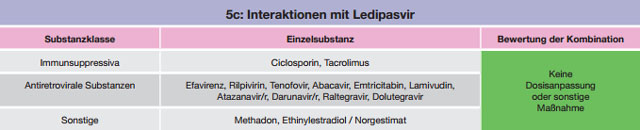
Tabelle 5 a-c:Kombinationen mit Ledipasvir – Daten und Beurteilungen zu Wechselwirkungen
Beeinflussung durch DAA
Abgesehen von Sofosbuvir inhibieren alle aktuell zugelassenen DAA verschiedene Transporter und/oder Metabolisierungsenzyme wie CYP oder UGT (Tab. 2). Dadurch können sich über eine erhöhte Substanzexposition der Komedikation vermehrt unerwünschte Wirkungen einstellen, woraus sich für verschiedene Kombinationen Kontraindikationen oder zumindest Einschränkungen in der Kombinierbarkeit ergeben.
Substanzen
und Substanzklassen, die dieser Form einer Wechselwirkung mit DAA
unterliegen, sind Calciumantagonisten (z.B. Amlodipin, Diltiazem,
Nifedipin, Nisoldipin), HMG-CoA-Reduktase-Inhibitoren (z.B.
Atorvastatin, Rosuvas-
tatin, Simvastatin), Antiarrhythmika (z.B.
Digoxin, Flecainid, Mexiletin, Propafenon, Amiodaron),
Phosphodiesterase-5-Inhibitoren (Sildenafil, Tadalafil, Vardenafil),
Sedativa (z.B. Midazolam oral), neue orale Antikoagulanzien (z.B.
Dabigatranetexilat), Antidepressiva (z.B. Sertralin, Mirtazepin,
Venlafaxin), DPP-
4-Inhibitoren (z.B. Saxagliptin) und
Neuroleptika (z.B. Aripiprazol, Risperidon).
Eine Sonderstellung unter den DAA nimmt die Fixkombination Paritaprevir/Ritonavir (RTV, „r“)/Ombitasvir ein, da hier das wesentliche Interaktionspotenzial von Ritonavir ausgeht. RTV selbst hat keinen Effekt auf die HCV-Replikation, sondern wird wegen seiner ausgeprägten Inhibition von CYP3A4 allein als pharmakokinetischer Booster eingesetzt, wie bereits seit vielen Jahren in der HIV-Therapie mit Protease-Inhibitoren. Dieses Interaktionspotenzial, welches in zahlreichen PK-Studien untersucht wurde, wirkt sich auch auf diverse Komedikation, die Substrat von CYP3A4 ist, aus.
Relevante Einzelkombinationen und ihre Bewertung hinsichtlich des Wechselwirkungspotenzials zeigen die Tabellen 3-7.
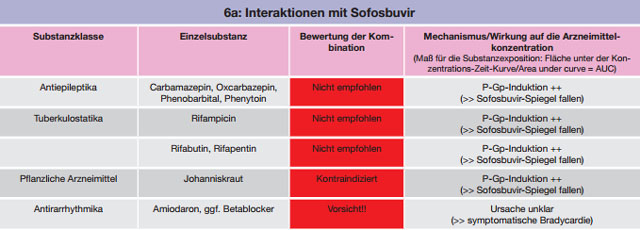
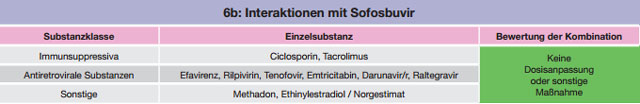
Tabelle 6 a-b:Kombinationen mit Sofosbuvir – Daten und Beurteilungen zu Wechselwirkungen
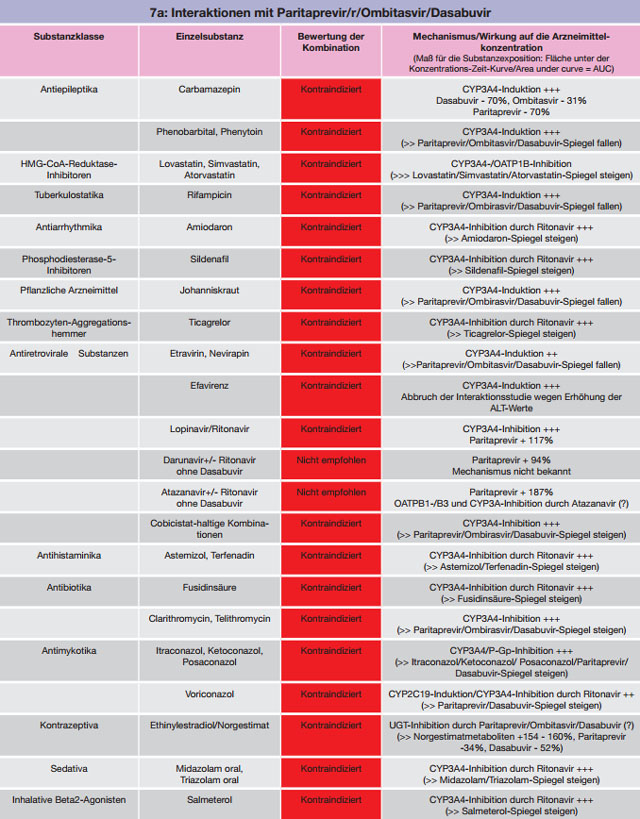
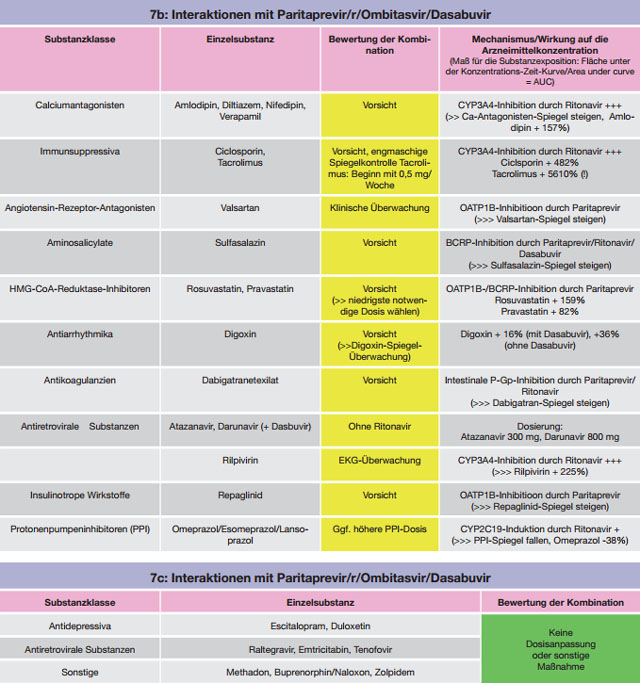
Tabelle 7 a-c:Kombinationen mit Paritaprevir/r/Ombitasvir/Dasabuvir – Daten und Beurteilungen zu Wechselwirkungen
Sonstige Wechselwirkungen
Da die Löslichkeit von Ledipasvir vom gastrischen pH-Wert abhängt und sich bei höherem pH vermindert, ist bei einer Komedikation mit Säureblockern mit einer verminderten Ledipasvir-Exposition und einem damit verbundenen Risiko für eine reduzierte Wirksamkeit zu rechnen.
Unter der Therapie mit Sofosbuvir in Kombination mit anderen DAAs (nicht bei Kombination mit PEG-Interferon/Ribavirin) wurden bei Komedikation mit dem Antiarrhythmikum Amiodaron symptomatische Bradykardien (darunter drei Fälle mit Schrittmacher-Pflichtigkeit und ein Todesfall) beobachtet. Die Ursache dieser möglichen Wechselwirkung ist bislang unklar. Die Bradykardien traten in den ersten Stunden bis Tagen (max. 2 Wochen) nach Beginn einer derartigen Behandlung auf. Eine Kombination mit Amiodaron und einer Sofosbuvir-haltigen DAA-Kombination sollte vermieden werden. Auch die Kombination mit anderen bradykardisierenden Substanzen erfordert eine genaue klinische Beobachtung.
Umgang mit Interaktionen
Eine große Bedeutung zur Erfassung möglicher Interaktionen kommt einer gewissenhaften Anamnese-Erhebung bezüglich bestehender Komorbiditäten und eingenommener Medikamente zu. Dabei ist auch an nicht verschreibungspflichtige sowie pflanzliche Medikamente zu denken. Zur möglichst lückenlosen Erfassung dieser Daten ist die Einbindung des Assistenzpersonals in der Praxis/Ambulanz häufig von großem Nutzen.
Jede Komedikation sollte vor Beginn einer Therapie mit DAA nochmals auf den Prüfstand gestellt werden. Insbesondere ist zu prüfen, ob nicht einzelne Medikamente während der HCV-Therapie, die sich ja über einen absehbaren Zeitraum erstreckt, abgesetzt werden können oder zumindest vorübergehend verzichtbar sind.
Falls möglich, sind Instrumente zum Monitoring der Komedikation zu nutzen. So besteht für verschiedene Medikamente die Möglichkeit des Therapeutischen Drug Monitorings (TDM), wodurch konkrete Veränderungen der Pharmakokinetik erkennbar werden. Etabliert ist ein TDM z. B. für Immunsuppressiva, Antiepileptika, einzelne Antibiotika, Digitalispräparate oder HIV-PI und –NNRTI.
Für einige Substanzen ist es auch möglich, Wechselwirkungen über Effektivitätskontrollen der Medikamente zu erkennen (z. B. engmaschige Kontrollen des Quick-Wertes bei Cumarin-Therapie).
Wegen der Vielfalt und auch der gelegentlichen Unvorhersagbarkeit möglicher Medikamenten-Wechselwirkungen ist die Nutzung von Interaktions-Datenbanken oft eine große Hilfe. Etabliert ist z. B. die Datenbank der Universität Liverpool (Chair: Prof. D. Back) unter www.hep-druginteractions.org oder als App „HEP iCHART“.
Für wichtige Indikationsgebiete können so z. B. aufgrund der verfügbaren Interaktionsdaten Medikamenten-Austauschlisten erstellt werden, in denen Substanzen mit geringem Interaktionspotential aufgeführt werden.
Zu beachten ist, dass bislang nur begrenzt Interaktionsdaten aus PK-Studien vorliegen und zahlreiche Empfehlungen aus dem Metabolismus sowie Induktions- bzw. Inhibitionspotenzial der Einzelsubstanzen abgeleitet wurden. In der Vergangenheit hat sich wiederholt gezeigt, dass sich diese Annahmen klinisch oder in später durchgeführten PK-Studien nicht bestätigen ließen. Als Beispiele seien die nicht erwartete, wahrscheinliche Interaktion zwischen einer Sofosbuvir-haltigen DAA-Kombination und Amiodaron sowie die, entgegen der aus der Interaktion Daclatasvir – Atazanavir/r abgeleiteten Wechselwirkung, nicht signifikante Interaktion mit Darunavir/r bzw. Lopinavir/r genannt. Während Daclatasvir bei Kombination mit Atazanavir/r auf 30 mg/d reduziert werden sollte, kann die Substanz bei Komedikation mit Darunavir/r bzw. Lopinavir/r normal (60 mg/d) dosiert werden.
Weitere Interaktionsstudien sind daher dringend erforderlich, um die Sicherheit einer Behandlung mit DAA, die ja oft in eine Multimedikation eingebunden ist, weiter zu erhöhen.
1. Fachinformation Sovaldi® (Sofosbuvir), Stand Januar 2014
2. Fachinformation Olysio® (Simeprevir), Stand Juni 2014
3. Fachinformation Daklinza® (Daclatasvir), Stand August 2014
4. Fachinformation Harvoni® (Sofosbuvir/Ledipasvir), Stand November 2014
5. Fachinformation Viekirax® (Ombitasvir/Paritaprevir/Ritonavir), Stand Januar 2015
6. Fachinformation Exviera® (Dasabuvir), Stand Januar 2015
7. German P, Pang PS, Fang L et al.. Drug-drug interaction profile of the fixed dose combination tablet ledipasvir/sofosbuvir. AASLD 2014, 7.-11.14, Boston, MA, Poster 1976
8. German P, Pang P, West S et al.. Drug interactions between direct acting anti-HCV antivirals sofosbuvir and ledipasvir and HIV antiretrovirals. 15th International Workshop on Clinical Pharmacology of HIV and Hepatitis Therapy. 19-21.5.14, Washington Abstract O_06
9. Karageorgopoulos DE, El-Sherif O, Bhagani S et al.. Drug interactions between antiretrovirals and new or emerging direct-acting antivirals in HIV/hepatitis C virus coinfection. Curr Opin Infect Dis. 2014; 27:36–45. doi: 10.1097/QCO.0000000000000034.
10. Kirby BJ, Symonds WT, Kearney BP et al.. Pharmacokinetic, Pharmacodynamic, and Drug-Interaction Profile
of the Hepatitis C Virus NS5B Polymerase Inhibitor Sofosbuvir. Clin Pharmacokinet. 2015 Mar 31. [Epub ahead of print]
11. Burgess S, Partovi N, Yoshida EM, Erb SR, Azalgara VM, Hussaini T. A Review of Drug Interactions With Direct-Acting Antivirals for Hepatitis C: Implications for HIV and Transplant Patients. Ann Pharmacother. 2015 Mar 13. pii: 1060028015576180. [Epub ahead of print]
12. German P, Garrison K, Pang PS, et al. Drug-drug interactions between anti-HCV regimen ledipasvir/sofosbuvir and antiretrovirals,. CROI 2015, February 23-26, 2015; Seattle, Abstract 82
13. German P, Yang J, West S, et al. Effect of food and acid reducing agents on the relative bioavailability and pharmacokinetics of ledipasvir/sofosbuvir fixed dose combination tablet. 15th International Workshop on Clinical Pharmacology of HIV and Hepatitis Therapy, May 19-21, 2014, Washington, DC abstract P_15
14. Eley T, You X, Wang R, et al. Daclatasvir: Overview of drug–drug interactions with antiretroviral agents and other common concomitant drugs. HIV DART, December 9-12, 2014, Miami, FL, Poster 63
15. FDA: Drug Safety Communication - FDA warns of serious slowing of the heart rate when antiarrhythmic drug amiodarone is used with hepatitis C treatments containing sofosbuvir (HARVONI or SOVALDI) in combination with another Direct Acting Antiviral drug;http://www.fda.gov/downloads/
16. Drugs/DrugSafety/UCM439492.pdf
17. Menon R, Badri P, Wang T, et al. Drug-drug Interaction Profile of the All-Oral Anti-Hepatitis C Virus Regimen of Paritaprevir/Ritonavir, Ombitasvirand Dasabuvir. J Hepatol. 2015 Jan 31. pii: S0168-8278(15)00057-4.doi: 10.1016/j.jhep.2015.01.026.
18. Patel N, Nasiri M, Koroglu A et al.. Prevalence of drug-drug interactions upon addition of simeprevir- or sofosbuvir-containing treatment to medication profiles of patients with HIV and hepatitis C coinfection. AIDS Res Hum Retroviruses. 2015 Feb;31(2):189-97. doi: 10.1089/AID.2014.0215. Epub 2015 Jan 6





