Reinhart Zachoval, MüNchen
HCV-Therapie bei Leberzirrhose
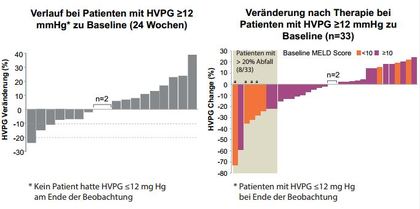
Abbildung 1:Sofosbuvir + Ribavirin bei kompensierter und dekompensierter Zirrhose mit portaler Hypertension. Veränderungen des portal-venösen Druckgradienten (HVPG) im Verlauf.
Am Anfang jeder Therapie steht neben der Frage nach HCV-Genotyp/Subtyp, eventueller Vorbehandlung, Viruslast und Laborparametern, die Überlegung, ob eine hochgradige Fibrose/Zirrhose beim Patienten vorliegt; und wenn ja, in welchem Stadium (kompensiert – Stadium Child A oder dekompensiert – Stadium Child B/C). Leider sind nicht wenige Patienten zum Zeitpunkt der Diagnosestellung schon im fortgeschrittenen Stadium ihrer Erkrankung. Die Diagnose einer Zirrhose hat – abgesehen von den Konsequenzen bei der Hepatitis-Therapie – zur Folge, dass bzgl. Komplikationen der portalen Hypertension abgeklärt werden muss und ein regelmäßiges HCC-Screening erfolgt.
Goldstandard: Elstographie
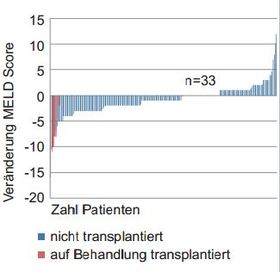
Abbildung 2:Englisches EAP-Programm bei dekompensierter Zirrhose. Änderung des MELD-Score von Baseline zu Follow Up Woche 4. n=200
Im klinischen Alltag geben der Ultraschall (B-Mode) mit Beachtung der Leberbinnenstruktur, der Leberoberfläche und Leberränder sowie der Pfortaderweite und Milzgröße in Kombination mit Duplex-Sonographie, ergänzt durch die aussagekräftige Thrombozytenzahl und Lebersyntheseparameter (Albumin, Bilirubin, Gerinnung, PCHE) einen ersten Anhalt für das Vorliegen einer Leberzirrhose. In weniger ausgeprägten Fällen ist diese Verdachtsdiagnose aber erst durch die Elastographie abzusichern. Die neuen Leitlinien der EASL – ALEH empfehlen die Elastographie in Kombination mit Serumbiomarkern (z.B. Fibro Test®, APRI oder NAFLD Fibrose Score) als Fibrosediagnostik der Wahl (siehe Kasten). Eine Leberbiopsie wird bei korrekter Anwendung nichtinvasiver Methoden in vielen Fällen überflüssig. Der Grenzwert für eine Zirrhose/F4 mittels ARFI liegt bei 1.87 m/sec (AUROC 0.93; Nierhoff 2013) mittels Fibroscan bei 13.0 kPa (AUROC 0.94; Friedrich-Rust 2008).
Prädiktoren bei Leberzirrhose
Nicht-invasive Evaluation des Schweregrads der Lebererkrankung
Auf der Jahrestagung der EASL erschienen erstmals Leitlinien zur Evaluation des Schweregrads der Lebererkrankung und Prognose. Die Leitlinien wurden in Zusammenarbeit mit der lateinamerikanischen Lebergesellschaft ALEH erstellt. Berücksichtigt wurden alle derzeit verfüG-BAren Verfahen, d.h. Elastographie, patentierte Serummarker-Tests (FibroTest®, FibroMeter® und HepaScore®) sowie die MRT-Elastographie. Die Gesellschaft bewertete die vorhanden Studiendaten für alle Lebererkrankungen. Bei der viralen Hepatitis sowie HIV/HCV-Koinfektion ist die Elastographie der neue Goldstandard. Die Methode ist besser geeignet, um eine Zirrhose auszuschließen (negativer prädiktiver Wert > 90 %) als zu diagnostizieren, und gleichzeitig besser im Nachweis einer Zirrhose als einer Fibrose.
Die
Gesellschaft empfiehlt, bei jedem Patienten mit Hepatitis C vor der
Behandlung eine transiente Elastographie durchzuführen. Bei Zirrhose
ist eine Leber-
biospie zur Bestätigung nicht erforderlich. Ist
kein Gerät verfüG-BAr, sollte ein Serummarker-Test gemacht werden.
Patienten mit Zirrhose sollten auf eine portale Hypertension und ein
hepatozelluläres Karzinom untersucht werden.
Empfehlungen zur Durchführung der Elastographie
Nichtinvasive Verfahren sollten stets von einem Leberspezialisten interpretiert werden in Zusammenhang mit der Klinik und anderen Tests (biochemisch, radiologisch, endoskopisch) und unter Berücksichtigung der Qualitätskriterien und Einschränkungen der Verfahren.
Serum-Biomarker können im klinischen Alltag eingesetzt werden aufgrund der breiten Anwendbarkeit (> 95 %) und guten Labor-Reproduzierbarkeit. Sie sollten beim nüchternen Patienten abgenommen werden (insbesondere die mit Hyaluronsäure) gemäß den Empfehlungen der Hersteller.
Die transiente Elastographie ist ein schnelles, einfaches, sicheres und einfach zu erlernendes Verfahren, das breit verfüG-BAr ist. Die wichtigsten Einschränkungen sind Aszites, Adipositas permagna und die Unerfahrenheit des Anwenders.
Die transiente Elastographie sollte von einem erfahrenen Anwender (>100 Untersuchungen) nach einem standardisierten Protokoll durchgeführt werden: Abstand mindestens zwei Stunden von der letzten Mahlzeit, im Liegen, rechter Arm in voller Abduktion, Sonde in der mittleren Axillarlinie im Bereich des 9-11 Interkostalraums, mindestens 10 Messungen.
Bei der Interpretation sollten folgende Parameter berücksichtigt werden:
- IQR/Median (< 30 %)
- GPT (< 5 x ULN)
- BMI (XL-Sonde >30 kg/M2 oder Haut-Sonden-Abstand > 25 mm)
- Keine extrahepatische Cholestase
- Kein Rechtsherz-Versagen oder andere Gründe für Leberstauung
- Kein akuter exzessiver Alkoholkonsum
Die alternativen Methoden sSWE/AFRI oder 2D-SWE scheinen einige Limitationen der transienten Elastographie nicht zu haben, die Qualitätskriterien für die korrekte Interpretation sind aber noch nicht gut definiert.
Derzeit sollte bei der Interpretation von pSWE/AFRI folgende Parameter berücksichtigt werden: Mindestens 2 Stunden nüchtern, Transminasen (<5xULN), keine extrahepatische Cholestase und kein Rechtsherz-Versagen.
Die MRT-Elastographie ist derzeit zu teuer und zeitaufwändig für die klinsiche Routine und vielmehr zur Forschung geeignet.
In
den Leitlinien der Fachgesellschaften sowie in den Zulassungstexten
der DAA wird zwischen „Zirrhose“ und „keine Zirrhose“
unterschieden. Somit ist der Ausschluss einer Leberzirrhose
essentiell. Patienten mit Zirrhose gelten als schwerer zu behandeln,
wobei hier verschiedene weitere Prädiktoren eine Rolle spielen. In
den aktuellen Studien waren insbesondere ein Albumin < 40
bzw. 35 bzw 28 g/l, eine Thrombozyten-
zahl < 90.000/µl,
ein Alfa-Fetoprotein >20 ng/ml, ein Stadium Child C bei
Dekompensation und eine erfolglose Vortherapie negative Prädiktoren.
In aller Regel sollte bei Zirrhosepatienten Ribavirin in das
Behandlungskonzept integriert werden. Die Ribavirin-Dosis beträgt
1200/1000 mg/d. Bei entsprechender Indikation kann die Therapie auch
mit 600 mg/d (oder weniger) begonnen werden und im Verlauf ggf. nach
oben angepasst werden. Bei Patienten mit mehreren negativen
Prädiktoren kann es sinnvoll sein, die Therapie von 12 auf 24 Wochen
zu verlängern (Sarrazin 2015).
Therapieoptionen
Derzeit
können alle zugelassenen DAA auch bei Zirrhose eingesetzt werden.
Die Datenlage ist jedoch unterschiedlich. Auch sind die SVR-Raten in
den Studien nicht ohne weiteres miteinander vergleichbar, denn die
Patientenpopula-
tionen bzw. der Schweregrad der Zirrhose waren in
den Studien unterschiedlich. Im Einzelnen sind derzeit folgende
Therapieoptionen – aufgeschlüsselt nach HCV-Genotyp – bei
kompensierter Zirrhose verfügbar (Tab.1).
Dekompensierte Zirrhose
Die Behandlung von Patienten mit dekompensierter Zirrhose Child B/C sollte nur in spezialisierten Zentren erfolgen. Für die Therapie mit den 3D-Substanzen Paritaprevir/r/Ombitavir und Dasabuvir in dieser Patientengruppe gibt es bisher noch keine belastbaren Daten. Im Gegensatz hierzu ist die Wirksamkeit bei guter Verträglichkeit der Kombination Sofosbuvir plus Ledispavir und Ribavirin über 12 (bzw. 24) Wochen bei Patienten mit dekompensierter Leberzirrhose (Child B und C) in mehreren Studien nachgewiesen (Reddy 2014, Flamm 2014, Manns 2015). Es zeigte sich eine hohe antivirale Wirksamkeit mit SVR-Raten von 85 – 96 % (Child B) und 70 – 90 % (Child C) unabhängig von der Therapiedauer 12 vs 24 Wochen.
Bei vielen Patienten kommt es zu einer funktionellen Verbesserung der Leberzirrhose und Verminderung des hepatisch-venösen Druckgradienten bei guter Verträglichkeit und einer geringen Anzahl ernsthafter Nebenwirkungen (Abb.1). In Einzelfällen kann es jedoch auch zu einer Verschlechterung der Leberfunktionsparameter kommen, auch mit Todesfällen selbst bei effektiver HCV-Suppression.
So kam es im englischen EAP-Programm bei rund 40 % der Patienten zu einer Verbesserung des MELD um mehr als 2 Punkte, allerdings auch bei 10 % zu einer Verschlechterung um mehr als 2 Punkten. Erneut war das Albumin ein Prädiktor. Die Wahrscheinlichkeit einer Verbesserung war bei einem Albumin > 35 g/l höher (Abb. 2). In SOLAR-2 wurde eine ähnliche Beobachtung gemacht.
Afdhal N, Zeuzem S, Kwo P, et al. Ledipasvir and sofosbuvir for untreated HCV genotype 1 infection. N.Engl.J.Med. 2014;370:1889-1898.
Bourliere M, Sulkowski MS, Omata M, et al. An Integrated Safety and Efficacy Analysis of > 500 Patients with Compensated Cirrhosis Treated with Ledipasvir/Sofosbuvir with or without Ribavirin. Hepatology 2014;60:239a-239a
EASL-ALEH Clinical Practice Guidelines: Non-invasive tests for evaluation of liver disease severity and prognosis J Hepatol 2015 (in press)
Everson GT, Dusheiko G, Coakley E, et al. Integrated Efficacy Analysis of Four Phase 3 Studies in HCV Genotype 1a-Infected Patients Treated with ABT450/r/Ombitasvir and Dasabuvir With or Without Ribavirin. Hepatology 2014; 60:239a-240a.
Flamm SL, Everson GT, Charlton M, et al. Ledipasvir/Sofosbuvir with Ribavirin for the Treatment of HCV in Patients with Decompensated Cirrhosis: Preliminary Results of a Prospective, Multicenter Study. Hepatology 2014;60:320a-321a.
Jacobson IM, Gordon SC, Kowdley KV, et al. Sofosbuvir for hepatitis C genotype 2 or 3 in patients without treatment options. N.Engl.J.Med. 2013;368:1867-1877.
Kapoor R, Kohli A, Sidharthan S, et al. All Oral Treatment for Genotype 4 Chronic Hepatitis C Infection with Sofosbuvir and Ledipasvir: Interim Results from the NIAID SYNERGY Trial. Hepatology 2014;60:321a-321a.
Lawitz E, Sulkowski MS, Ghalib R, et al. Simeprevir plus sofosbuvir, with or without ribavirin, to treat chronic infection with hepatitis C virus genotype 1 in non-responders to pegylated interferon and ribavirin and treatment-naive patients: the COSMOS randomised study. Lancet 2014.
Manns M, Forns X, Samuel D, et al. Ledipasvir/Sofosbuvir with ribavirin is safe and efficacious in decompensated and post liver transplantation patients with HCV infection: preliminary results of the prospective SOLAR 2 trial. J Hepatol 105;62:S187
Friedrich-Rust M, Ong MF, Martens S et al. Performance of transient elastography for the staging of liver fibrosis: a meta-analysis- Gastroenterology 2008; 134:960-974.
Nierhoff J , Chávez Ortiz AA , Herrmann E, et al. The efficiency of acoustic radiation force impulse imaging for the staging of liver fibrosis: a meta-analysis. Eur Radiol 2013; 23:3040–3053
Poordad F, Hezode C, Trinh R, et al. ABT-450/r-ombitasvir and dasabuvir with ribavirin for hepatitis C with cirrhosis. N Engl J Med 2014;370:1973-82.
Reddy KR, Everson GT, Flamm SL, et al. Ledipasvir/Sofosbuvir with Ribavirin for the Treatment of HCV in Patients with Post Transplant Recurrence: Preliminary Results of a Prospective, Multicenter Study. Hepatology 2014;60:200a-201a.
Sarrazin C, Berg T, Buggisch P et al. Aktuelle Empfehlung zur Therapie der chronischen Hepatitis C. Z Gastroenterol. 2015 ;53:320-34.
van der Meer AJ, Veldt BJ, Feld JJ et al. Association between sustained virological response and all-cause mortality among patients with chronic hepatitis C and advanced hepatic fibrosis
JAMA 2012; 308(24):2584-93 Zeuzem S, Dusheiko GM, Salupere R, et al. Sofosbuvir and ribavirin in HCV genotypes 2 and 3. N.Engl.J.Med. 2014; 370:1993-2001





