The Liver Meeting 7.-11. November 2013 in Washington
 Vorbereitung auf eine
neue Ära
Vorbereitung auf eine
neue Ära
Der Jahreskongress der amerikanischen Hepatologen stand ganz im Zeichen der Interferon-freien Therapie der Hepatitis C. Die neuen Kombinationen verheißen goldene Zeiten: Heilungsraten über 90% unabhängig vom Genotyp innerhalb von wenigen Wochen. Jetzt muss man nur noch entscheiden, wer sofort und wer später behandelt wird, und welches Regime für welchen Patienten am besten ist. Doch das ist leider nicht ganz so einfach.
Nach Angaben der AASLD waren über 9000 Interessierte aus aller Welt zum Liver Meeting nach Washington DC gereist, die
meisten davon wohl, um die Erfolgsgeschichte der direkt antiviralen Therapie persönlich mitzuerleben. Ihre Erwartungen
wurden nicht enttäuscht. In den meisten Studien, die präsentiert wurden, lag die Heilungsrate über 90 %.
In den ersten beiden Kongresstagen lag der Schwerpunkt des Programmes nicht auf der Hepatitis. Dafür gab es bei den beiden einzigen Industrie-gesponsorten Satelliten-Symposien zur Hepatitis einen Vorgeschmack auf die neue amerikanische Fortbildungskultur. Beide Symposien wurden von sogenannten unabhängigen CME-Agenturen organisiert und fanden nicht im Kongressgebäude, sondern in einem nahe gelegenen Hotel als Dinner-Symposium mit mehreren Hundert Teilnehmern statt. Ein Symposium wurde von Gilead Sciences unterstützt, das andere Symposium von AbbVie, Boehringer Ingelheim und Janssen, also gemeinsam von zukünftigen Konkurrenten. Wie es zu solch einer interessanten Konstellation kam, ließ sich nicht eruieren.
Wichtig: Blick nach vorne
An den letzten beiden Kongresstagen jagte dann eine interessante Studie die andere. Die Zahl der Substanzen und Kombinationen zur Therapie der Hepatitis C, die in der Entwicklung sind, ist immer noch groß und schwer überschaubar. Klar ist jedoch bereits heute, welche Medikamente 2014 zur Verfügung stehen werden. Der NS5B-Polymerasehemmer Sofosbuvir und die beiden NS3/4A-Proteasehemmer der zweiten Generation Faldaprevir und Simeprevir Anfang und Mitte 2014 und möglicherweise gegen Ende des Jahres der NS5A-Inhibitor Daclatasvir.
Gleich in die erste Welle springen?
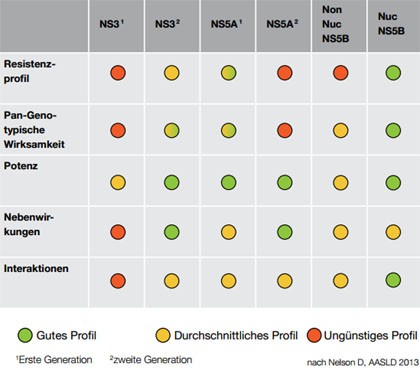 Abbildung 1: Profil direkt antiviraler Substanzen nach Klassen
Abbildung 1: Profil direkt antiviraler Substanzen nach Klassen
Damit besteht erstmals die Möglichkeit, Patienten außerhalb von Studien Interferon-frei zu behandeln. Dennoch sollte man über diesen neuen Optionen nicht den Blick in die weitere Zukunft verlieren. Viele Referenten haben die aktuelle Phase der direkt antiviralen Hepatitis C-Therapie mit dem Beginn der antiretroviralen HIV-Behandlung verglichen. Die Euphorie war hier anfangs groß, fast ebenso groß wie die Enttäuschung nach den ersten Misserfolgen und Resistenzen. Dieser Vergleich hinkt, da HCV-Resistenzen nach bisherigem Kenntnisstand im Gegensatz zu HIV-Resistenzen nicht archiviert werden. Trotzdem sollte man bei den Studien genau hinsehen. Nicht in allen Studien wurden schwer zu behandelnde Patienten in relevanter Zahl eingeschlossen und nicht bei allen Patientengruppen lag die Heilungsrate über 90 %. Angesichts der Dynamik der Entwicklung kann es sich lohnen zu warten.
Substanzklassen unterscheiden
Angesichts der Vielzahl an neuen Substanzen loht es sich auch, sich mit den verschiedenen Substanzklassen und ihren Vor- und Nachteilen vertraut zu machen (Abbildung 1). So haben NS3-Proteasehemmer eine niedrige Resistenzschwelle und ein hohes Interaktionspotential. Innerhalb der Klasse gibt es Kreuzresistenzen und Simeprevir ist bei GT1a mit dem Polymorphismus Q80K weniger wirksam. Ein Therapieversagen ist meist mit einer Resistenzentwicklung verbunden. Die Resistenzschwelle von nukleotidischen NS5B-Polymerasehemmer wie Sofosbuvir ist dagegen hoch. Bislang ist nur ein klinischer Fall einer Resistenz dokumentiert. Auf die Therapie mit Sofosbuvir sprechen nahezu alle Patienten an. Grund für ein Therapieversagen ist hier in erster Linie der Relaps. Kontrollen während einer Sofosbuvir-haltigen Therapie sind nur wenig sinnvoll, das Ansprechen zu Woche 4 ist kein Prädiktor für den Relaps (Wyles D et al., #1112). Doch möglicherweise ist auch hier das letzte Wort noch nicht gesprochen. Die breite Anwendung in der Praxis hat schon bei manchen Medikamenten zu Überraschungen geführt.
Leichtes Spiel bei GT2
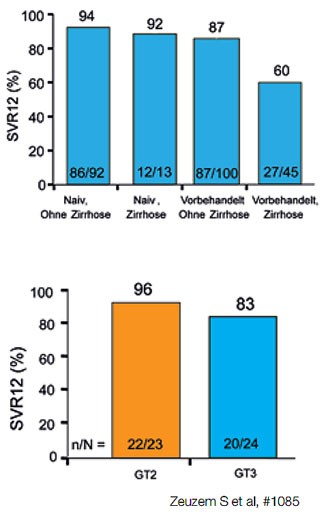 Abbildung 2a und b: SVR12 bei verschiedenen Strategien bei Genotyp 3.2 a VALENCE:
Sofosbuvir/Ribavirin über 24 Wochen. 2b LONESTAR-2: Sofosbuvir + P/R über 12 Wochen bei Vorbehandelten
Abbildung 2a und b: SVR12 bei verschiedenen Strategien bei Genotyp 3.2 a VALENCE:
Sofosbuvir/Ribavirin über 24 Wochen. 2b LONESTAR-2: Sofosbuvir + P/R über 12 Wochen bei Vorbehandelten
Als erste Interferon-freie Therapie wird zur Verfügung stehen: Sofosbuvir plus Ribavirin bei Genotyp 2 und 3. Diese Kombination über 12 Wochen hat in den Zulassungsstudien bei Patienten mit Genotyp 2 mit und ohne Zirrhose eine SVR-Rate von über 90 % ergeben. Es nahmen auch vorbehandelte Patienten an den Studien teil, allerdings nur wenige Vorbehandelte mit Zirrhose.
GT3: Schwer zu behandeln
Patienten mit GT2 und GT3 wurden bislang „in einen Topf geworfen“, d.h. die Therapie-Algorithmen waren gleich. Das
dürfte in Zukunft anders werden. Überraschenderweise hatten Patienten mit GT3 in den Studien FISSION, FUSION und
POSITRON deutlich schlechter abgeschnitten. Die SVR12-Raten nach 12 Wochen Sofosbuvir/Ribavirin erreichten gerade mal
60%, bei Zirrhotikern lagen sie deutlich niedriger. Die Lösung des Problems scheint eine Therapieverlängerung auf 24
Wochen oder bei 12wöchiger Behandlung die zusätzliche Gabe von Interfon zu sein.
Das Konzept der Therapieverlängerung wurde von der deutschen Arbeitsgruppe um Zeuzem, Frankfurt, in der VALENCE-Studie geprüft. Diese Studie war eigentlich nur aufgelegt worden, um die europäischen Hepatologen zu besänftigen, die an den großen Sofosbuvir-Zulassungsstudien nicht beteiligt wurden. Nach bekannt werden der schlechten Ergebnisse von FUSION bei GT3 wurde die Therapiedauer in VALENCE auf 24 Wochen verlängert – mit Erfolg. Von den 240 Patienten erreichten nach 24 Wochen über 90 % der Therapienaiven, 87 % der Vorbehandelten ohne Zirrhose und 60 % der Vorbehandelten mit Zirrhose die SVR12 (Abbildung 2a) (Zeuzem S et al., #1085).
In der deutlich kleineren amerikanischen Studie LONESTAR-2 (n=47) erhielten vorbehandelte Patienten mit GT2/3 12 Wochen Sofosbuvir/Ribavirin plus pegyliertes Interferon. 22/23 (96%) mit GT2 und 20/24 (83%) mit GT3 erreichten eine SVR12. Patienten mit und ohne Zirrhose sprachen gleich gut an (Abbildung 2b) (Lawitz E et al., #LB4).
Genotyp 1
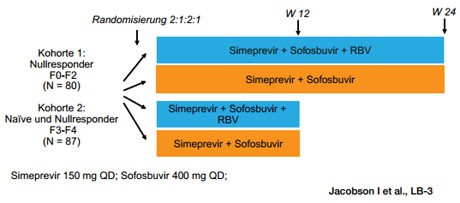 Abbildung 3a: COSMOS Studiendesign: Simeprevir + Sofosbuvir ± RBV bei
Genotyp 1
Abbildung 3a: COSMOS Studiendesign: Simeprevir + Sofosbuvir ± RBV bei
Genotyp 1
Eine Interferon-freie Therapie bei Genotyp 1 ist theoretisch auch möglich, wenn Sofosbuvir und Simeprevir erhältlich sind. Praktisch wird darüber der Zulassungstext der Medikamente entscheiden. Studiendaten zu dieser Kombination gibt es. In COSMOS wurden 167 Patienten mit dieser Kombination behandelt und zwar mit/ohne Ribavirin über 12/24 Wochen. Die präsentierten SVR-Raten sind beeindruckend hoch. Von den Nullrespondern ohne Zirrhose erreichten 80%-96% eine SVR, von den Naiven und Nullrespondern mit Zirrhose 94-100%. Ribavirin und die Zirrhose scheinen keinen Einfluss auf das Ergebnis zu haben, möglicherweise jedoch der Q80K-Polymorphismus. Vier Patienten hatten einen Relaps mit dieser Mutation. Die Verträglichkeit war sehr gut. Hauptprobleme waren Anämie und Hyperbilirubinämie (Abbildung 3 a und b) (Jacobsen I et al., #LB-3).
Der nächste Schritt
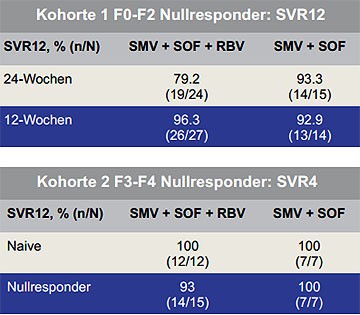 Abbildung 3b: COSMOS SVR12 bei Patienten mit F0-F2 (alle Arme) und SVR4 bei
Patienten mit F3-F4 (nur 12-Wochen-Arm)
Abbildung 3b: COSMOS SVR12 bei Patienten mit F0-F2 (alle Arme) und SVR4 bei
Patienten mit F3-F4 (nur 12-Wochen-Arm)
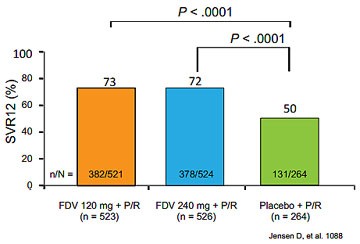
Abbildung 4: STARTVerso 1 und 2: Faldaprevir + pegIFN/RBV bei therapienaiven Patienten mit GT 1
Die Proteasehemmer der zweiten Generation, die voraussichtlich 2014 zugelassen werden, sind Faldaprevir und
Simeprevir. Zu Faldaprevir wurde eine gepoolte Analyse der Studien STARTVerso1 und 2 (gleiches Design) vorgestellt. 1314
Patienten mit GT1 nahmen an den Untersuchungen teil. Die Therapie konnte bei 84% der Patienten aufgrund des frühen
Ansprechens auf 24 Wochen verkürzt werden und im Vergleich zu PegIFN/RBV wurden deutlich mehr Patienten geheilt (73 %
vs. 50 %) (Abbildung 4)(Jensen D et al., #1088). In der gepoolten Analyse von QUEST 1 und 2 mit Simeprevir (gleiches
Design) konnten 88 % der Patienten die Therapie verkürzen und 89 % erreichten die SVR12 im Vergleich zu 50 % unter der
alten Standardtherapie (Jacobsen I et al., #1122). Beide Proteasehemmer werden auch in Interferon-freien Regimen
weiterentwickelt.
Vor/nach Transplantation
Patienten vor und nach einer Lebertransplantation brauchen neue Therapieoptionen am dringlichsten. Deshalb wurde Sofosbuvir im Rahmen eines „Compassionate Use“ Programms bei schwerer Rezidiv-Hepatitis nach Lebertransplantation eingesetzt. 32 Patienten erhielten Sofosbuvir/Ribavirin ohne Interferon, 12 Patienten wurden zusätzlich mit Interferon behandelt. Angedacht war eine 48-wöchige Therapie, doch nur ein Patienten erreichte dieses Ziel. 11% brachen die Behandlung ab, 16 % verstarben und bei 18 % läuft die Behandlung noch. Dennoch sind die Ergebnisse ermutigend: Bei 64 % besserte sich die Dekompensation und 11% stabilisierten sich. 74 % der Patienten in der Interferon-freien Gruppe und 56 % mit Interferon erreichten die SVR4 (Forns X et al., #1084).
In einer zweiten, noch laufenden Pilotstudie werden Patienten mit HCV-Rezidiv nach Transplantation 24 Wochen mit Sofosbuvir/Ribavirin behandelt. Vorgestellt wurden die Daten von 40 Patienten. Die Rezidiv-Hepatitis bestand im Schnitt seit vier Jahren, die große Mehrzahl hatte GT1a und eine fortgeschrittene Fibrose. 88% waren vorbehandelt. Alle Patienten sprachen an, doch nur 77 % (27/35) erreichten die SVR4 (Charlton MR et al., #LB-2).
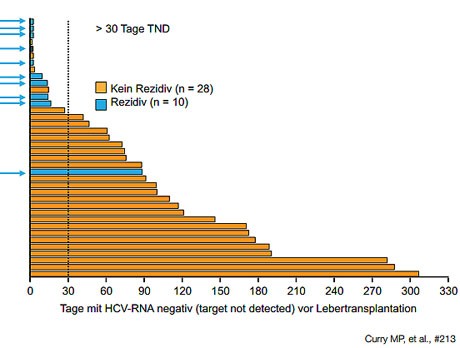 Abbildung 5: Tage mit nicht nachweisbarer HCV-RNA vor Transplantation als
Prädiktor für Rezidiv
Abbildung 5: Tage mit nicht nachweisbarer HCV-RNA vor Transplantation als
Prädiktor für Rezidiv
Ein interessanter Ansatz ist die Behandlung der Patienten kurz vor der Transplantation, um eine HCV-Infektion der neuen Leber zu verhindern. Dies wurde in einer Studie an Patienten geprüft, die wegen eines hepatozellulären Karzinoms transplantiert werden sollten, also hinsichtlich des Leberstatus weniger fortgeschritten waren. Vorgesehen war eine Therapie mit Sofosbuvir/Ribavirin für 48 Wochen bzw. bis zur Transplantation. Tatsächlich konnte die Behandlung von mehr als 30 Tagen das Hepatitis-Rezidiv in den meisten Fällen verhindern (Abbildung 5) (Curry MP et al., #213).
Akute Hepatitis C
Hepatitis-Therapie ohne Experten?
Interferon-freie Regime sind in der Regel einfach und gut verträglich.Kontrollen von Viruslast oder Laborwerten, Response-gesteuerte Therapieanpassungen, Nebenwirkungsmanagement, all das ist ohne Interferon Vergangenheit. Anders gesagt: Die neue Hepatitis-Therapie ist so einfach, dass jeder Hausarzt (nichts gegen Hausärzte!) sie durchführen kann. Der Patient bekommt ein Rezept und vier und 12 Wochen nach Therapieende wird kontrolliert, ob es geklappt hat.Das scheint nicht nur so einfach, nach Meinung der AASLD ist auch so einfach. Die amerikanische Hepatologen-Gesellschaft hat angekündigt,ein großangelegtes Fortbildungsprogramm für Ärzte aufzulegen und denkt über die Möglichkeit der Internet-basierten Beratung von Hausärzten nach. Damit soll die flächendeckende Versorgung der Patienten gewährleistet werden. Schließlich rechnet man mit einer hohen Nachfrage, denn die Dunkelziffer in den USA soll hoch sein und Kampagnen rufen zur HCV-Testung auf.Für den Hepatitis-Spezialisten bleibt dann die Aufgabe, die Indikation zur Behandlung zu stellen und das Regime auszuwählen – zumindest solange, bis es die Pille, die alle Genotypen und Patientengruppen heilt, noch nicht gibt.
Eine akute Hepatitis C bei HIV-Infizierten wurde bislang mit pegyliertem Interferon plus Ribavirin über 24 Wochen behandelt – mit großem Erfolg. Die SVR-Raten lagen ähnlich wie bei den HCV-Monoinfizierten in dieser Situation bei rund 90%. Die Ansprechraten können damit kaum verbessert werden, aber kann man die Therapiedauer vielleicht verkürzen? Dieser Frage ging Fierer aus New York nach und behandelte Patienten mit Genotyp 1 mit einer Telaprevir-basierten Tripletherapie über 12 Wochen.
An der offenen Studie (10/11-7/12) nahmen 34 HIV-positive schwule Männer mit akuter Hepatitis C teil. Wenn die Hepatitis C Genotyp 1 nicht spontan ausheilte (n=5), wurde entweder konventionell 24 Wochen mit pegIFN/RBV (n=7) oder 12 Wochen mit Telaprevir plus pegIFN/RBV (n=19) behandelt. Im zweiten Teil der Untersuchung (10/12-10/13) wurden weitere 14 Patienten mit Tripletherapie behandelt. In der Gesamtauswertung erreichten unter Tripletherapie 85% eine SVR12 im Vergleich zu 63% unter Standardtherapie. Dieses Ergebnis verfehlte knapp die statistische Signifikanz (p=0,06) (Fierer DS et al., #40).
HIV/HCV-Koinfektion
Bei der HIV/HCV-Koinfektion hat bereits die Tripletherapie mit Telaprevir bzw. Boceprevir die SVR-Raten ähnlich wie bei Monoinfizierten um rund 30 % verbessert. Problematisch waren bei diesen Proteasehemmern neben den bekannten Nebenwirkungen vor allem die Interaktionen mit der antiretroviralen Medikation.
Mit dem Proteasehemmer der zweiten Generation Faldaprevir ist dieses Problem deutlich geringer und die Therapie lässt sich genauso wie bei den HCV-Monoinfizierten Response-gesteuert auf 24 Wochen verkürzen.
Faldaprevir bei HIV/HCV
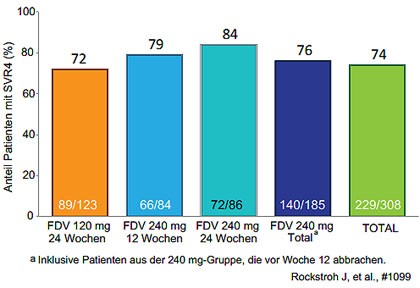 Abbildung 6: STARTVerso 4: SVR4 unter Faldaprevir + PegIFN/RBV bei
HIV/HCV-Koinfizierten mit Genotyp 1
Abbildung 6: STARTVerso 4: SVR4 unter Faldaprevir + PegIFN/RBV bei
HIV/HCV-Koinfizierten mit Genotyp 1
An der großen Studie StartVerso4 nahmen 310 HIV/HCV-Koinfizierte mit GT1 teil. 79 % hatten GT1a, 15 % eine Zirrhose,
82 % eine hohe HCV-RNA und 66 % IL28B non-CC. 22 % waren Relapser, 78 % therapienaiv. Insgesamt 74 % der Patienten
erreichten die SVR4. 80 % der Patienten erfüllten das Kriterium für eine Therapieverkürzung (HIV-RNA<25 IU/ml zu
Woche 4 und negativ zu Woche 8) und 88 % dieser Patienten erreichten die SVR4. Häufigster Grund für ein Therapieversagen
war der virologische Durchbruch. Bei den Subgruppen sprachen Patienten mit und ohne Zirrhose sowie GT1a und b
gleichermaßen gut an (Abbildung 6) (Rockstroh J et al., #1099).
Interferon-frei bei Koinfektion
In der dreiarmigen Studie PHOTON-1 wurde jetzt erstmal eine Interferon-freie Therapie (Sofosbuvir/Ribavirin) bei Koinfizierten geprüft. Therapienaive Patienten mit GT1 wurden 24 Wochen (n=114) lang behandelt. Naive Patienten mit GT2 (n=26) / GT3 (n=42) wurden 12 Wochen lang behandelt. Der Studienarm mit vorbehandelten Patienten GT2/3, die 24 Wochen lang therapiert werden, läuft noch. 7 % der Teilnehmer hatten eine Zirrhose. Über 80 % hatten eine ART, wobei es keine Vorgaben hinsichtlich des Regimes gab.
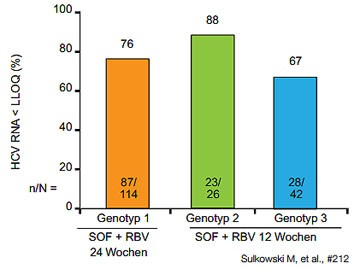 Abbildung 7: PHOTON-1: Sofosbuvir/Ribavirin bei HIV/HCV-Koinfektion SVR12
Abbildung 7: PHOTON-1: Sofosbuvir/Ribavirin bei HIV/HCV-Koinfektion SVR12
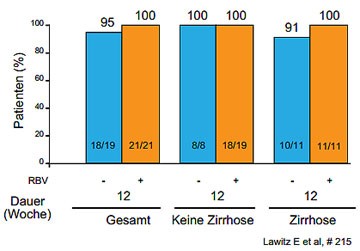 Abbildung 8: LONESTAR:
SVR12-Raten nach Sofosbuvir/Ledipasvir: SVR12-Raten bei Patienten mit Tripletherapie-Versagen mit/ohne Zirrhose
Abbildung 8: LONESTAR:
SVR12-Raten nach Sofosbuvir/Ledipasvir: SVR12-Raten bei Patienten mit Tripletherapie-Versagen mit/ohne Zirrhose
Die SVR12 nach 24-wöchiger Behandlung betrug bei GT1 76 %, bei GT2 88 % und bei GT3 67 % nach 12-wöchiger Therapie.
In der Subgruppenanalyse bei GT 1 waren GT1b und Zirrhose Prädiktoren für ein schlechteres Ansprechen (Abbildung 7).
Erneut war das Ergebnis bei GT3 unbefriedigend. Virologische Durchbrüche bei HIV und HCV waren selten und gingen auf
schlechte Compliance zurück. In den meisten Fällen war ein Relapse Grund des Therapieversagens. Bei Kombination mit
Atazanavir entwickelten bei 24-wöchiger Behandlung 18% der Patienten eine Hyperbilirubinämie >Grad 3 (Sulkowski MS et
al., #212).
Neue Ufer
Im Zentrum des Interesses der Hepatitis-Experten stehen mittlerweile die Fragen nach der optimalen Kombination und Therapiedauer. Dies wird derzeit in vielen kleinen Pilotstudien an verschiedenen Patientengruppen geprüft. Sechs Wochen könnten selbst bei Therapienaiven mit GT1 ohne Zirrhose zu kurz sein, denn in ELECTRON führten 6 Wochen Sofosbuvir/Ledipasvir (NS5B-Polymerasehemmer, NS5A-Inhibitor) plus Ribavirin nur zu einer SVR-Rate von 68 %. Die längere Therapie über 8 und 12 Wochen ergab dagegen jeweils 100 % SVR12 (Gane EJ et al., #73; Lawitz E et al., #215).
Nach Tripletherapieversagen
Die Kombination Sofosbuvir/Ledipasvir (NS5B-Polymerasehemmer, NS5A-Inhibitor), die als Fixkombination entwickelt
wird, wirkt auch nach Tripletherapieversagen. An der Studie LONESTAR nahmen Patienten mit GT1 teil, nämlich
Therapienaive ohne Zirrhose (n=60) sowie Vorbehandelte nach Versagen eines Boceprevir- bzw. Telaprevir-basierten Regimes
(n=62). 58/60 (97 %) der Therapienaiven erreichten nach 8-12 Wochen Behandlung die SVR12 sowie bei den vorbehandelten
Therapieversager 39/40 (98 %) und 21/22 Patienten (95 %) derer mit Zirrhose nach 24 Wochen Behandlung (Abbildung 8). 9 %
der früheren Versager hatten NS5A-Mutationen, 7/9 dieser Patienten wurden geheilt.
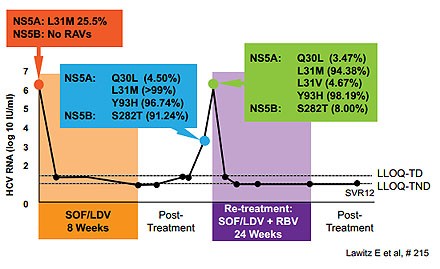 Abbildung 9: LONESTAR: Ein Patient mit Relaps 4 Wochen nach Therapieende
und der primären Sofosbuvir-Mutation S282T wurde gleich wieder behandelt und erreichte nach 24 Wochen die SVR12
Abbildung 9: LONESTAR: Ein Patient mit Relaps 4 Wochen nach Therapieende
und der primären Sofosbuvir-Mutation S282T wurde gleich wieder behandelt und erreichte nach 24 Wochen die SVR12
Bei insgesamt vier Patienten kam es zum Relaps. Ein Patient, der 8 Wochen behandelt worden war, und bei dem der Relaps innerhalb von vier Wochen nach Therapieende auftrat, hatte die primäre Sofosbuvir-Mutation S282T entwickelt. Er wurde erneut mit Sofosbuvir/Ledipasvir behandelt und zwar diesmal über 24 Wochen und erreichte eine SVR (Abbildung 9).
Auch mit einer anderen Kombination mit den gleichen Substanzklassen hat dieses Konzept funktioniert. Und zwar führte Sofosbuvir/Daclatasvir mit/ohne Ribavirin über 24 Wochen ebenfalls bei Tripletherapieversagern zu einer SVR4 von 100 % (Sulkowski M et al., EASL 2013 #1417). Diese Kombination hat allerdings den Schönheitsfehler, dass beide Substanzen von unterschiedlichen Firmen hergestellt werden und Gilead Sciences die zuerst genannte Fixkombination mit zwei Substanzen aus dem eigenen Haus entwickelt.
Das Rennen geht weiter
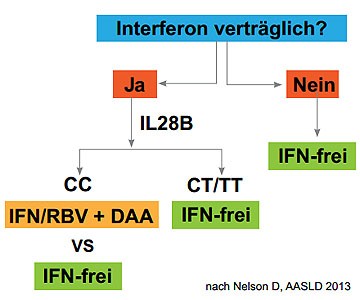 Abbildung 10: Therapie mit oder ohne Interferon?
Abbildung 10: Therapie mit oder ohne Interferon?
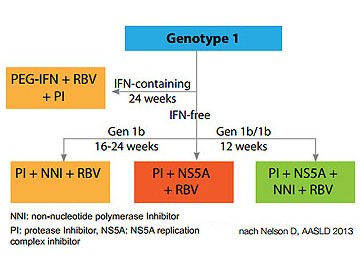
Abbildung 11: Strategien bei Genotyp 1
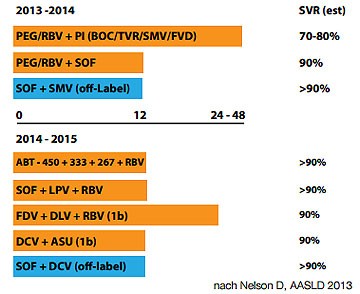
Abbildung 12: SVR12-Raten bei Genotyp 1 bei verschiedenen DAA-Kombinationen. Keine direkten Vergleichsstudien. Unterschiedliche Patientenpopulationen, meist naive Patienten ohne Zirrhose
Nicht nur Gilead Sciences, auch andere Unternehmen wie Boehringer Ingelheim, Bristol-Myers Squibb, MSD und AbbVie
usw. entwickeln mit Hochdruck Interferon-freie Regime mit mehreren Substanzen aus dem eigenen Unternehmen.
Faldaprevir/Deleobuvir (Proteasehemmer/nicht-nukleosidischer NS5B-Inhibitor) plus Ribavirin über 16 Wochen führten in
SOUND-C3 bei Patienten mit GT1b (inklusive kompensierte Zirrhose) bei 95 % zur SVR12 (Dufour JF et al., #1102).
Daclatasvir/Asunaprevir (Proteasehemmer/NS5A-Inhibitor) ohne Ribavirin über 24 Wochen führte bei
Nonrespondern/IFN-Kontraindikationen und GT1b bei 80 % bzw. 87 % zur SVR (Chayama K et al., #211). Und unter einer
ähnlichen Kombination MK-5172/MK-8742 (Proteasehemmer/NS5A-Inhibitor) mit und ohne Ribavirin über 24 Wochen erreichten
in C-WORTHY 90-100 % der Therapienaiven GT1 ohne Zirrhose die SVR12 (Lawitz E et al., #76). Zudem laufen noch zahlreiche
Studien mit Kombinationen von drei DAA (Direct Antiviral Agents) mit/ohne Ribavirin. Die Therapiedauer liegt hier
zwischen sechs und 12 Wochen, die SVR-Raten bei über 90 % und die Verträglichkeit ist gut. Angesichts der kurzen
Therapiedauer und des hohen Konkurrenzdrucks könnten solche Regime bereits 2015 zur Verfügung stehen.
Therapiealgorithmen
Das Gefühl, alle Patienten heilen zu können, festigt sich. Offen ist allerdings, welches Regime für welchen Patienten
das Beste ist. Dennoch muss der behandelnde Arzt in absehbarer Zeit entscheiden, ob und wie er seine Patienten behandeln
will. David Nelson aus Gainesville, Florida, hat daher auf dem Kongress schon mal einen ersten Algorithmus beim Genotyp
1 vorgestellt (Abbildung 10). Danach kommt eine Interferon-haltige Therapie nur für Patienten in Frage, die Interferon
vertragen und den ILB28B CC-Genotyp haben. Alle anderen sollten Interferon-frei behandelt werden. In diesem Fall muss
man sich entscheiden, ob man eine Therapie mit oder ohne Nukleosiden machen will (Abbildung 11 und 12).
Hepatitis B
Das Thema Hepatitis B war auf dem diesjährigen Liver Meeting an den Rand gedrängt. Neuartige Substanzen gibt es nicht, wohl aber den Nachfolger von Tenofovir. Das Prodrug Tenofovir Alafenamid (TAF), das weniger Einfluss auf die Nierenfunktion hat, erwies sich in einer frühen Phase auch bei chronischer Hepatitis B als wirksam (Agarwal K et al., #973).
Die Gefahr einer Hepatitis B-Reaktivierung wurde schon bei der letzten Aktualisierung der deutschen Leitlinien betont. Wie wichtig dies ist, zeigt eine Beobachtung aus Hongkong. Dort kam es bei 25% der Patienten (n=62) mit hämatologischer Grunderkrankung und Rituximab-Therapie meist innerhalb von 6 Monaten zur Reaktivierung. Niedrige Anti-HBs-Spiegel von weniger als 100 IU/ml waren ein signifikanter Prädiktor (Seto WK et al., #34).






