Kilian
Weigand, Regensburg
Genotyp 3 – Wie geht’s weiter?
Vieles tut sich im Bereich der Therapie der chronischen Hepatitis C Virus (HCV) Infektion und wir schauen immer besseren, kürzeren und nebenwirkungsärmeren Therapien entgegen. Über diesen ganzen Enthusiasmus darf man zwei Dinge nicht vergessen. Erstens wird es immer komplizierter, den Überblick zu bewahren, für welchen Patienten welche Therapie sinnvoll und kosteneffektiv ist. Zum anderen hat sich der Genotyp 3 (GT 3) als der neue „schwer zu therapierende“ Genotyp herausgestellt, da er deutlich schlechter als der Genotyp 2 auf viele der neuen Therapien anspricht und viele der neuen Medikamente nicht beim GT 3 wirken.
Daher muss man sich zunächst die Wirksamkeit der einzelnen
Substanzklassen für die Therapie des GT 3 der chronischen Hepatitis C-Infektion
betrachten. Was bleibt, ist natürlich das pegylierte Interferon, welches durch
seine immunmodulatorische Wirkung in den letzten 10 Jahren die Grundlage jeder
HCV-Therapie war. Altbekannt, aber auch Teil fast jeder der kommenden Therapien
ist und bleibt das Ribavirin, dessen genaue Wirkungsweise immer noch nicht
entschlüsselt ist. Was wir neu lernen müssen, ist die Vielzahl der
hinzukommenden direkt antiviral wirksamen Substanzen (DAAS – Direct-Acting
Antivirals). Hier sind primär die Protease-Inhibitoren (PIs) zu nennen, zu
denen auch Boceprevir und Telaprevir gehören. Allen diesen PIs („-previr“) ist
gemeinsam, dass sie wenig bis keine Aktivität beim GT 3 aufweisen. Demgegenüber
stehen die NS5A-Inhibitoren („-asvir“) sowie die nukleosidischen und
nicht-nukleosidischen NS5B-
Polymeraseinhibitoren („-buvir“), die meist eine pangenotypische Wirksamkeit
aufweisen und auch zur Behandlung des GT 3 geeignet sind. Bekanntester
Vertreter ist hier der nukleosidische Polymeraseinhibitor Sofosbuvir (SOF),
über dessen Zulassung in den USA die FDA am 08.12.2013 entscheidet. Damit ist
SOF der erste zugelassene Vertreter seiner Wirkklasse. Auch in Europa wird aufgrund
des beschleunigten Zulassungsverfahrens eine Zulassung für Anfang 2014 zu
erwarten sein. Daneben gibt es mit Alisporivir und BIT-225 zwei weitere
Substanzklassen, die andere Zielsubstanzen angreifen und eine Wirksamkeit gegen
den GT 3 aufweisen.
Duale Standardtherapie
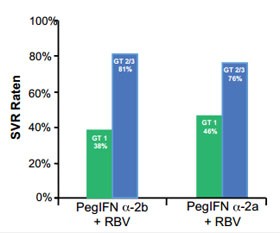 Abbildung 1: Die beiden wegweisenden Studien in der Behandlung der HCV von Manns et al. 2001 im Lancet und Fried et al. 2002 im N Engl J Med publiziert. Sie zeigen durch die Therapie mit PegIFN und RBV beim GT 3 eine SVR Rate von um die 80%. Seither ist dies die SOC-Therapie bei der Behand-lung von Patienten mit einer HCV GT 3-Infektion.
Abbildung 1: Die beiden wegweisenden Studien in der Behandlung der HCV von Manns et al. 2001 im Lancet und Fried et al. 2002 im N Engl J Med publiziert. Sie zeigen durch die Therapie mit PegIFN und RBV beim GT 3 eine SVR Rate von um die 80%. Seither ist dies die SOC-Therapie bei der Behand-lung von Patienten mit einer HCV GT 3-Infektion.
Bis zur Zulassung von SOF in Deutschland steht hierzulande lediglich die bisherige Therapie aus pegyliertem Interferon (PegIFN) und Ribavirin (RBV), die sogenannte Standard-of-Care (SOC) Therapie zur Verfügung. Die überlegene Wirksamkeit dieser Kombination in der Behandlung der HCV wurde in den beiden wegweisenden Studien von Manns et al. in Lancet 2001 und Fried et al. im New Engl J Med 2002 publiziert. Hier zeigten sich SVR Raten beim GT 3 von um die 80 % (Abb. 1). Seither ist diese Therapie über 24 Wochen beim GT 3 die SOC Therapie. In den letzten 10 Jahren gab es zum GT 3 dann auch nicht viel Neues. Es wurde noch gezeigt, dass bei einer Ausgangsviruslast < 600.000-800.000 IU/ml und dem Erreichen einer nicht nachweisbaren Viruslast zu Therapiewoche 4 eine Therapieverkürzung auf 16 Wochen durchgeführt werden kann. Eine weitere Verkürzung auf 12 Wochen hat sich aufgrund schlechterer SVR-Raten nie wirklich durchgesetzt. Kritisch betrachtet zeigte sich dabei auch erstmals, dass GT 3 und GT 2 nicht gleichwertig betrachtet werden können. Ansonsten gab es jedoch in den letzten Jahren wenig bis keine Veränderung bei der Behandlung von GT 3-Patienten.
Sofosbuvir und Genotyp 3
Viel erhofft man sich von der Interferon-freien Therapie: Therapieverkürzung, geringere Nebenwirkungen, eine höhere SVR-Rate und eine Therapieoption für vorbehandelte und /oder schwer zu therapierende Patienten. Doch was können wir erwarten?
Bei Sofosbuvir (SOF) handelt es sich wie oben erwähnt um einen nukleosidischen NS5B-Polymeraseinhibitor mit pangenotypischer Wirksamkeit. SOF hat eine sehr hohe Resistenzbarriere und in den bisherigen Studien wurde bei keinem GT 3- Patienten die bekannte HCV-Resistenzmutation (S282T) gefunden. Sofosbuvir wird als 400 mg Tablette einmal täglich verabreicht. Da es renal ausgeschieden wird und keinen Cyp3A /4-Metabolismus aufweist, sind wenige Medikamenteninteraktionen zu erwarten, was es auch für den Einsatz zum Beispiel bei lebertransplantierten Patienten geeignet macht. Keine Daten gibt es bislang jedoch für Patienten mit fortgeschrittener Niereninsuffizienz. Aufgrund der renalen Elimination sind hier jedoch Schwierigkeiten zu erwarten. Ansonsten hat sich SOF bei bislang über 3000 behandelten Patienten in den Studien als sicher und gut verträglich gezeigt.
FUSION, FISSION und POSITRON
| Studie | Studienpopulation | Patienten
Anzahl | Anteil an Patienten mit Zirrhose | Thrombozyten-
Untergrenze |
|---|---|---|---|---|
| FISSION | GT 2 & 3
Ohne Vortherapie | 499 | 20% | >= 75.000/mm³ |
| FUSION | GT 2 & 3
Mit Vortherapie | 201 | 34% | >= 50.000/mm³ |
| POSITRON | GT 2 & 3
IFN-Therapie nicht möglich | 278 | 16% | keine |
| VALENCE | GT 2 & 3
Mit & Ohne Vortherapie | 323 | 21% | >= 50.000/mm³ |
| PHOTON 1 | GT 1-3
Ohne Vortherapie, HIV Koinfektion | 182 | 7% | keine |
| LONESTAR-2 | GT 2 & 3
Mit Vortherapie, mit & ohne Zirrhose | 47 | 55% | NA |
Tabelle 1: Übersicht über die Studien mit SOF beim GT 3
Tabelle 1 und Abbildung 2 zeigen eine Übersicht der Studien, die
im nachfolgenden vorgestellt werden. FISSION und FUSION sind die primären
Zulassungsstudien von SOF mit einem IFN-freien Behandlungsschema beim GT 2
& 3. Eine kumulative Übersicht der Studien-
ergebnisse zur Therapie mit SOF zeigt die Abbildung 3.
In die FISSION-Studie wurden Patienten ohne Vortherapie
eingeschlossen. In die FUSION-Studie wurden Patienten eingeschlossen, die
bereits eine nicht erfolgreiche HCV-Therapie erhalten hatten, wobei es nicht
entscheidend war, ob die Patienten Non-Responder oder Relapser in der
Vortherapie waren. Während sich für den GT 2 exzellente Heilungsraten zeigten,
waren die Ergebnisse für den GT 3 bei einer Therapiedauer von 12 Wochen
enttäuschend. Gegenüber der SOC- Therapie fand sich in der FISSION-Studie
lediglich eine SVR12 von 61 %. Bei Patienten mit einer
Zirrhose lag das Ergebnis bei nicht vortherapierten Patienten noch deutlich
schlechter. Allerdings konnte bei der FUSION-Studie noch gezeigt werden, dass
die Verlängerung der Therapie von 12 auf 16 Wochen die SVR12-Rate signifikant
erhöht, insbesondere auch bei Patienten mit vorbestehender Zirrhose. So lag bei
diesen vorbehandelten Patienten die SVR12-Rate nach 16 Wochen Therapie bei
Patienten ohne Zirrhose bei 63 %, bei Patienten mit
Zirrhose bei 61 %. In beiden Studien zeigte
sich eine Nichtunterlegenheit der rein oralen Kombination aus SOF und RBV
gegenüber der SOC-Therapie, was als Erfolg gewertet wurde. Zudem gab es
deutlich weniger Nebenwirkungen als bei der interferonhaltigen Therapie. Das Sicherheitsprofil war mit maximal 1 % Studienabbrechern sehr gut. Die POSITRON-Studie ist vom
Design her mit der FISSION-Studie vergleichbar. Auch hier wurden therapienaive
Patienten über 12 Wochen mit SOF und RBV behandelt. Das Interessante an dieser
Studie ist, dass dazu Patienten ausgewählt wurden, die aus den verschiedensten
Gründen für eine Interferon-Therapie nicht in Frage kamen und dadurch aktuell
keine Therapieoptionen hatten. Durch diesen Kunstgriff konnte eine Studie
durchgeführt werden, die SOF/RBV gegen Placebo verglich und nicht gegen die
SOC-Therapie. In POSITRON fand sich beim GT 3 eine SVR12-Rate von 68 % bei
Patienten ohne Zirrhose und von 21 % bei Patienten mit
Zirrhose. Insofern wurden die Ergebnisse von FISSION bestätigt. Auch hier
zeigte sich ein sehr gute Verträglichkeit und Sicherheitsprofil mit einer
Studien-Abbruchrate von 2 %.
 Abbildung 2: . Übersicht der Studien mit SOF zu den Genotypen 2 & 3. Betrachtet wurde jeweils die SVR12, als die SVR-Rate zu Woche 12 nach Therapieende. SOF wurde in allen Studien mit 400 mg einmal täglich verabreicht, Ribavirin mit 1000-1200 mg/d und in LONESTAR 2 wurde PegIFN mit 180 µg/Woche dosiert.
Abbildung 2: . Übersicht der Studien mit SOF zu den Genotypen 2 & 3. Betrachtet wurde jeweils die SVR12, als die SVR-Rate zu Woche 12 nach Therapieende. SOF wurde in allen Studien mit 400 mg einmal täglich verabreicht, Ribavirin mit 1000-1200 mg/d und in LONESTAR 2 wurde PegIFN mit 180 µg/Woche dosiert.
VALENCE
Aufgrund der schlechten Ergebnisse beim GT 3 gegenüber dem GT 2 bei einer Therapiedauer von 12 Wochen wurde in Europa die VALENCE-Studie durchgeführt. In dieser wurden GT 2-Patienten wie bisher über 12 Wochen, Patienten mit dem GT 3 aber über 24 Wochen mit 400 mg /d SOF und 1000-1200 mg /d RBV behandelt, davon 21 % mit vorbestehender Zirrhose. Insgesamt wurden 250 Patienten mit GT 3 eingeschlossen. Primärer Endpunkt dieser Phase 3-Studie, die sowohl Patienten mit (58 %) als auch ohne (42 %) Vortherapie einschloss, war wie gehabt die SVR12-Rate. 94 % der Patienten waren Kaukasier und 62 % männlich. Das Durchschnittsalter lag bei 48 Jahren. Durch die Therapieverlängerung auf 24 Wochen konnte bei den GT 3-Patienten insgesamt eine SVR12 von 85% gefunden werden. Die Ergebnisse der Subgruppen sind in Abbildung 3 aufgeführt. Lediglich die vortherapierten Patienten mit Leberzirrhose lagen mit einer SVR12-Rate von 60 % nur im mittleren Bereich. Ansonsten erreichten die anderen Subgruppen Heilungsraten um die 90 %. Alle Patienten hatten zu Therapiewoche 4 keine nachweisbare Viruslast mehr und bei den Therapieversagern kam es zu einem Relapse nach Ende der Therapie. Auch in dieser Studie fand sich bei den Patienten ohne SVR12 keine S282T Mutation. Die Abbruchrate lag < 1 % womit sich auch bei längerer Therapiedauer ein sehr gutes Sicherheitsprofil zeigte.
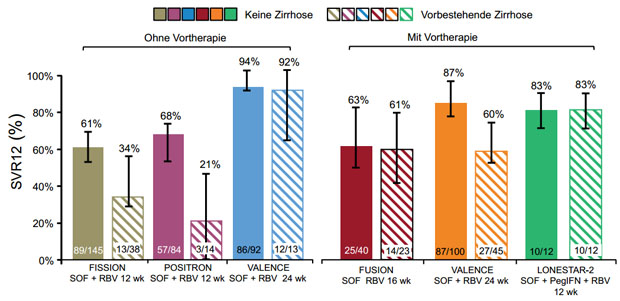 Abbildung 3:Kumulative Übersicht der Studien-Ergebnisse zu den Therapien mit SOF beim Genotyp 3. Betrachtet wurde jeweils die SVR12, als die SVR-Rate zu Wo-che 12 nach Therapieende. SOF wurde in allen Studien mit 400 mg einmal täglich verabreicht, Ribavirin mit 1000 -1200 mg/d und in LONESTAR 2 wurde PegIFN mit 180 µg/Woche dosiert. HCV GT 3-Patienten, die mit SOF + RBV für 24 Wochen oder SOF + RBV + PegIFN für 12 Wochen therapiert wurden, erreichten hohe SVR12- Raten, unabhängig davon ob eine Vortherapie durchgeführt worden war oder eine Leberzirrhose bestand.
Abbildung 3:Kumulative Übersicht der Studien-Ergebnisse zu den Therapien mit SOF beim Genotyp 3. Betrachtet wurde jeweils die SVR12, als die SVR-Rate zu Wo-che 12 nach Therapieende. SOF wurde in allen Studien mit 400 mg einmal täglich verabreicht, Ribavirin mit 1000 -1200 mg/d und in LONESTAR 2 wurde PegIFN mit 180 µg/Woche dosiert. HCV GT 3-Patienten, die mit SOF + RBV für 24 Wochen oder SOF + RBV + PegIFN für 12 Wochen therapiert wurden, erreichten hohe SVR12- Raten, unabhängig davon ob eine Vortherapie durchgeführt worden war oder eine Leberzirrhose bestand.
LONESTAR 2
In der LONESTAR 2 Studie wurde der Effekt einer Kombinationstherapie von SOF und RBV mit PegIFN über 12 Wochen bei GT 2 und 3 Patienten mit Vortherapie untersucht. Auch hier war der überwiegende Anteil der Patienten kaukasischer Abstammung (96 %) und männlich (68 %). Insgesamt wurden in dieser Studie 24 Patienten mit GT 3 behandelt, wovon 12 (50 %) eine vorbestehende Zirrhose hatten. Die SVR12-Rate lag bei den Patienten mit GT 3 bei 83 %, unabhängig davon, ob eine Zirrhose vorlag oder nicht (Abb. 3). Auch hier war das Sicherheitsprofil mit einer Abbruchrate von 2 % gut.
Verträglichkeit
In allen genannten Studien gab es sehr wenige schwerwiegende Nebenwirkungen. Die hauptsächlichen Nebenwirkungen waren bei den IFN-freien Therapien Kopfschmerzen, Müdigkeit, Juckreiz und Anämie. Wenige Fälle vielen durch eine Hyperbilirubinämie auf. Insgesamt waren die Nebenwirkungen konsistent zu den Nebenwirkungen, die bei einer RBV-Therapie zu erwarten sind, so dass SOF als sehr sicher und gut verträglich angesehen werden kann. Auch in Kombination mit IFN kam es nicht zu einer höheren Nebenwirkungsrate als in den SOC-Therapiegruppen.
Fazit
Zusammengefasst kann also die Therapie mit SOF als gut verträgliche und sichere Therapie angesehen werden. Der initiale Enthusiasmus lässt sich beim GT 3 jedoch nicht halten. Eine Therapieverkürzung ohne Interferon führt nicht zu besseren Heilungsraten, so dass, insbesondere bei Patienten mit vorbestehender Leberzirrhose, eine Therapiedauer von 24 Wochen bleiben dürfte. Lediglich in der Kombination mit Interferon ist eine Therapieverkürzung wahrscheinlich möglich, was natürlich wiederum zu Lasten der Verträglichkeit geht.
Dennoch trotz stellt SOF die lang ersehnte Möglichkeit dar, Patienten mit dem GT 3 Interferon-frei zu behandeln. Ferner ist es für alle Patienten, die bislang aufgrund einer IFN-Unverträglichkeit oder gescheiterten Vortherapie keine sinnvolle Therapieoption mehr hatten, eine große Hoffnung. Abzuwarten bleibt jedoch, wie die Zulassung für SOF bei uns aussehen wird. Relativ sicher scheint, dass es sowohl mit als auch ohne PegIFN verabreicht werden kann. Ob dies auch für den GT 3 zutreffen wird und ob eine Verlängerung der Therapiedauer beim GT 3 auf 24 Wochen möglich sein wird, bleibt aktuell noch offen. Es bleibt jedoch zu hoffen, dass eine möglichst breite Zulassung kommt um alle Möglichkeiten der Therapie zu haben.
HIV/HCV-Koinfektion
Auch für diese Patienten wurden auf
dem Amerikanischen Leberkongress (AASLD) im November dieses Jahres neue Daten
zu Sofosbuvir gezeigt. In der PHOTON 1 -Studie wurden koinfizierte Patienten
mit stabiler HIV-Infektion mit SOF und RBV behandelt. Dabei wurden
HCV-therapienaive GT 3-Patienten über 12 Wochen behandelt. Die Dosis war wiederum
400 mg/d SOF plus 1000-1200 mg/d RBV. Es war eine große Bandbreite an
antiretroviralen Therapien erlaubt (Tenofovir/Emtricitabin plus Efavirenz,
Atazanavir/r, Darunavir/r, Raltegravir, Rilpivirin und andere). Die SVR12-Rate
lag in dieser GT3-Gruppe bei 67 %, also ähnlich zu den
Ergebnissen in der FISSION-Studie. Erneut fand sich keine S282T-Mutation bei
den Therapieversagern und das Sicherheitsprofil war sehr gut. Eine
Beeinträchtigung der HIV-Therapie fand sich nicht.
In einer kleinen Pilotstudie, der 1910-Studie, erhielten koinfizierte Patienten eine Dreifachtherapie aus SOF, RBV und PegIFN. Hier fand sich, bei allerdings nur 2 Patienten mit dem GT 3, eine SVR12-Rate von 100 %.
Sofosbuvir scheint auch bei koinfizierten Patienten eine gute und sichere Therapieoption zu sein, wobei eine Verkürzung der Therapiedauer bei einem Interferonfreien Regime nicht sinnvoll erscheint, da dies zu Lasten der Heilungsrate geht.
Lebertransplantation
Eines der Hauptprobleme nach Lebertransplantation ist die sehr häufige und oft rasche Reinfektion der transplantierten Leber. So findet sich bei einem Großteil der Patienten sechs Monate nach Lebertransplantation (LTPL) bereits eine Reinfektion mit HCV. Zu diesem Thema wurden auf der AASLD-Tagung zwei kleine Pilotstudien vorgestellt. In der einen Untersuchung wurden Patienten vor LTPL bis zur Transplantation mit SOF und RBV behandelt. Zum Zeitpunkt der LTPL fand sich 94 % der Patienten keine nachweisbare Viruslast und 12 Wochen nach LTPL fand sich bei 64 % der Patienten keine HCV-Viruslast. Damit konnte durch eine Therapie vor LTPL bei 2/3 der Patienten die HCV-Infektion vor LTPL noch geheilt werden. Die zweite Studie untersuchte die Therapie mit SOF und RBV nach LTPL über 24 Wochen. Auf der AASLD konnten nur SVR4-Raten gezeigt werden, diese lagen aber immerhin bei 77 %. In beiden Studien zeigte sich eine gute Verträglichkeit. Interaktionen mit der Immunsuppression nach der LTPL wurden nicht beobachtet.
Die Zukunft
SOF scheint eine gute Möglichkeit für GT 3-Patienten darzustellen. Aber es zeigen sich bereits heute schwerer zu therapierende Subgruppen, die auch unter der Therapie mit SOF keine Heilung erreichen – selbst wenn zusätzlich noch PegIFN verwendet wird. Was erwartet uns für diese Patienten in der Zukunft?
Derzeit laufen sehr viele Studien mit der Kombination verschiedener DAAs. Insbesondere nach den initial etwas enttäuschenden Ergebnissen beim GT 3 werden solche Kombinationen nun verstärkt bei Patienten mit diesem Genotyp geprüft, so dass es auf der AASLD dieses Jahr hierzu einige neue Daten gab.. So zeigen zum Beispiel die pangenotypisch wirksamen NS5A-Inhibitoren Daclatasvir (DCV), Ledispasvir (LDV), ABT-267 und MK-8742 eine gute Wirksamkeit beim GT 3, insbesondere in Kombination mit Polymeraseinhibitoren wie SOF, BMS-791325 und ABT-333. Ferner sind einige Proteaseinhibitoren mit Aktivität gegen GT3 wie zum Beispiel ABT-450/r in Phase -2/3-Studien in Kombination mit anderen DAAs. Weitere Proteaseinhibitoren, NS5A-Inhibitoren und Polymeraseinhibitoren mit Aktivität gegen den GT 3 ebenfalls sind in Entwicklung.
Eine weitere interessante Substanz ist Alisporivir. Diese Substanz verhindert die Interaktion von Cyclophilin A und NS5A und blockiert damit den Replikationszyklus von HCV. Auch Alisporivir weist eine pangenotypische Wirksamkeit auf und ist beim Genotyp 3 deutlich wirksam. Insbesondere mit NS5A-Inhibitoren scheint die Substanz eine starke synergistische Aktivität zu entfalten. BIT225 blockiert das hoch konservierte p7-Protein von HCV. Hier zeigte eine Pilotstudie auf der AASLD auch eine Wirksamkeit beim GT 3.
Man wird sich in Zukunft also mit diesem ganzen Portfolio an DDAs auseinandersetzten müssen und in Zukunft auch bei Patienten mit HCV GT 3-Infektion eine Vielzahl an Kombinationsmöglichkeiten zur Hand haben, die man den schwierig zu therapierbaren Patienten anbieten kann. Ob in diesem ganzen Enthusiasmus dann letztlich das PegIFN doch noch einen Stellenwert haben wird, bleibt abzuwarten, ist aber durchaus noch möglich ,wie die jüngste Entwicklung in der Therapie des GT 3 zeigt.





