Erich Lotterer, Wetzlar
Spontane bakterielle Peritonitis
Die durch die Komplikation der Grunderkrankung schon bestehende reduzierte Lebenserwartung der Patienten mit Leberzirrhose wird durch interkurrente Infektionen und insbesondere durch die spontane bakterielle Peritonitis (SBP) noch weiter verschlechtert. Nach einer aktuellen Studie beträgt die mediane Mortalität der infizierten Patienten 30,3 % nach einem Monat und 63 % nach einem Jahr. Die Odds-Ratio für Tod bei infizierten versus nicht infizierten Patienten liegt bei 3,75. Bei Patienten mit SBP zeigen sich nahezu identische Zahlen.
Ursachen der gehäuften bakteriellen Infektionen bei Leberzirrhose
- Verminderte Phagozytoseaktivität des RES durch portocavaleShunts und reduzierte Kupfferzellfunktion
- Verminderung von Komplement im Serum (und Aszites)
- Gestörte Funktion der neutrophilen Granulozyten (Phagzytose,intrazelluläres „Killing“, metabolische Aktivität)
- Verminderte Opsonierungsfähigkeit (Blut, Aszites)
- Gesteigerte Permeabilität der intestinalen Barriere für enterischeKeime
- Modulation der intestinalen und peripheren Durchblutung,Barriere und Leberfunktion durch Mediatoren (z.B. NO)
- Invasive Maßnahmen (endoskopische Therapie, zentraler Venenkatheter,Blasenkatheter)
Tabelle 1
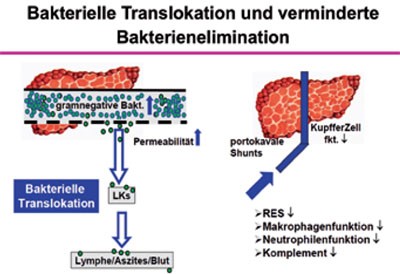
Abbildung 1
Pathophysiologie
Als wesentliche Ursachen der gehäuften bakteriellen Infektion bei Leberzirrhose wurden eine reduzierte Phagozytoseaktivität des retikuloendothelialen Systems aufgrund der portocavalen Shunts und der reduzierten Kupferzellfunktion, eine Verminderung von Komplement im Serum und Aszites, eine gestörte Funktion der neutrophilen Granulozyten sowie eine reduzierte Opsonierungsfähigkeit beschrieben. Von Bedeutung ist dabei auch eine erhöhte Permeabilität der in-testinalen Barriere für enterische Keime, die teilweise durch die NO-induzierte Modulation der intestinalen und peripheren Durchblutung bedingt ist. Auch spielen invasive Maßnahmen, die gehäuft bei diesen Patienten durchgeführt werden, eine Rolle (Abbildung 1, Tabelle 1).
Eine erhöhte Permeabilität der Mukosa führt zur Translokation von Bakterien und deren Abbauprodukten, gefolgt von einer Typ-I-Immunantwort peritonealer Makrophagen mit dann gesteigerter lokaler Synthese verschiedener Zytokine (Interleukin (IL)-2, IL-6, IL-12, TNFα, Interferon-γ) und weiterer Effektormo-leküle (zum Beispiel NO) im Aszites (-> Quotient in der Größenordnung von 100 zwischen Aszites und Plasma für verschiedenste Zytokine bei Patienten mit Leberzirrhose).
Bakterielle DNA in der systemischen Zirkulation ist mit einer Verstärkung der peripheren Vasodilatation als Ursache der hyperdynamen Zirkulation bei Leberzirrhose und einer Verschlechterung der intrahepatischen Endothel- dysfunktion assoziiert. Diese Ergebnisse bestätigen die entscheidende Rolle der bakteriellen Translokation für die Entstehung der zirkulatorischen Fehlfunk tionen bei Zirrhose.
Tierexperimentelle Untersuchungen an
zirrhotischen Ratten mit Aszites und SBP bestätigten, dass die bakterielle
Translokation mit dem gleichzeitigen Vorhandensein einer erhöhten Permeabilität
und einer bakteriellen Fehlbesiedlung im Darm assoziiert war. Letztere
korrelierte wiederum mit einer verzögerten Darmtransitzeit. Die Gabe von
Propranolol in einer den Pfortaderdruck nicht senkenden Dosierung führte zu
einer signifikanten Reduktion der bakteriellen Translokation, der bakteriellen
Überwucherung und der Häufigkeit einer SBP. Es fand sich kein wesentlicher
Effekt auf die Permeabilität, während der intestinale Transit durch Propranolol
drastisch gesteigert wurde (Tabelle 2).
| Einfluss von Propranolol auf die bakterielle Translokation bei Ratten mit Zirrhose und Aszites (28) | ||
|---|---|---|
| Placebo | Pro-
pranolol | |
| n | 12 | 12 |
| Pfortaderdruck (mmHg) | 21 ± 4 | 21 ± 4 |
| Bakterielle Translokation (%) | 58 | 15* |
| SBP (%) | 33 | 8* |
| Bakterielle Überwucherung (%) | 67 | 15* |
| Transit
( 51Cr-Verteilung) | 0,23 | 0,44* |
| Permeabilität (% Urinausschei- dung) | 16 ± 7 | 20 ± 8 |
Tabelle 2
(* = signifikant)
In einer aktuellen Metaanalyse von 3 randomisierten und 3 retrospektiven Studien zur Primär- und Sekundärprophylaxe der Varizenblutung mit ß-Blockern zeigte sich ein statistisch signifikanter Vorteil in Höhe von 12,1 % (p < 0,001) zugunsten von Propranolol für die Prävention einer SBP. In einer Sensitivitätsanalyse, welche nur die randomisierten Studien berücksichtigte, wurde dies mit einem Unterschied von 7,8 % bestätigt. Der Effekt war nicht abhängig vom hämodynamischen Ansprechen auf den ß-Blocker, gemessen an der Reaktion auf den Lebervenendruckgradienten.
Prävalenz
Die Angaben zur Prävalenz der SBP sind sehr unterschiedlich und reichen von ca. 10 % aller Patienten mit Aszites in Deutschland bis zu 30 % bei mangel- ernährten Patienten mit alkoholischer Leberzirrhose und Aszites in Südkali- fornien.
Definition
Die spontane bakterielle Peritonitis (SBP) ist definiert als die Infektion eines Aszites (= conditio sine qua non) meist auf dem Boden einer portalen Hypertension bei Leberzirrhose ohne intestinale Läsion (d.h. keine Verletzung der Integrität oder direkte Infektion eines intraabdominellen Organs als Ursache der Peritonitis). Zusätzlich ist entweder der Nachweis von Keimen oder einer Neutrophilenzahl ≥ 250/mm3 bzw. einer Leukozytenzahl ≥ 500/mm3 erforderlich. In ca. 80 % der Fälle werden gramnegative Keime (häufigster Erreger: E. coli, Klebsiella-Spezies und Enterococcus faecalis), in ca. 20 % grampositive Bakterien, am häufigsten Streptokokken-Spezies, und Anaerobier in weniger als 5 % der Fälle nachgewiesen. Über 90 % aller SBP sind mono- mikrobiell.
Ein zunehmendes Problem stellen die nosokomial erworbenen SBP dar. Hier zeigt sich im Vergleich zur ambulant erworbenen SBP eine signifikante Verschiebung hin zu grampositiven Keimen sowie ein hoher Anteil an resistenten Keimen gegen Cephalosporine der 2. und 3. Generation sowie gegen Chinolone.
Drei Varianten
| Formen der SBP bei Patienten mit Leberzirrhose | |||
|---|---|---|---|
| (%) Referenz | Häufigkeit 10 / 9 | Symptome 10 / 9 | Mortalität 10 / 9 |
| Komplette SBP | 9 / 12 | 100 / 67 | 42 / 55 |
| Bacteraszites | 6 / 11 | 56 / 71 | 13 / 21 (50) a |
| Neutrozytischer Aszites | 13 / 8 | 76 / 70 | 18 / 43 |
Tabelle 3
a symptomatische Patienten
Prinzipiell werden drei Varianten der SBP unterschieden:
- die komplette SBP mit Nachweis von Keimen und erhöhter Neutrophilenzahl im Aszites;
- der Bacteraszites mit Nachweis von Keimen ohne erhöhte Neutrophilenzahl im Aszites;
- der neutrozytische Aszites, welcher durch eine erhöhte Neutrophilenzahl im Aszites und das Fehlen von Keimen in der Kultur charakterisiert ist.
Diese Varianten der SBP treten mit einer Häufigkeit zwischen 6 und 13 % auf, wobei Symptomatik und Mortalität sehr unterschiedlich sind (Tabelle 3). Patienten mit Bacteraszites bzw. neutrozytischem Aszites weisen im Vergleich zu Patienten mit kompletter SBP seltener Symptome auf und die Mortalität lag unter 20 %.
Nur ca. zwei Drittel der Patienten mit
SBP weisen begrenzt sensitive und spezifische Symptome und Befunde (Fieber,
Schmerzen, abdomineller Druck, Abwehrspannung, Leukozytose) auf. Aber auch ein
Aszites ohne o.g. Symptome sowie jede plötzliche Verschlechterung des
Gesamtzustandes eines Patienten mit Leberzirrhose und (therapierefraktärem)
Aszites (z.B. Neuauftreten bzw. Verschlechterung einer Enzephalopathie,
Rückgang der Urin- und Natriumausscheidung, Verschlechterung der Nieren-
und/oder Leberfunktion) muss an eine SBP denken lassen. Patienten mit einmal
durchgemachter SBP weisen eine schlechtere 1-Jahres-Überlebensrate auf als
Patienten ohne diese Komplikation (43 % versus 14 %).
Risikofaktoren
Eine niedrige Eiweißkonzentration im Aszites (< 10 g/L) gilt als unabhängiger Risikofaktor mit einer Wahrscheinlichkeit für eine SBP von 20 - 43 % innerhalb eines Jahres. Bei einer Eiweißkonzentration im Aszites von > 10 g/L ist die Inzidenz einer SBP im Beobachtungszeitraum von 3 Jahren im Vergleich zu Patienten mit einer Eiweißkonzentration ≤ 10 g/L extrem gering (4 % versus 24 %).
Verschiedene Studien belegen, dass eine Hospitalisation selbst sowie eine Varizenblutung und die dabei durchgeführte endoskopische Diagnostik und Therapie Risikofaktoren für eine SBP darstellen (= 4fach erhöhtes Risiko für eine In- fektion / SBP, wobei die Infektion im Median nach 4 Tagen auftritt). Bei einer Sklerosierungstherapie zeigen sich im Vergleich zur Ligaturbehandlung signifikant höhere Bakteriämie- (17,2 % vs. 3,3 %) und Infektionsraten (v.a. SBP; 18,0 % vs. 1,8 %).
Screening
Bisher gibt es kein einheitliches Vorgehen bezüglich eines systematischen Screenings bei Patienten mit Leberzirrhose und Aszites zur Erfassung einer SBP. Gerade bei ambulant geführten Patienten mit Aszites ist die Frage eines diagnostischen Screenings von Bedeutung. In einer prospektiven Studie trat im mittleren Beobachtungszeitraum von 45 Wochen bei 28 von 109 Patienten erstmalig eine SBP auf. Die multivariate Analyse wies das Serum-Bilirubin (> 3,2 mg/dl bzw. 54,7 μmol/L) und die Thrombozytenzahl (< 98.000/mm3) als unabhängige Risikofaktoren einer erstmaligen SBP aus. Nach Stratifizierung anhand dieser beiden Variablen in eine Hoch- und Niedrigrisikogruppe betrug die Wahrscheinlichkeit für eine erstmalige SBP innerhalb eines Jahres 55 % versus 24 % (p < 0,01) und für das 1-Jahres-Überleben 58 % versus 38 % (p < 0,05). Somit scheinen eine intensive Beobachtung und ein diagnostisches Screening bei Hochrisikopatienten mit Aszites sinnvoll.
Bei nicht-hospitalisierten Patienten mit Zirrhose plus therapierefraktärem Aszites und ohne Infektionsverdacht ist nicht bei jeder Parazentese die Durchführung einer zytologischen Untersuchung (Kultur) des Aszites erforderlich. Eine Bestimmung der Neutrophilenzahl wird jedoch unverändert empfohlen. Dieses differenzierte Vorgehen würde zu einer erheblichen Senkung der Kosten beitragen.
Diagnostik
Eine diagnostische Parazentese zum Ausschluss bzw. Nachweis einer SBP sollte derzeit aufgrund der Empfehlungen internationaler Konsensus-Konferenzen durchgeführt werden bei:
- jeder Hospitalaufnahme (neu auftretender oder bestehender Aszites)
- Infektionszeichen (lokal: abdominelle Schmerzen, Erbrechen, Durchfall, Ileus; systemisch: Fieber, Leukozytose, Sepsis, Schock)
- hepatischer Enzephalopathie
- rascher Verschlechterung der Nierenfunktion ohne eindeutige Ur- sache
- vor prophylaktischer Antibiotika-gabe bei gastrointestinaler Blutung
Bei fehlenden klinischen sowie konventionellen laborchemischen Parametern, welche die Diagnose einer SBP erlauben, stellt der Nachweis einer erhöhten Neutrophilenzahl im Aszites (≥ 250 Neutrophile/mm3 bzw. ≥ 500 Leukozyten/mm3) immer noch die einzige wesentliche, auch kurzfristig nutzbare Information bezüglich des Vorliegens einer SBP dar.
Die Aszitesflüssigkeit (10 ml) sollte zusätzlich zur Anlage einer Kultur di- rekt am Patientenbett in Blutkultur- flaschen eingebracht werden. Die Verwendung spezieller Kultursysteme beschleunigt den Nachweis von Keimen, ist allerdings auch nur in zwei Drittel der Fälle erfolgreich.
Mit Hilfe eines simplen Urin-Streifentests konnte in einer monozentrischen Studie (53 Fälle einer SBP bei 228 Parazentesen) eine Sensitivität von 98 % bei einer Spezifität von 89 % erzielt werden. Leider bestätigte sich dieses Ergebnis nicht in einer großen multizentrischen Studie bei 2123 Parazentesen mit 117 nachgewiesenen SBP-Fällen. Hier zeigte sich lediglich eine Sensitivität von 45 % bei einer Spezifität von 99 %. Somit kann auch aufgrund einer kürzlich publizierten Metaanalyse zu diesem Thema der Einsatz eines Urinstix zum Nachweis einer SBP nicht empfohlen werden.
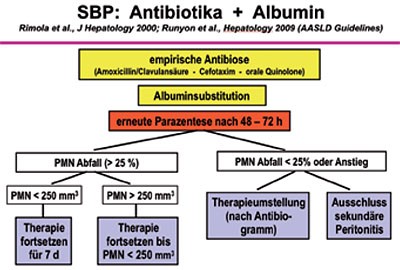
Abbildung 2
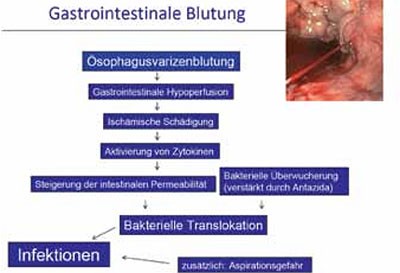
Abbildung 3
| Albumin bei SBP – Einfluss auf Nierenfunktion und Mortalität (34) | ||||
|---|---|---|---|---|
| |
Cefotaxim (n = 63) |
Cefotaxim plus Albumin # (n = 63) |
p | |
| Infektionsfrei | 59 (94 %) | 62 (98 %) | n.s. | |
| Dauer der Antibiotikatherapie (tage) | 6 ± 1 | 5 ± 1 | n.s. | |
| Dauer der Hospitalisation (Tage) | 13 ± 1 | 14 ± 1 | n.s. | |
| Nierenfunktionsstörung | 21 (33 %) | 6 (10 %) | 0,002 | |
| Tod | - Hospital - 3 Monate |
18 (29 %) 26 (41 %) |
6 (10 %) 14 (22 %) |
0,01 0,03 |
Tabelle 4
# Humanalbumin 20 %: 1,5 g/kg KG an Tag 1 und 1,0 g/kg KG an Tag 3
Bei SBP wurden signifikant erhöhte Spiegel von Zytokinen und Adhäsionsmolekülen im Serum und Aszites beschrieben. Diese Parameter spielen jedoch bisher für die Routinediagnostik keine Rolle. Inwieweit das bisher nur bei wenigen Patienten mit SBP prospektiv untersuchte, jedoch innerhalb von 2 Stunden bestimmbare Propeptid Procalcitonin einen zusätzlichen Gewinn in der Diagnostik der SBP bringt, ist noch nicht eindeutig geklärt. Auch der Stellenwert der Bestimmung von Laktoferrin bzw. bakterieller DNA in der Aszitesflüssigkeit muss erst noch weiter untersucht werden, bis hier eine generelle Empfehlung ausgesprochen werden kann.
Therapie
Die Therapie der SBP soll umgehend nach Diagnosestellung (Neutrophilen- bzw. Leukozytenzahl) beginnen und ist letztendlich empirisch. Cephalosporine der 3. Generation sind die Mittel der Wahl (1 x 2 g Ceftriaxon i.v./Tag oder 3 x 2 g Cefotaxim i.v./Tag). Alternativ können Ampicillin-β-Lactamase-Hemmer-Kombinationen oder Fluorchinolone gegeben werden. Vergleiche verschiedener Antibiotika ergaben keinen grundlegenden Unterschied. Von wesentlicher Bedeutung allerdings ist eine Kontrolle des Abfalls der Neutrophilenzahl im Aszites nach 48 (spätestens 72) Stunden. Findet sich hier eine drastische Reduktion der Neutrophilenzahl unter den Grenzwert von 250 Neutrophile/mm3, kann von einem Therapieansprechen ausgegangen werden, eine Reduktion um weniger als 25 % entspricht einem Therapieversagen. Hier ist dann eine Änderung des Therapieregimes erforderlich (Abbildung 2).
Einen besonderen Aspekt stellt die Gabe von Humanalbumin bei der Behandlung der SBP dar. Eine randomisierte, kontrollierte Studie zeigte, dass die Kombination von Cefotaxim und Humanalbumin zu einer deutlichen Reduktion der Nierenfunktionsstörung sowie der Hospitalmortalität und Mortalität nach 3 Monaten führte (Tabelle 4). Der Grund hierfür scheint ein positiver Effekt des Albumins auf die Plasmareninaktivität, welche wesentlich weniger anstieg, zu sein. Auf jeden Fall ergibt sich aus diesen Daten, dass während der Behandlung der SBP eine Reduktion des Plasmavolumens vermieden werden sollte.
Die zusätzliche Gabe von Humanalbumin zur Antibiotikatherapie scheint aufgrund neuer Daten zur Prophylaxe eines Nierenversagens bei Patienten mit Leberzirrhose plus Aszites nicht nur bei der SBP, sondern auch bei Harnwegsinfektionen sowie biliären und gastrointestinalen bakteriellen Infektionen sinnvoll.
Prophylaxe bei gastrointestinaler Blutung
Alle Patienten mit einer oberen gastrointestinalen Blutung weisen ein erhöhtes Risiko für verschiedene bakterielle Infektionen (einschließlich SBP) in den Folgetagen nach der Blutung. Die Entwicklung einer bakteriellen Infektion ist ein prädiktiver Faktor für das Auftreten einer Rezidivblutung innerhalb der ersten Woche und mit einer schlechten Prognose assoziiert (Abbildung 3).
| Antibiotikaprophylaxe bei Patienten mit Leberzirrhose und gastrointestinaler Blutung - Metaanalyse (6) | ||||
|---|---|---|---|---|
|
| Prophylaxe | Placebo | OR | RR |
| frei von Infektionen | 86% | 55% | 4,6% | 32% |
| frei von Bakteriämie und/oder SBP | 92% | 73% | 3,9% | 19% |
| frei von SBP | 95% | 87% | 2,8% | 7% |
| Überleben | 85% | 76% | 1,9% | 9% |
Tabelle 5
5
Studien; Prophylaxe (n = 264), Placebo (n = 270); mittlerer
Beobachtungszeitraum 11,5 ± 2,6 Tage; alle Unterschiede signifikant
Eine Metaanalyse aus fünf Studien zu diesem Thema ergab, dass eine 7- bzw. 10-tägige prophylaktische Gabe von Antibiotika bei Patienten mit Leberzirrhose und gastrointestinaler Blutung mit konsekutiver endoskopischer Intervention signifikant häufiger eine Infektion und auch eine SBP verhindert. Zusätzlich ließ sich auch eine signifikante Verbesserung des Kurzzeit-Überlebens dieser Patienten zeigen (Tabelle 5). Der Vorteil einer solchen Therapie war am größten bei Patienten mit fortgeschrittener Lebererkrankung. Dieses Vorgehen ist heute allgemeiner Standard.
Aufgrund dieser Daten bei Patienten mit
oberer gastrointestinaler Blutung ist deshalb zu diskutieren, eine solche
Prophylaxe bei Patienten mit Aszites und schlechter Leberfunktion auch bei
elektiven endoskopischen Eingriffen durchzuführen.
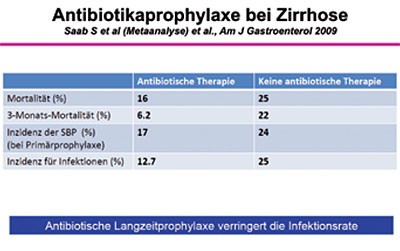
Abbildung 4
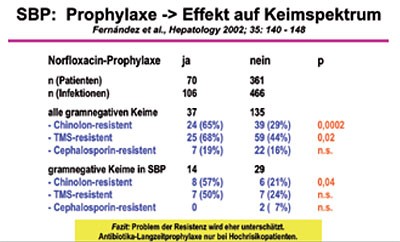
Abbildung 5
Primär- und / oder Sekundärprophylaxe
Die Rezidivrate der SBP ist hoch und liegt ohne eine entsprechende Prophylaxe bei 43 % nach 6 und bei 69 % nach 12 Monaten. Bei 18 / 59 verstorbenen Patienten (31 %) war die SBP bzw. das SBP-Rezidiv die Haupttodesursache.
Zahlreiche Studien untersuchten deshalb den Effekt einer primären bzw. sekundären Antibiotikaprophylaxe zur Verhinderung einer SBP bei Patienten mit erniedrigter Eiweißkonzentration im Aszites (≤ 10 oder 15 g/L). Die Ergebnisse sind aufgrund kleiner und nicht streng stratifizierter Patientenpopulationen, unterschiedlicher Studienendpunkte und kurzer Beobachtungszeiträume nur sehr eingeschränkt verwertbar.
Verschiedene Kosten-Nutzen-Analysen ergaben deutliche Spareffekte einer prophylaktischen Antibiotikagabe im Vergleich zur Strategie „Erst Diagnostik, dann Therapie“. Ein Risiko-stratifiziertes Vorgehen unter Berücksichtigung der direkten Kosten (Diagnose, Behand- lung und Prophylaxe der SBP) zeigte, dass eine prophylaktische Antibiotikatherapie für 1 Jahr für Patienten mit hohem Risiko (Eiweißkonzentration im Aszites ≤ 10 g/L, Serum-Bilirubin > 2,5 mg/L bzw. 43 μmol/L) kostengünstiger ist, als eine prophylaktische Therapie bei allen Patienten mit Leberzirrhose und Aszites bzw. keine Prophylaxe (1123 $ versus 1311 $ versus 3509 $).
Eine Antibiotika-Langzeitprophylaxe verringert bei Patienten mit Leberzirrhose und SBP somit durchaus die Infektionsrate (Abbildung 4), führt jedoch aber auch zu einer signifikanten Zunahme der Resistenzbildung (Abbildung 5).
Eine kürzlich publizierte Metaanalyse konnte nur 6 „high quality studies“ ermitteln und zeigte bezüglich des Effektes einer Antibiotikatherapie auf 1.) die Prävention der SBP eine absolute Risikoreduktion von 11 % (number needed to treat, NNT = 9) und 2.) die Gesamt-Mortalität der SBP eine absolute Risikoreduktion von 8 % (NNT = 12,5). Somit ist die prophylaktische Antibiotikatherapie abhängig von der individuellen Situation des Patienten und des lokalen Resistenzmusters der (Krankenhaus-) Keime:
- Eine Langzeit-Rezidivprophylaxe nach durchgemachter SBP wird bei Patienten mit erhöhtem Risiko (niedriger Eiweißgehalt im Aszites) und erfolgter Evaluation zur Lebertransplantation allgemein als sinnvoll betrachtet.
- Eine Primärprophylaxe bei Patienten mit hohem Eiweißgehalt im Aszites (> 10 g/L) ist nicht erforderlich, da das Risiko einer SBP sehr gering ist.
- Eine Primärprophylaxe bei Risiko-Patienten mit niedrigem Eiweißgehalt im Aszites (≤ 10 g/L) ist nicht generell akzeptiert. Hier fehlt bisher die klare Identifikation von Patientensubgruppen, welche von einer solchen Therapie (langfristig) profitieren würden.
Die beste Prophylaxe ist immer noch die erfolgreiche Behandlung des Aszites.





