The Livermeeting, 29. Oktober bis 2. November 2010, Boston
HCV – höhere Ausheilungsraten, aber
komplexere Therapien
 Die AASLD
(American Association for the Study of Liver Diseases) feierte auf der 61. Jahrestagung ihren 60. Geburtstag und mehr
als 7.500 Teilnehmer kamen nach Boston. Zentrales Thema war die Therapieindividualisierung bei Hepatitis C und die
Phase-3-Studien der beiden Proteasehemmer Telaprevir und Boceprevir sowie erste mögliche Algorithmen zum Einsatz dieser
Substanzen in der Praxis. Neben einer Flut von weiteren neuen HCV-Substanzen und neuen Therapiestrategien gegen HCV, gab
es auch bei der Hepatitis B neue Daten zu Interferon, Entecavir und Tenofovir.
Die AASLD
(American Association for the Study of Liver Diseases) feierte auf der 61. Jahrestagung ihren 60. Geburtstag und mehr
als 7.500 Teilnehmer kamen nach Boston. Zentrales Thema war die Therapieindividualisierung bei Hepatitis C und die
Phase-3-Studien der beiden Proteasehemmer Telaprevir und Boceprevir sowie erste mögliche Algorithmen zum Einsatz dieser
Substanzen in der Praxis. Neben einer Flut von weiteren neuen HCV-Substanzen und neuen Therapiestrategien gegen HCV, gab
es auch bei der Hepatitis B neue Daten zu Interferon, Entecavir und Tenofovir.
Es tut sich viel in der Indikation Hepatitis C – die Pipeline für direkt antiviral wirkende Substanzen (DAA) ist
übervoll. Die Zulassungsunterlagen der ersten beiden Proteasehemmer Boceprevir und Telaprevir für die Behandlung
therapienaiver und vorbehandelter HCV-Patienten werden noch in diesem Jahr eingereicht, die Markteinführung wird im
Laufe des nächsten Jahres erwartet. Acht weitere Proteasehemmer sind bereits in der Phase II. Ebenfalls in der Phase II
befinden sich mindestens acht nukleos(t)idale Polymerasehemmer, sieben nicht nukleos(t)idale Polymerasehemmer, ein
NS5A-Hemmer und ein Entry-Inhibitor. Aber auch Substanzen, die nicht das Virus, sondern beispielsweise Cyclophilin A,
Mikro-RNA und Lipidsynthese im Wirt als Angriffspunkte haben, werden entwickelt. Die Liste der neuen Substanzen ist
lang und wahrscheinlich schon nicht mehr aktuell – auf dem diesjährigen Livermeeting war deshalb Hepatitis C auch
Hauptthema.

Standardtherapie nicht ausreichend
Mit der bisherigen Standardtherapie aus Peginterferon und Ribavirin (pegIFN/RBV) erreichen weniger als die Hälfte der therapienaiven HCV-Patienten mit Genotyp 1 eine Heilung, d.h. eine dauerhafte Virussuppression mindestens sechs Monate nach Ende der Therapie (sustained virological suppression, SVR). Und je nach dem, ob Patienten unter einer initialen Therapie mit pegIFN/RBV Nullresponder (<2 Logstufen Abfall der Viruslast), partielle Responder (>2 Logstufen Abfall der Viruslast) oder Relapser (nach negativer HCV-RNA zum Therapieende erneuter Nachweis nach Ende der Therapie ) waren, liegen die SVR-Raten nach einer Re-Therapie mit pegIFN/RBV bei 0-40%. Die Triple-Therapie aus einem DAA und pegIFN/RBV erhöht dagegen die Ausheilungsraten je nach Genotyp bei therapienaiven Patienten auf 70-90% und bei vorbehandelten Patienten auf 30-85%. Aber auch unter den neuen Triple-Therapien aus einem DAA und pegIFN/RBV versagt die Therapie bei 20-30% der therapienaiven Patienten und 40-50% der vorbehandelten Patienten. Nach den Worten von Raymond Chung, Boston/Massachusetts liegt das vor allem am schlechten Ansprechen auf Peginterferon alpha und Ribavirin: Die unter diesen Umständen stattfindende funktionelle Monotherapie mit dem DA führt zu einer raschen Resistenzentwicklung gegen die DAA. Eine Einleitungsphase (Lead-in) mit pegIFN/RBV könnte Chung zufolge rechtzeitig die Ansprechempfindlichkeit auf pegIFN/RBV erheben und so ein Therapieversagen unter einer Triple-Therapie verhindern. Als weitere Therapiestrategien nannte Chung eine Hochdosis Peginterferon alpha und/oder Ribavirin in Kombination mit einem Proteasehemmer, eine Vierfachtherapie, um die niedrige genetische Barriere der Proteasehemmer auch in der Kombination mit pegIFN/RBV zu erhöhen, und ein Interferon-freies Therapieregime aus mehreren DAAs. Auch wenn für viele Patienten eine kürzere Therapiedauer zur Ausheilung führt, könnten nach den Worten von Chung eine mangelnde Compliance und Nebenwirkungen der Triple-Therapie den Therapieerfolg der neuen komplexen Behandlungen gefährden.
Jetzt behandeln oder warten?
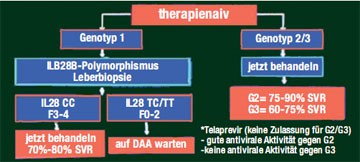
Abb. 1: Potenzieller Algorithmus für therapienaive Patienten
(nach D. Nelson, AASLD 2010)
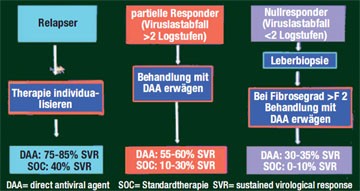
Abb. 2: Potenzieller Algorithmus für vorbehandelte Patienten
(nach D. Nelson, AASLD 2010)
Bis zur Zulassung der ersten beiden Proteasehemmer wird es noch dauern – wie sollen in der Zwischenzeit die HCV-Patienten behandelt werden – jetzt oder erst wenn der erste Proteasehemmer auf dem Markt ist? David Nelson, Gainesville/Florida, stellte im Postgraduate Workshop zur Hepatitis C mögliche Algorithmen für therapie-naive und vorbehandelte Patienten vor. Bei den therapienaiven Patienten, die mit Genotyp 1 infiziert sind, entscheidet der IL28B-Polymorphismus und eine Leberbiopsie über das weitere Vorgehen: Patienten mit IL28-CC-Genotyp (gutes Ansprechen auf pegIFN/RBV) und einer Fibrose Grad 3-4 sollen jetzt behandelt werden (Abb. 1). Haben die Patienten die ungüns-tigen Genotypen ILB28-TC oder -TT, empfahl Nelson auf die neuen DAAs zu warten. HCV-Patienten, die mit den Genotypen 2 und 3 infiziert sind, sollten ebenfalls jetzt behandelt werden, da diese HCV-Genotypen gut auf die bisherige Standardtherapie ansprechen. Bei den vorbehandelten Patienten mit partiellem Ansprechen und bei den Nullrespondern mit einem Fibrosegrad von >2 sollte eine Therapie mit einem DAA wenn möglich bereits jetzt im Rahmen einer Studie, erwogen bzw. bis zur Zulassung abgewartet werden, bei Relapsern sollte je nach individueller Situation entschieden werden (Abb. 2).
Bestimmung des IL28B-Polymorphismus auch für Triple-Therapie nötig?
Eine Modellrechnung geht davon aus, dass für die Interpretation von Studienergebnissen mit neuen Substanzen in Kombination mit pegIFN/RBV der IL28B-Polymorphismus wichtig ist (Thompson AJ et al. #810). Vor allem in kleineren Studien mit mehreren Behandlungsgruppen wie Dosisfindungsstudien könnte ein Ungleichgewicht des gut ansprechenden CC-Genotyps die Entscheidung, eine Substanz weiterzuentwickeln, beeinflussen. Basis des Models sind Ergebnisse aus nordamerikanischen Untersuchungen mit pegIFN, in denen 33% der weißen HCV-Patienten den Genotyp CC haben und die mediane Senkung der Viruslast nach vier Wochen 3,8 Logstufen bei Genotyp CC und 1,4 Logstufen bei anderen Genotypen beträgt. Demnach würde beispielsweise in einer dreiarmigen Phase-I-Studie ein Ungleichgewicht des CC-Genotyps von 10-20% zu einer Differenz von 0,2-0,5 Logstufen zu Woche 4 führen.
Boceprevir und Telaprevir
Die ersten Ergebnisse der Phase-III-Studien mit dem NS3-Proteasehemmer Boceprevir (Merck) und dem NS3/4A-Proteasehemmer Telaprevir (Vertex und Janssen) bei therapie-naiven und vorbehandelten HCV-Patienten Genotyp 1 veröffentlichten die beiden börsennotierten Firmen per Pressemitteilung bereits im August, die detaillierten Auswertungen wurden nun auf dem Livermeeting 2010 vorgestellt. Die zusätzliche Gabe eines Proteasehemmers zur Standardtherapie erhöhte mit beiden Substanzen die SVR-Raten bei therapienaiven und vorbehandelten Patienten signifikant, Therapiestrategie und -dauer der Phase-III-Studien unterschieden sich bei insgesamt ähnlichen Ergebnissen (Tab. 1). Mit beiden Proteasehemmern funktioniert eine Response-gesteuerte Therapie (RGT): Sprechen therapie-naive und vorbehandelte Patienten früh auf die Therapie an, ist eine kürzere Therapiedauer möglich und es werden Ausheilungsraten von mindestens 80% erreicht.
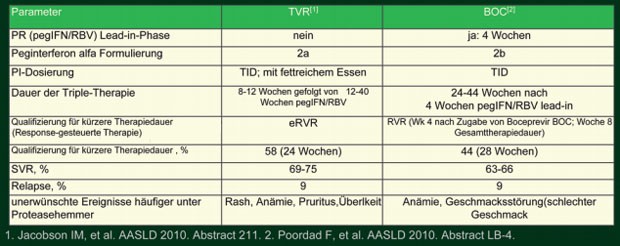
Tab. 1:
Vergleich Phase-III-Studien Telaprevir (ADVANCE) und Boceprevir (SPRINT-2) bei therapienaiven Patienten HVC-Genotyp 1
Welches Interferon für (welchen) DAA?
Zur Verfügung stehen aktuell zwei pegylierte Interferone: Peginterferon alpha-2a, das in zwei Dosierungen als Fertigspritze erhältlich ist, und Pegintereron alpha-2b, das dosisadaptiert mit einem Pen gespritzt wird. In den Studien mit Boceprevir wurde pegIFN alpha-2b eingesetzt, vermutlich weil beide Substanzen vom gleichen Unternehmen, nämlich Essex/Merck hergestellt werden. Telaprevir wurde in den Phase-III-Studien mit pegIFN alpha-2a geprüft. In den Telaprevir-Studien wurde der „Backbone“ pegIFN alpha-2a vom ersten Tag an mit dem DAA gegeben. In den SPRINT-Studien mit Boceprevir gab es dagegen eine 4wöchige Induktionsphase mit pegIFN und Ribavirin. In dieser Lead-in-Phase habe das pegylierte Interferon und Ribavirin – so der Erstautor der Studie SPRINT-1, Paul Kwo, Indianapolis – genügend Zeit, eine optimale Konzentration zu erreichen, was das Risiko von Resistenzen gegen DAA vermindere. Welcher Ansatz besser ist, und ob beide Interferone mit beiden DAA kombiniert werden können, ist noch offen, ebenso die Frage, ob die Zulassung von Telaprevir und Boceprevir nur in Kombination mit dem jeweils geprüften Interferon erfolgen wird.
SPRINT-2: mit Boceprevir-RGT hohe SVR-Raten
In der doppelblinden, plazebokontrollierten Phase-III-Studie SPRINT-2 erhielten 1.097 therapienaive HCV-Patienten Genotyp 1 im Verhältnis 1:1:1 drei verschiedenen Therapien (Abb. 3) (Poordad F et al., #LB-4):
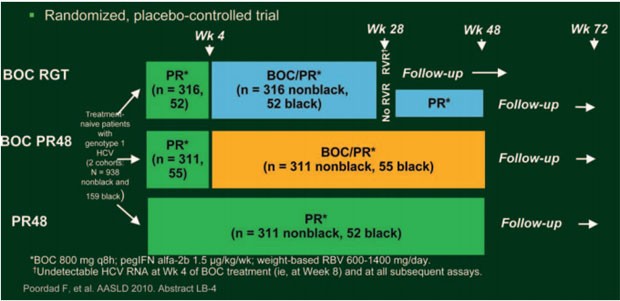
Abb. 3: SPRINT-2 Studiendesign therapienaive Patienten
- Standardtherapie pegIFN/RBV über 48 Wochen (48P/R)
- Response-gesteuerte Therapie (BOC RGT) mit einer vierwöchigen Lead-in-Phase mit 1,5μg/kg/Woche Peginterferon alfa-2b plus 600-1.400 mg/Tag Ribavirin je nach Körpergewicht (pegIFN/RBV) gefolgt von 3x täglich 800 mg Boceprevir plus pegIFN/RBV für 24 Wochen; falls die Viruslast zwischen Woche 8 und 28 nicht nachweisbar war (frühes Ansprechen), Ende der Triple-Therapie nach 24 Woche; falls kein frühes Ansprechen, weitere 20 Wochen pegIFN/RBV und Ende der Therapie nach 48 Wochen.
- 48-wöchige Therapie (BOC/PR48): Nach der 4-wöchigen Lead-in-Phase mit pegIFN/RBV erhielten die Patienten für 44 Wochen BOC plus pegIFN/RBV.
Patienten, die auch nach zwölf Wochen nicht auf die Therapie ansprachen, beendeten die Studie als Therapieversager vorzeitig.
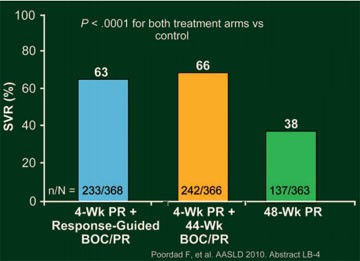
Abb. 4: SPRINT-2:
SVR Raten
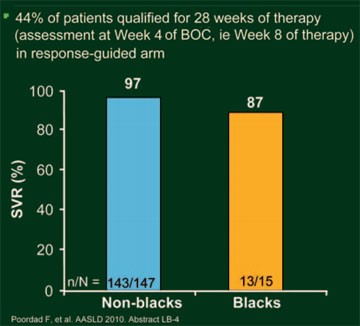
Abb. 5: SPRINT-2: SVR-Raten bei Patienten mit kurzer RGT (28
Wochen Therapie)
Die Reponse-gesteuerte Therapie (BOC RGT) war vergleichbar wirksam wie eine 44-wöchige Triple-Therapie (BOC/PR48) und Woche 8 der Therapie (nach 4 Wochen pegIFN/RBV gefolgt von 4 Wochen BOC plus pegIFN/RBV) war ein guter Zeitpunkt, um zu entscheiden, ob die Patienten 24 oder 44 Wochen Triple-Therapie benötigen (Abb. 4). Schätzungsweise 60% der therapienaiven HCV-Patienten kamen für die verkürzte Therapiedauer in Frage. Da schwarze HCV-Patienten mit Genotyp 1 schlechter auf pegIFN/RBV ansprechen, wurde die Studienpopulation in zwei Kohorten unterteilt und ausgewertet: Kohorte 1 umfasst 938 (86%) nicht schwarze Patienten und Kohorte 2 umfasst 159 (14%) schwarze Patienten. Insgesamt 40% der nicht schwarzen Patienten erreichten nach der Standardtherapie eine SVR, 67% nach der RGT und 68% nach der 48-Wochen-Therapie (jeweils p<0,0001 versus Kontrolle); die dementsprechenden SVR-Raten der schwarzen Patienten betrugen 23%, 42% (p=0,044 versus Kontrolle) und 53% (p=0,004 versus Kontrolle). Im BOC-RGT-Arm sprachen 44% (162/368) der Patienten früh auf die Triple-Therapie an und konnten deshalb die Therapie bereits nach 28 Wochen beenden. Die SVR-Rate betrug in dieser Gruppe bei den nicht schwarzen Patienten 97% (143/147) und bei den schwarzen Patienten 87% (13/15) (Abb. 5). Insgesamt 22% der Patienten aus der BOC-RGT-Gruppe hatten eine nachweisbare Viruslast zwischen Woche 8 und 24 und von ihnen erreichten mit der Verlängerung der Therapie mit pegIFN/RBV 74% (nicht schwarze Patienten) bzw. 58% (schwarze Patienten) der Patienten eine SVR. In der Gruppe mit der BOC/48PR betrug die SVR-Rate bei den nicht schwarzen Patienten mit frühem Ansprechen 96% (137/142) und bei den schwarzen Patienten 95% (18/19).
Anämie (29, 49, 49%) und Geschmacksstörung (18, 37, 43%) traten unter Boceprevir häufiger auf. Jeweils 43% der Patienten aus den Boceprevir-Armen und 24% aus dem Kontrollarm wurden wegen einer Anämie mit Erythropoietin behandelt und jeweils 2% der Patienten aus den Boceprevir-Armen, 1% aus dem Kontrollarm brachen wegen einer Anämie die Studie vorzeitig ab (Tab. 2).
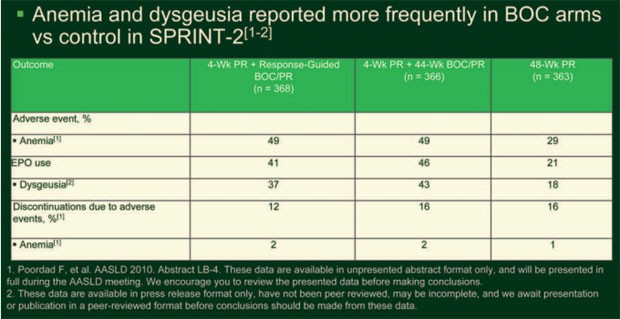
Tab.
2: SPRINT-2: unerwünschte Ereignisse
RESPOND-2: Relapser und partielle Responder profitieren
Die Boceprevir-Zulassungsstudie RESPOND-2 untersuchte mit dem gleichen dreiarmigen Studiendesign wie SPRINT-2 die Wirksamkeit einer Response-gesteuerten Triple-Therapie mit Boceprevir im Vergleich zur Standardtherapie (Abb. 6). (Bacon BR et al. #219). Allerdings galt als Ansprechen für die RGT eine nicht nachweisbare Viruslast bei Woche 8, in diesem Fall konnte die RGT nach 36 Wochen beendet werden; war die Viruslast nach wie vor bei Woche 8, aber nicht mehr bei Woche 12 nachweisbar, wurden die Patienten für weitere 12 Wochen mit IFN/RBV behandelt und beendeten die Therapie nach 48 Wochen. In RESPOND-2 wurden 403 Nonresponder und Relapser (keine Nullresponder) unter vorangegangener pegIFN/RBV-Therapie im Verhältnis 1:2:2 auf die drei Arme verteilt.
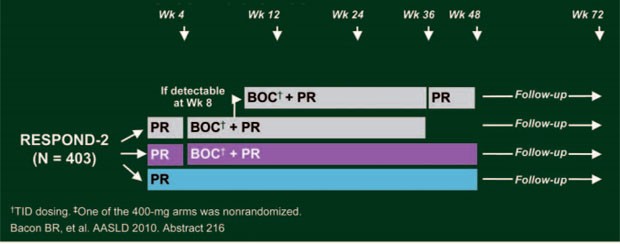
Abb. 6: Studiendesign RESPOND-2: vorbehandelte Patienten
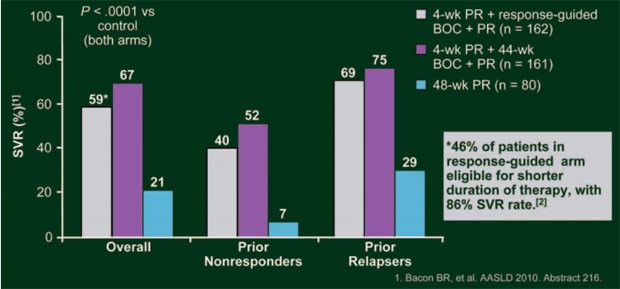
Abb. 7:
RESPOND-2: SVR-Raten
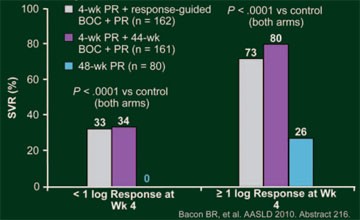
Abb. 8: RESPOND-2: SVR-Raten nach Ansprechen Woche 4 (Ende der
Lead-in-Phase)
Insgesamt 46% der Patienten im BOC-RGT-Arm erreichten ein frühes Ansprechen und konnten die Therapie nach 36 Wochen beenden, die SVR-Rate betrug in dieser Population 86%. In allen drei Armen war die SVR-Rate bei den Relapsern signifikant höher als bei den Non-Respondern (Abb. 7). Patienten, die bereits auf die Einleitungsphase bis Woche 4 mit einer Senkung der Viruslast um mindestens 1 Logstufe ansprachen, hatten eine höhere SVR-Rate als Patienten mit einer Senkung der Viruslast um <1 Logstufe zu Woche 4 (Abb. 8). Auch in dieser Studie waren die häufigsten unerwünschten Ereignisse Anämie und schlechter Geschmack (43 und 46 versus 20% bzw. 43 und 45 versus 11%).
Advance: Tripletherapie mit Telaprevir für 8 oder 12 Wochen
Zum Proteasehemmer Telaprevir wurden auf dem AASLD zwei Studien mit therapienaiven HCV-Patienten Genotyp 1 vorgestellt. Die doppelblinde, plazebokontrollierte Zulassungsstudie ADVANCE untersuchte zwei verschiedene Response-gesteuerte Telaprevir-basierte Therapien und verglich diese mit der 48-wöchigen Standardtherapie 180 μg/Woche Peginterferon alpha-2a plus 1.000-1.200 mg/Tag Ribavirin je nach Körpergewicht (pegIFN/RBV; PR): Eine RGT mit 8 oder 12 Wochen 750 mg Telaprevir (T8PR bzw. T12PR) alle 8 Stunden jeweils plus pegIFN/RBV gefolgt von weiteren 16 bzw. 12 Wochen pegIFN/RBV; bei ausgedehntem frühem Ansprechen, d.h. HCV-Negativität in Woche 4 und 12 (extended rapid viral response; eRVR) konnten die Patienten die Therapie nach Woche 24 beenden, Patienten ohne eRVR erhielten nochmals 24 Wochen peg IFN/RBV und beendeten die Therapie nach 48 Wochen (Bacon BR, et al. #216.(Abb. 9). Bei Patienten, die unter Telaprevir zu Woche 4 nach wie vor eine Viruslast von >1.000 IU/ml HCV-RNA hatten, wurde Telaprevir gestoppt und mit pegIFN/RBV weiterbehandelt. Bei Patienten, bei denen die Viruslast zu Woche 12 weniger als 2 Logstufen gesunken war, und bei Patienten, die zwischen Woche 24 und 40 nach wie vor eine nachweisbare Viruslast hatten, wurde die Studie vorzeitig beendet. Die 1.088 Patienten wurden im Verhältnis 1:1:1 auf die drei Arme randomisiert. Insgesamt 77% der Patienten hatten zu Studienbeginn eine Viruslast von ≥800.000 IU/ml, 58% den Genotyp 1a, und 21% eine Fibrose oder kompensierte Zirrhose.
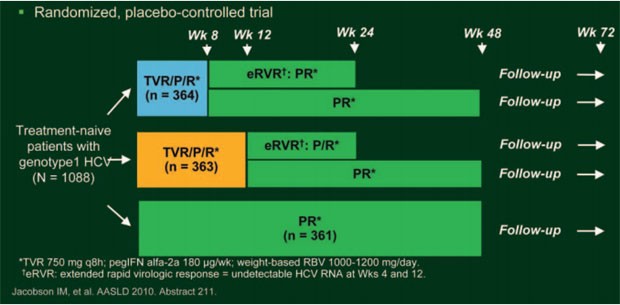
Abb. 9: Studiendesign ADVANCE: TVR + pegIFN/RBV bei
therapienaiven Patienten
Im Vergleich zur Standardtherapie (44%) erreichten signifikant mehr Patienten mit T12PR (75%) und mit T8PR (69%) eine SVR (jeweils p<0,0001 versus Kontrolle) (Abb. 10). Eine eRVR erreichten 58% und 57% Patienten (Kontrolle 8%), die dann die Therapie bereits nach weiteren 24 Wochen pegIFN/RBV beenden konnten und SVR-raten von 83-89% erreichten. Die Relapse-Raten waren in den Telaprevir-Armen niedriger (jeweils 9%) als im Kontroll-Arm (28%). Virologisches Versagen trat unter T8PR häufiger auf als unter T12PR (8% versus 12%). Patienten ohne, mit leichter und mit portaler Fibrose erreichten häufiger eine SVR als Patienten mit grenzwertiger „bridging“ Fibrose und Zirrhose. Die SVR-Raten unter Telaprevir bei Patienten mit grenzwertiger „bridging“ Fibrose und Zirrhose waren jedoch höher als im Kontrollarm.
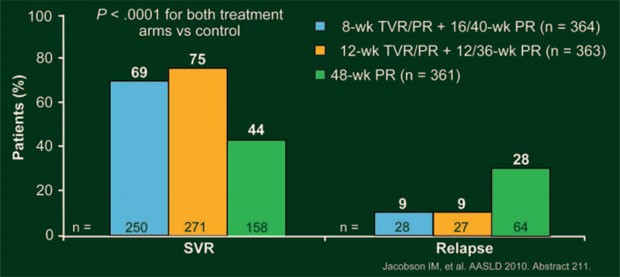
Abb.
10: ADVANCE: SVR- und Relapse-Raten
Die am häufigsten berichteten unerwünschten Ereignisse unter Telaprevir waren Juckreiz, Anämie und Rash und (überwiegend ekzematöser Hautauschlag). Wegen eines unerwünschten Ereignisses brachen 8% (T12PR), 8% (T8PR) und 4% (PR) der Patienten die Studie ab, wegen eines Hautausschlages 11%, 7% bzw. 1%. Bei einem mittleren bis schweren Rash unter der Triple-Therapie wurden die Medikamente sequenziell abgesetzt: Zuerst Telaprevir und nach sieben Tagen Ribavirin, falls der Rash anhielt auch Peginterferon. Bei Auftreten einer Anämie wurde die Ribavirin-Dosis modifiziert, eine Behandlung mit Erythropoietin war in dieser Studie nicht erlaubt.
Illuminate: kürzere Therapiedauer bestätigt
Dass eine kürzere Therapie-Gesamtdauer bei Patienten mit frühem Ansprechen möglich ist, belegte die Studie Illuminate: 540 HCV-Patienten Genotyp 1 erhielten zwölf Wochen lang dreimal täglich alle acht Stunden 750 mg Telaprevir (T12) zusammen mit einmal wöchentlich 180 μg Peginterferon alpha-2a und je nach Körpergewicht täglich 1.000-1.200 mg Ribavirin (PR). Danach wurde die Therapie mit pegIFN/RBV fortgeführt. Patienten, die eine eRVR erreichten, wurden bei Woche 20 randomisiert auf die beiden Behandlungsarme 24 Wochen oder 48 Wochen Gesamtdauer aufgeteilt, ohne eRVR erhielten die Patienten ebenfalls eine pegIFN-Therapie bis Woche 48 (Sherman KE et al. #LB-2) (Abb. 11). Als Therapieversager wurden Patienten gewertet, deren Viruslast bei Woche 12 nicht mehr als 2 Logstufen gesunken war oder die zu Woche 24 nach wie vor eine nachweisbare Viruslast hatten.
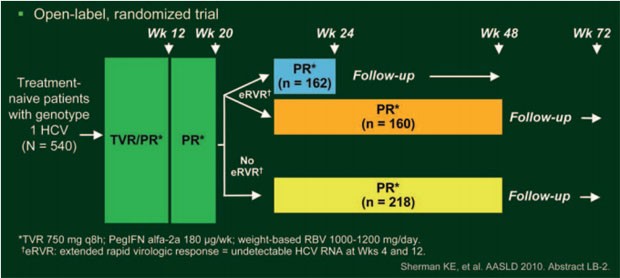
Abb. 11: Studiendesign ILLUMINATE: therapienaive Patienten
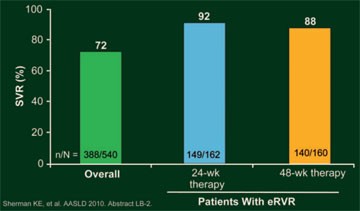
Abb. 12:
ILLUMINATE: SVR-Raten
Insgesamt 65,2% (n=352) der Patienten erreichten eine eRVR und 59,6% (n=322) wurden im Verhältnis 1:1 auf die 24- oder 48-wöchige Therapie verteilt. Mit der 24-wöchigen Therapie (n=162) erreichten 92% der Patienten und mit der 48-wöchigen Therapie (n=160) 87,5% eine SVR – damit war die kürzere der längeren Therapie nicht unterlegen; die SVR-Rate betrug in der Gesamtpopulation 71,9% (Abb. 12). Wegen virologischen Versagens wurde die Studie bei 36 (6,7%) Patienten und wegen eines unerwünschten Ereignisses bei 94 (17,4%) Patienten vorzeitig beendet. Fatigue (n=22) und Anämie (n=12) waren die häufigsten unerwünschten Ereignisse, die zum Studienabbruch führten.
Und noch mehr Proteasehemmer...
Der NS3/4A-Proteasehemmer Danoprevir (ehemals RG7227) wurde in der ATLAS-Studie (Phase II) an 225 therapienaiven
Patienten Genotyp 1 in drei verschiedenen Dosierungen untersucht (3x täglich 300 mg, 2x täglich 600 mg und 2x täglich
900 mg in Kombination mit pegIFNalpha-2a/RBV) und mit der Standardtherapie verglichen (Terrault N et al. #32). Die
Patienten wurden zwölf Wochen lang mit der Triple-Therapie behandelt und erhielten danach je nach frühem
Therapieansprechen bis Woche 24 oder 48 mit pegIFN/RBV. Ein komplettes frühes Ansprechen (cEVR; nicht nachweisbare
Viruslast zu Woche 12; Standardresponder) erreichten 88-92% der Patienten mit der Triple-Therapie und 43% der Patienten
mit der Standardtherapie. Als
Nebenwirkung trat eine dosisabhängige ALT-Erhöhung Grad 4 auf. Danoprevir wird zur
Zeit auch in Kombination mit dem Booster Ritonavir untersucht, um die Dosis des Proteasehemmers zu verringern.
Vaniprevir, ein weiterer NS3/4A-Proteasehemmer (ehemals MK-7009), wurde in vier verschiedenen Dosierungen (2x täglich 300 oder 600 mg, 1x täglich 600 oder 800 mg) mit pegIFN/RBV als Triple-Therapie mit der Standardtherapie verglichen (Manns MP et al. #32). Nach 28 Tagen Triple-Therapie erhielten alle Patienten für weitere 44 Wochen pegIFN/RBV. Die endgültige Auswertung ergab zwar für die verschiedenen Triple-Therapien signifikant höhere Raten für RVR (67-84% versus 5%) und cEVR (74-85% versus 47%), die SVR-Raten waren jedoch nur numerisch höher (61-84% versus 63%).
Der mit niedrig dosiertem Ritonavir (100 mg) geboosterte NS3-Proteasehemmer ABT-450 kann einmal täglich eingenommen werden. In einer Dosisfindungsstudie wurde ABT-450 für drei Tage in verschiedenen Dosierungen (50/100 mg, 100/100 mg oder 200/100 mg oder Plazebo) als Monotherapie gegeben (Lawitz E et al. #LB-10). Danach erhielten die 30 therapienaiven Patienten alle ABT-450/r plus pegIFn/RBV für 12 Wochen gefolgt von pegIFn/RBV für 36 Wochen.
Die ersten Zwischenergebnisse zeigten einen raschen Abfall der Viruslast auch unter der dreitägigen Monotherapie von 4 Logstufen und nach vier Wochen Triple-Therapie um mindestens 5,5 Logstufen. Eine RVR erreichten 93% der Patienten.
Triple-Therapie mit Polymerasehemmer
RG7128 ist ein NS5B nukleosidaler Polymerasehemmer, der gegen alle HCV-Typen aktiv ist und eine hohe genetische Barriere besitzt. In der doppelblinden Phase-IIb-Studie PROPEL wurden insgesamt 408 HCV-Patienten mit Genotyp 1 oder 4 eingeschlossen und randomisiert auf fünf verschiedene Gruppen aufgeteilt: Arm A: 1x täglich 500 mg RG7128 plus pegIFN/RBV für 12 Wochen (n=80); Arm B 1x täglich 1.000 RG7128 plus pegIFN/RBV für 8 Wochen (n=81); Arm C und Arm D: jeweils 1x täglich 1.000 mg RG7128 plus pegIFN/RBV für 12 Wochen (n=82 und n=81); Arm E: pegIFN/RBV für 12 Wochen (Jensen DM et al. #81). Patienten aus den Armen A, B und C, deren Viruslast zwischen Woche 4 und 22 unter der Nachweisgrenze von 15 IU/ml lag, konnten die Therapie nach 24 Wochen beenden. Patienten ohne RVR und Patienten aus den Armen D und E erhielten bis Woche 48 pegIFN/RBV. Unabhängig von einer vorbestehenden Zirrhose (ca. 20% der Patienten) waren in der geplanten Zwischenanalyse nach 12 Wochen alle Triple-Therapien signifikant wirksamer als die Standardtherapie (EVR 68-88% versus 49%), dabei waren die cEVR-Raten unter einer 12-wöchigen Triple-Therapie vergleichbar (jeweils >80%). Insgesamt 11 Patienten hatten nach 12 Wochen Triple-Therapie eine Viruslast von >1.000 IU/ml, eine RG7168-assoziierte Resistenz trat jedoch nicht auf. Die berichteten unerwünschten Ereignisse waren in allen fünf Armen vergleichbar.
Kombination Polymerase- und Proteasehemmer mit und ohne RBV oder pegIFN/RBV
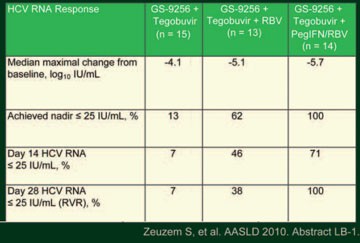
Tab. 3: GS-9256 + Tegobuvir alleine, mit RBV oder
mit pegIFN/RBV: virologisches Ansprechen
Polymerasehemmer haben zwar eine hohe Potenz, aber eine niedrige genetische Barriere – die Kombination mit einem weiteren DAA, z.B. mit einem Polymerasehemmer mit hoher genetischer Barriere könnte die Wirksamkeit erhöhen. Auf Ribavirin kann aber nicht verzichtet werden, wie Stefan Zeuzem, Frankfurt, anhand einer Phase-II-Studie in der Late Breaker Session vorstellte (Zeuzem S et al. #LB-1). Insgesamt 46 therapienaive Patienten erhielten im Part A der Studie für vier Wochen randomisiert entweder den NS5B-nichtnukleosidalen Polymerasehemmer Tegobuvir (ehemals GS-9190; 40 mg BID) und den NS3-Proteasehemmer GS-9256 (75 mg BID) als Zweierkombination oder zusätzlich gewichtsadaptiertes Ribavirin (1.000-1.200 mg) als Dreierkombination. Die Patienten wurden mit pegIFN/RBV bis Woche 48 bei einem frühen virologischen Durchbruch weiterbehandelt. Im zweiten, nicht randomisierten Part B der Studie erhielten15 Patienten für ebenfalls für vier Wochen die Vierfachkombination aus den beiden DAA und zusätzlich pegIFN alfa-2a/RBV und danach bis Woche 48 pegIFN/RBV. Im Part A sank die Viruslast um maximal 4,1 bzw. 5,1 Logstufen HBV-DNA IU/ml (Tab. 3). Ribavirin verstärkte die antivirale Wirksamkeit der beiden DAAs und verzögerte einen virologischen Durchbruch bzw. verringerte dessen Rate. Bei den meisten HC-Viren von Patienten mit einem virologischen Durchbruch konnten N3B- und/oder NS5B-Resistenzmutationen nachgewiesen werden. Die Vierfachkombination im Part B der Studie war am wirksamten, am Tag 28 hatten alle Patienten eine nicht nachweisbare Viruslast (≤25 IU/ml).
Interferonfreie Therapie möglich
Die interferonfreie Kombination aus dem NS3/4A-Proteasehemmer BI 201335 (1x täglich 120 mg) und dem NS5B-Polymerasehemmer BI 207127 (3x täglich 400 oder 600 mg) und gewichtsadaptierten Ribavirin erhielten aufgeteilt in zwei Gruppen insgesamt 32 therapienaive Patienten für 28 Tage (Zeuzem S et al. #LB-7). Danach wurde die Therapie bei allen Patienten auf die Triple-Therapie Proteasehemmer plus pegIFN/RBV umgestellt. Die Viruslast sank bei allen Patienten bereits deutlich nach zwei Tagen. Am Tag 29 war bei allen Patienten (17/17) aus der Gruppe mit der höheren Dosierung und bei 11 von 15 Patienten aus der Gruppe mit der niedrigeren Dosierung die Viruslast unter 25 IU/ml gesunken. Die interferonfreie Therapie wurde gut vertragen.
Kombination Polymerase- und Proteasehemmer bei Nullrespondern
Ob eine Kombination aus zwei DAAs und pegIFN/RBV bei Nullrespondern Genotyp 1 wirkt, wurde in einer Phase-IIa-Studie an 21 Patienten untersucht (Lok A et al. #LB-8). Die Patienten erhielten für 24 Wochen entweder den NS5A-Polymerasehemmer BMS-790052 (60 mg QD; wirkt gegen verschiedene Genotypen) und den NS3-Proteasehemmer BMS-650032 (600 mg BID; wirkt gegen Genotyp 1a und 1b) als Zweierkombination (n=11) oder zusammen mit pegIFN alfa 2a plus RBV (n=10). In der Zwischenauswertung nach zwölf Wochen war die RVR-Rate der beiden Gruppen vergleichbar (64 vs. 60%). Die Rate der eRVR (36 vs. 60%) und der cEVR (46 vs. 90%) waren mit der Dreierkombination höher. Virologische Durchbrüche traten nur bei Patienten mit Viren des Genotyps 1a auf.
HCV: Prävention Leberkrebs mit Peginterfon-Erhaltungstherapie
Langfristig schützt eine Peginterferon-Erhaltungstherapie (90 μg/Woche) über 3,5 Jahre Patienten mit chronischer HVC wohl doch vor Leberkrebs, das gilt aber nur für Patienten mit Zirrhose , wie eine aktuelle Auswertung der Studie HALT-C nach einer medianen Beobachtungszeit von 6,1 (maximal 8,7) Jahren zeigte (Lok AS et al. #214). In der Studie erhielten 1.050 Patienten mit chronischer HCV und Ishak-Score Fibrosegrad ≥3 ohne SVR unter einer vorherigen Therapie mit pegIFN/RBV entweder eine pegIFN-Erhaltungstherapie oder keine Therapie. Nach dem nunmehr sechsjährigen Follow-up hatten 88 Patienten ein HCC entwickelt, davon war das HCC bei 68 Patienten gesichert und bei 20 vermutet: Die Inzidenz betrug 7,2% (347/515) in der pegIFN-Gruppe und 9,6% (51/533) in der Kontrollgruppe (p=0,24). Von der langen Behandlung profitierten vor allem Patienten mit Zirrhose (kumulative Inzidenz nach 8 Jahren 11% vs. 24,2%; p=0,01), nicht jedoch Patienten mit einer Fibrose (10,1% vs 9,8% ; p=0,26).
Hepatitis B
Tenofovir : 4-Jahres-Daten
Vorgestellt wurden die Ergebnisse der beiden Studien 102 und 103 nach 192 Wochen. In der Studie 102 nahmen nach vier Jahren noch 84% der ursprünglich 375 HBe-Ag-negativen Patienten teil (Marcellin P et al. #476). In der On-Treatment-Analyse nach 192 Wochen hatten 100% der Patienten, die von Anfang an Tenofovir erhielten, und 99% der Patienten, die die ersten 48 Wochen zuerst Adefovir erhielten, eine Viruslast von <400 Kopien/ml. In der Intent-To-Treat-Analyse waren das 87% bzw. 84%. In der Studie 103 nahmen nach vier Jahren noch 74% der ursprünglich 266 HBe-Ag-positiven Patienten teil (Heathcote E et al. #477). Laut On-Treatment-Analyse lag die Viruslast bei 99% der Patienten, die Tenofovir von Anfang an erhielten, und bei 96%, die von Adefovir auf Tenofovir umgestellt wurden, unter der Nachweisgrenze, in der Intent-To-Treat-Analyse waren es 72% und 68%. Nach vier Jahren Tenofovir-Therapie hatten 41% der HBeAg-positiven Patienten einen HBeAg-Verlust und 29% eine HBeAg-Serokonversion und 10,8% der Patienten erreichten mit der HBsAg-Serokonversion eine vollständige Remission der Erkrankung (Abb. 13). Eine Resistenz gegen Tenofovir entwickelte sich in keiner der beiden Studien.
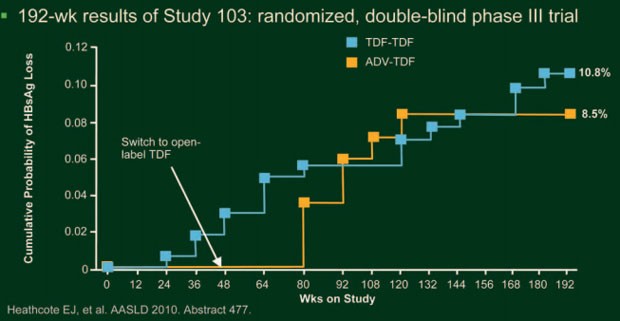
Abb. 13: HBsAg-Serokoversion unter Tenofovir
„Real-Life“-Daten mit Entecavir
In 18 italienischen Zentren wurden 418 NRTI-naive Patienten mit chronischer HBV (83% HBe-negativ) konsekutiv in eine Beobachtungsstudie eingeschlossen und mit täglich 0,5 mg Entecavir 30 Monate (Bereich 2-38) behandelt (Lampertico P et al. #391). Die HBV-DNA lag zu Studienbeginn bei 6 Logstufen IU/ml (Bereich 1,5 bis >9,0) und die ALT war bei 85% der Patienten erhöht. Im Verlauf von 30 Monaten stieg der Anteil der Patienten mit nicht nachweisbarer Viruslast (<12 IU/ml) auf 96% (Auswertung von 120 Patienten) und 93% der Patienten hatten normale ALT-Werte. Insgesamt 65 (38,5%) Patienten erreichten eine HBeAg-Serokonversion.
In der retrospektiven spanischen Beobachtungsstudie ORIENTE wurden die Daten von 190 HBV-Patienten mit kompensierter Lebererkrankung nach einer medianen Beobachtungszeit von 50 Wochen Behandlung mit 1x täglich 0,5 mg Entecavir ausgewertet (Buti M et al. #409). Nach 48 Wochen war die Viruslast bei 83% der Patienten unter <50 IU/ml gesunken (61% HBeAg-positiv und 92% HBeAg-negativ), der ALT-Wert hatte sich bei 82% (115/141) der Patienten mit zuvor erhöhtem ALT-Wert normalisiert und 21% (12/57) der Patienten erreichten eine HBe-Serokonversion. Eine HBsAg-Serokonversion trat bei 2 (1%) Patienten auf. War die Viruslast nach 12 Wochen um mindestens 3 Logstufen gesunken, korrelierte das mit mit der HBe-Serokonversionsrate nach 48 Wochen.
Neptune-Studie bestätigt 180 μg pegIFN für 48 Wochen
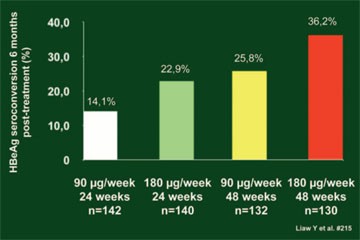
Abb. 14: HBeAg-Serokonversion in Abhängigkeit von der
pegIFN-Dauer und -Dosis
Ob auch eine kürzere Therapie und/oder eine niedrigere Dosis pegIFN alpha2a bei HBeA-positiven Patienten eingesetzt werden kann, wird seit längerem diskutiert. Die Neptune-Studie bestätigte nun die bisherige Standarddosis von 180 μg/Woche über 48 Wochen (Liaw Y et al. #215).
In der vierarmigen Studie erhielten 548 Patienten mit chronischer HBV 90 μg peg-IFN für 24 oder 48 Wochen oder 180 μg pegIFN für 24 oder 48 Wochen. Sechs Monate nach Ende der Therapie war die Rate der HBeAg-Serokonversion mit 180 μg pegIFN für 48 Wochen am höchsten (Abb. 14).
Die kürzere Dauer war der längeren Dauer unabhängig von der Dosierung unterlegen, ebenso die niedrigere Dosis der höheren Dosis unabhängig von der Dauer.
Andrea Warpakowski, Itzstedt






