HOLGER H. LUTZ, PROF. DR. CHRISTIAN TRAUTWEIN
Die Hepatitis B- und C-Koinfektion:
Eine therapeutische Herausforderung
Aufgrund gemeinsamer Infektionswege stellt die Hepatitis B- und C-Koinfektion besonders in Endemiegebieten ein häufiges Problem mit speziellen therapeutischen Herausforderungen dar. Eindeutige Empfehlungen diesbezüglich sind bisher - auch aufgrund mangelnder Studien - nicht vorhanden. Bei erhöhter Morbidität und Mortalität durch synergistische pathogene Effekte der Virushepatitiden B und C ist eine rasche und erfolgreiche Therapie dieser Patientengruppe von großer Bedeutung. In aller Regel "dominiert" die Hepatitis C-Infektion und führt zu einer Suppression der HBV-Replikation; entsprechend sollte ein Therapieregime mit primärem Blick auf die chronische Hepatitis C gewählt werden.
EPIDEMIOLOGIE
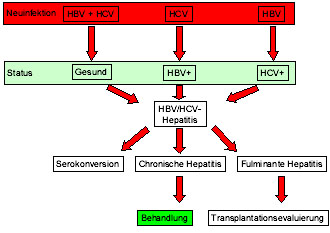
Abb. 1: Die HBV/HCV-Koinfektion kann als de-novo-Koinfektion entstehen. Häufig entwickelt sie sich
jedoch durch eine Superinfektion bei bereits bestehender chronischer Hepatitis. Kommt es zu keiner
Ausheilung, sollte rasch eine entsprechende Therapie begonnen werden (modifiziert nach 29).
Hepatitis B- und C-Infektionen sind die Hauptursachen chronischer Lebererkrankungen weltweit (350 Millionen HBV, 170 Millionen HCV). Die Prävalenz chronischer Infektionen reicht von <1% in Westeuropa bis zu >20% in Endemiegebieten (Süd-ostasien, China, Mittelmeerraum). Aufgrund gemeinsamer Infektionswege ist die Koinfektion vor allem in Ländern endemischen Vorkommens sowie in Hochrisikopopulationen (Bluttransfusionen in der Vorgeschichte, i.v.-Drogenabusus) ein medizinisches Problem. Genaue epidemiologische Daten hierzu sind nur spärlich vorhanden. Die Prävalenz einer HCV-Infektion bei Hepatitis B-Patienten schwankt in Endemiegebieten zwischen 9 und 30%1. Eine genaue Angabe zur Gesamtpopulation der HBV/HCV-Koinfizierten wird zudem durch die so genannte „okkulte“ Hepatitis B-Infektion erschwert, welche aufgrund des fehlenden HBs-Antigen-Nachweises nicht immer erfasst wird (siehe unten).
Die Koinfektion entsteht häufig durch eine Superinfektion bei bereits bestehender chronischer Hepatitis B- oder C-Infektion (Abb. 1). Der Krankheitsverlauf ist sehr variabel und reicht von der fulminanten Hepatitis über die Serokonversion der HBV-Infektion nach Superinfektion bis zu einer kombinierten HCV- und HBV-Elimination2,3.
OKKULTE HEPATITIS B-INFEKTION
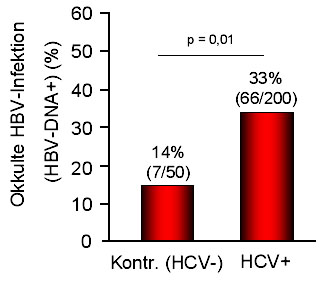
Abb. 2: Eine okkulte Hepatitis B-Infektion zeigt sich in Endemiegebieten (hier Italien) gehäuft in
Patienten mit chronischer Hepa- titis C gegenüber Patienten mit chronischen Lebererkrankungen anderer
Genese (nach 5).
Eine okkulte HBV-Infektion ist definiert als positiver HBV-DNA-Nachweis ohne detektierbares HBs-Antigen. Verschiedene Ursachen des HBs-Antigenverlustes werden diskutiert, z.B. eine Mutation in der a-Determinante des Virus, welche zu einer fehlenden Nachweisbarkeit des HBsAg führt, oder eine niedrige Viruslast ohne messbare Mengen HBs-Antigen (etwa durch direkte Suppression durch HCV). Ein vermindertes Ansprechen einer antiviralen HCV-Therapie ist mit einer okkulten HBV-Koinfektion assoziiert4. Prinzipiell kann auch die Hepatitis B die führende Infektion darstellen, jedoch tritt zumeist eine Inhibition der HBV- durch die „dominante“ HCV-Infektion auf8. In einer italienischen Studie zeigte sich in einem Drittel aller HCV-Infizierten eine okkulte HBV-Infektion5 (siehe Abb. 2).
HBV-HCV-INTERAKTION
Das Hepatitis C-Virus supprimiert die HBV-Replikation und führt zu einer Verringerung der genetischen Variabiliät (weniger pre-C-Mutationen) gegenüber HBV-Monoinfektionen6. Hingegen ließen sich in Mono- gegenüber Koinfektionen nicht weniger HCV-Mutationen nachweisen7. Die Transkriptionshemmung der HBV-RNA wird über das HCV-Core-Protein vermittelt9. Insbesondere bei einer Infektion mit dem Genotyp 1 zeigt sich eine deutliche Suppression der HBV Enhancer 1 und 2 in vitro9. Eine HCV-Superinfektion bei bekannter chronischer Hepatitis B führt ebenfalls zu einer Verminderung der HBV-DNA in vivo10. Jedoch ist auch eine Suppression der HCV-Replikation durch HBV möglich11.
Ein weiterer Anhalt für die reziproke Hemmung ergibt sich aus Untersuchungen an koinfizierten Patienten nach Lebertransplantation. Hierbei konnte ein verlängertes Überleben im Vergleich zur Monoinfektion gezeigt werden. Dieser positive Effekt ist am ehesten auf die besondere Situation dieser Patienten unter immunsuppressiver Therapie zurückzuführen12, 13. Die reziproke Hemmung der Virusreplikation bewirkt eine geringere Leberschädigung unter Immunsuppression. Auch histologisch zeigte sich eine mildere Progression bei Koinfektion gegenüber einer Hepatitis B-Monoinfektion14.
Die HBV/HCV-Koinfektion kann einer ausgeprägten Dynamik unterliegen. In einer longitudinal angelegten italienischen Studie über 1 Jahr wurden 103 Patienten alle 2 Monate bzgl. ALT und Viruslast untersucht15. Hier zeigten sich, insbesondere bei sowohl aktiver Hepatitis B- als auch Hepatitis C-Infektion, fluktuierende Virämien und Transaminasenanstiege. Eine dominierende Hepatitis C-Infektion war allerdings auch hier mehrheitlich vorhanden (49%).
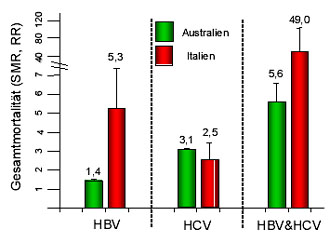
Abb. 3: Drei unabhängige Studien aus Italien und Australien belegen eine deutliche Morti- litätssteigerung
bei HBV/HCV-Koinfektionen im Vergleich zu den jeweiligen Monoinfekti- onen (modifiziert nach 16, 19,
30).
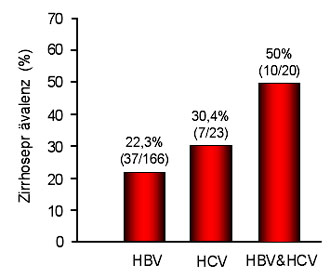
Abb. 4: Die Prävalenz der Leberzirrhose ist bei HBV/HCV-Koinfizierten im Vergleich zu
Monoinfizierten signifikant erhöht (nach 19).
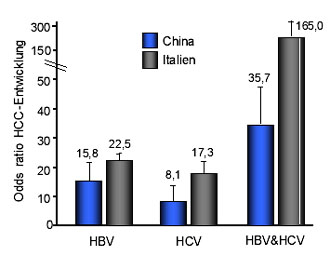
Abb. 5: Risiko der Entwicklung eines hepa- tozellulären Karzinoms gegenüber HBV- und
HCV-Monoinfektionen (nach 20, 31)
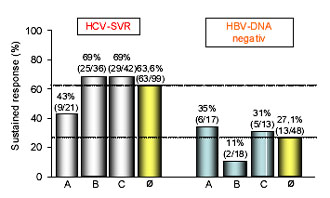
Abb. 6: Auswahl einiger alpha-Interferon/ Ribavirin-basierter Studien zur Therapie bei Hepatitis B- und
C-Koinfektion
A: α-IFN 6MU, 6 Mon. + IFN 3MU + Riba 3 Mon. (32) (21 Pat.)
B: α-IFN 3-5MU + Ribavirin 6 Mon. (33) (36 Pat.)
C: α-IFN 6MU + Ribavirin 6 Mon. (34) (42 Pat.)
MORTALITÄT
Sowohl retrospektive als auch prospektive Daten zeigten eine deutlich erhöhte Mortalität bei Koinfizierten (siehe Abb. 3). Ursächlich hierfür sind zum einen ein synergistischer pathologischer Effekt der beiden Virusinfektionen sowie zum anderen der häufig zugrunde liegende i.v.-Drogenabusus mit entsprechender „nicht-hepatischer“ Mortalität16, 17. Daher sollten insbesondere entsprechende Komorbiditäten in Risikopopulationen beachtet und in die Therapie mit einbezogen werden.
ZIRRHOSEPROGREDIENZ
Die verstärkte Progression der Lebererkrankung im Falle einer Koinfektion ist sowohl klinisch als auch histologisch gut belegt11, 18. Damit einhergehend ist die Prävalenz der Leberzirrhose bei Koinfizierten deutlich erhöht (Abb. 4)19. Trotz gegenseitiger Hemmung der Viren kommt es nicht zu einer Verbesserung, sondern zu einer Verschlechterung der chronischen Lebererkrankung durch pathologische Effekte beider Viren.
HCC-ENTWICKLUNG
Im Rahmen einer großen Metaanalyse konnte gezeigt werden, dass die Koinfektion im Vergleich zur HBV- und HCV-Monoinfektion mit einem höheren Risiko für ein hepatozelluläres Karzinoms einhergeht20 (Abb. 5). Bei bestehender HCV-Infektion erhöht auch eine „abgelaufene“ Hepatitis B-Infektion das Risiko an einem HCC zu erkranken bzw. fördert das mulitfokale Auftreten21. Eine okkulte Hepatitis B-Infektion ist ebenfalls mit einem erhöhten Risiko einer HCC-Entwicklung assoziiert22, 23.
THERAPIEOPTIONEN
Zum aktuellen Zeitpunkt gibt es keine Studien zur Behandlung der HBV/HCV-Infektion mit pegylierten Interferonen plus Ribavirin oder zu alternativen Therapieoptionen. Die bisherigen großen Zulassungsstudien zur Behandlung der Hepatitis B oder C werteten die Koinfektion stets als Ausschlusskriterium24. Kleinere Untersuchungen zeigen allerdings, dass das Therapieansprechen bei Hepatitis C-Infektion mit okkulter oder serologisch abgelaufener Hepatitis B-Infektion mittels alpha-Interferon (+/- Ribavirin) verringert ist25, 26. Eine mögliche Ursache ist hier die verminderte Expression des IFN-Rezeptors bei okkulter HBV-Infektion.
Eine Auswahl bisheriger Studien zur Behandlung mit alpha-Interferon und Ribavirin ist in Abbildung 6 dargestellt. Durchschnittlich konnten hier in über 60% der Fälle eine HCV-SVR und in rund einem Viertel der Fälle eine dauerhafte Suppression der HBV-DNA nach Therapie erreicht werden. Im Jahr 2006 wurde erstmalig über eine erfolgreiche Behandlung von HBV/HCV-Koinfektion mit pegyliertem Interferon und Ribavirin berichtet27. Sowohl hierbei, wie auch in einem zweiten publizierten Fall mit einer okkulten Hepatitis B-Infektion kam es durch die fehlende Hemmung durch den Hepatitis C-Virus zu einem ausgeprägten Flare bzw. Relapse der Hepatitis B27, 28.
In einer derzeit laufenden Studie zur Behandlung der Koinfektion mit pegyliertem Interferon alpha-2b und Ribavirin zeigten sich positive Ergebnisse mit einer hohen Rate an SVR (>60%) und dauerhafter HBV-Suppression im follow-up (unpublizierte Daten). Zu ausgeprägten Nebenwirkungen, insbesondere einer HBV-(Re-) Aktivierung, kam es hierbei nicht.
Korrespondenz: Prof. Dr. med. Christian Trautwein
Medizinische Klinik III, Universitätsklinikum (UKA), Universität Aachen (RWTH)
Pauwelsstrasse 30, 52074 Aachen
Tel.: 0241 - 8080860
Email: ctrautwein@ukaachen.de
Empfehlungen für die Praxis
- Aufgrund der zumeist dominanten HCV-Infektion sollte eine kombinierte Therapie mit pegyliertem Interferon und Ribavirin mit dem Ziel der Elimination von HCV durchgeführt werden. Je nach Therapieerfolg kann dann die chronische Hepatitis B-Infektion medikamentös mit Nukleos(t)idanaloga behandelt werden. Wegen der bislang mangelhaften Studienlage sollte die Therapie jedoch in einem spezialisierten Zentrum durchgeführt werden.
- Im Rahmen der HCV-Therapie kann es durch die Suppression des Hepatitis C-Virus zum Hepatitis B-Flare kommen. Den Patienten sollte dennoch eine Therapie nicht vorenthalten werden. Engmaschige Kontrollen sind allerdings empfehlenswert.
- HBV/HCV-Koinfizierte sind häufig Risikopatienten mit entsprechenden Komorbiditäten (insbesondere bei i.v.-Drogenabusus). Dies muss beachtet und in die Therapie mit einbezogen werden.
- Vor Therapie einer chronischen Hepatitis C sollte stets der Hepatitis B-Status erhoben werden. Insbesondere bei positivem anti-HBc-Titer sollte ein HBV-DNA-Nachweis zum Ausschluß einer okkulten HBV-Infektion geführt werden.
- Bei entsprechender Indikation sollten auch Patienten mit Koinfektion zur Lebertransplantation angemeldet werden. Aufgrund der reziproken Hemmung der Viren unter Immunsuppression haben diese Patienten im Vergleich zu Monoinfizierten sogar eine günstigere Prognose nach der Transplantation.
Literatur
1. Liaw YF. Role of hepatitis C virus in dual and triple hepatitis virus infection. Hepatology. 1995; 22:1101-8.
2. Chen SW, Lee TS, Hu CC, Chang LC, Chien RN. Simultaneously acute hepatitis B virus and C virus coinfection and subsequent chronic hepatitis C. Scand J Infect Dis. 2007; 39:351-4.
3. Yan BM, Lee SS. Acute coinfection with hepatitis B and hepatitis C viruses. Can J Gastroenterol. 2005; 19:729-30.
4. Khattab E, Chemin I, Vuillermoz I, Vieux C, Mrani S, Guillaud O, Trepo C, Zoulim F. Analysis of HCV co-infection with occult hepatitis B virus in patients undergoing IFN therapy. J Clin Virol. 2005; 33:150-7.
5. Cacciola I, Pollicino T, Squadrito G, Cerenzia G, Orlando ME, Raimondo G. Occult hepatitis B virus infection in patients with chronic hepatitis C liver disease. N Engl J Med. 1999;341:22-6.
6. De Mitri MS, Morsica G, Cassini R, Bagaglio S, Andreone P, Bianchi G, Loggi E, Bernardi M. Low replication and variability of HBV pre-core in concomitant infection with hepatitis B and hepatitis C viruses. Arch Virol. 2007;152:395-404.
7. De Mitri MS, Morsica G, Cassini R, Bagaglio S, Andreone P, Bianchi G, Margotti M, Bernardi M. Genetic variability of hepatitis C virus in HBV/HCV co-infection and HCV single-infection. Arch Virol. 2005; 150:261-71.
8. Sato S, Fujiyama S, Tanaka M, Yamasaki K, Kuramoto I, Kawano S, Sato T, Mizuno K, Nonaka S. Coinfection of hepatitis C virus in patients with chronic hepatitis B infection. J Hepatol. 1994;21:159-66.
9. Schüttler CG, Fiedler N, Schmidt K, Repp R, Gerlich WH, Schaefer S. Suppression of hepatitis B virus enhancer 1 and 2 by hepatitis C virus core protein. J Hepatol. 2002; 37:855-62.
10. Sagnelli E, Coppola N, Scolastico C, Filippini P, Santantonio T, Stroffolini T, Piccinino F. Virologic and clinical expressions of reciprocal inhibitory effect of hepatitis B, C, and delta viruses in patients with chronic hepatitis. Hepatology. 2000; 32:1106-10.
11. Zarski JP, Bohn B, Bastie A, Pawlotsky JM, Baud M, Bost-Bezeaux F, Tran van Nhieu J, Seigneurin JM, Buffet C, Dhumeaux D. Characteristics of patients with dual infection by hepatitis B and C viruses. J Hepatol. 1998; 28:27-33.
12. Rifai K, Wedemeyer H, Rosenau J, Klempnauer J, Strassburg CP, Manns MP, Tillmann HL. Longer survival of liver transplant recipients with hepatitis virus coinfections. Clin Transplant. 2007; 21:258-64.
13. Steinmüller T, Seehofer D, Rayes N, Muller AR, Settmacher U, Jonas S, Neuhaus R, Berg T, Hopf U, Neuhaus P. Increasing applicability of liver transplantation for patients with hepatitis B-related liver disease. Hepatology. 2002; 35:1528-35.
14. Huang EJ, Wright TL, Lake JR, Combs C, Ferrell LD. Hepatitis B and C coinfections and persistent hepatitis B infections: clinical outcome and liver pathology after transplantation. Hepatology. 1996; 23:396-404.
15. Raimondo G, Brunetto MR, Pontisso P, Smedile A, Maina AM, Saitta C, Squadrito G, Tono N; Associazione Italiana Studio Fegato Cooperative Group. Longitudinal evaluation reveals a complex spectrum of virological profiles in hepatitis B virus/hepatitis C virus-coinfected patients. Hepatology. 2006 43:100-7.
16. Amin J, Law MG, Bartlett M, Kaldor JM, Dore GJ. Causes of death after diagnosis of hepatitis B or hepatitis C infection: a large community-based linkage study. Lancet 2006; 368:938-45.
17. Tacke F, Trautwein C. Causes of death in hepatitis B and/or C virus infected-people - lessons for clinical practice. Hepatology. 2007; 45:1076-7.
18. Weltman MD, Brotodihardjo A, Crewe EB, Farrell GC, Bilous M, Grierson JM, Liddle C. Coinfection with hepatitis B and C or B, C and delta viruses results in severe chronic liver disease and responds poorly to interferon-alpha treatment. J Viral Hepat. 1995; 2:39-45.
19. Di Marco V, LoIacono O, Camma C, Vaccaro A, Giunta M, Martorana G, Fuschi P, Almasio PL, Craxi A. The long-term course of chronic hepatitis B. Hepatology. 1999; 30:257-64.
20. Donato F, Boffetta P, Puoti M. A meta-analysis of epidemiological studies on the combined effect of hepatitis B and C virus infections in causing hepatocellular carcinoma. Int J Cancer. 1998; 75:347-54.
21. Kubo S, Nishiguchi S, Hirohashi K, Tanaka H, Tsukamoto T, Hamba H, Shuto T, Yamamoto T, Ikebe T, Kinoshita H. Clinical significance of prior hepatitis B virus infection in patients with hepatitis C virus-related hepatocellular carcinoma. Cancer. 1999; 86:793-8.
22. Pollicino T, Squadrito G, Cerenzia G, Cacciola I, Raffa G, Craxi A, Farinati F, Missale G, Smedile A, Tiribelli C, Villa E, Raimondo G. Hepatitis B virus maintains its pro-oncogenic properties in the case of occult HBV infection. Gastroenterology. 2004; 126:102-10.
23. Squadrito G, Pollicino T, Cacciola I, Caccamo G, Villari D, La Masa T, Restuccia T, Cucinotta E, Scisca C, Magazzu D, Raimondo G. Occult hepatitis B virus infection is associated with the development of hepatocellular carcinoma in chronic hepatitis C patients. Cancer. 2006; 106:1326-30.
24. Strader DB. Understudied populations with hepatitis C. Hepatology. 2002;36(Suppl 1):226-36.
25. De Maria N, Colantoni A, Friedlander L, Leandro G, Idilman R, Harig J, Van Thiel DH. The impact of previous HBV infection on the course of chronic hepatitis C. Am J Gastroenterol. 2000; 95:3529-36.
26. Zignego AL, Fontana R, Puliti S, Barbagli S, Monti M, Careccia G, Giannelli F, Giannini C, Buzzelli G, Brunetto MR, Bonino F, Gentilini P. Impaired response to alpha interferon in patients with an inapparent hepatitis B and hepatitis C virus coinfection. Arch Virol. 1997; 142:535-44.
27. Rautou PE, Asselah T, Saadoun D, Martinot M, Valla D, Marcellin P. Hepatitis C virus eradication followed by HBeAg to anti-HBe seroconversion after pegylated interferon-alpha2b plus ribavirin treatment in a patient with hepatitis B and C coinfection. Eur J Gastroenterol Hepatol. 2006; 18:1019-22.
28. Chakvetadze C, Bani-Sadr F, Le Pendeven C, Lamontagne F, Vincensini JP, Pialoux G. Reactivation of hepatitis B virus replication during peginterferon-ribavirin therapy in an HIV/hepatitis C virus-co-infected patient with isolated anti-hepatitis B core antibodies. AIDS. 2007; 21:393-4.
29. Crockett SD, Keeffe EB. Natural history and treatment of hepatitis B virus and hepatitis C virus coinfection. Ann Clin Microbiol Antimicrob. 2005; 13: 4-13.
30. Osella AR, Misciagna G, Guerra VM, Chiloiro M, Cuppone R, Cavallini A, Di Leo A. Hepatitis C virus (HCV) infection and liver-related mortality: a population-based cohort study in southern Italy. The Association for the Study of Liver Disease in Puglia. Int J Epidemiol. 2000; 29:922-7.
31. Shi J, Zhu L, Liu S, Xie WF. A meta-analysis of case-control studies on the combined effect of hepatitis B and C virus infections in causing hepatocellular carcinoma in China. Br J Cancer. 2005; 92:607-12.
32. Liu CJ, Chen PJ, Lai MY, Kao JH, Jeng YM, Chen DS. Related Articles, Ribavirin and interferon is effective for hepatitis C virus clearance in hepatitis B and C dually infected patients. Hepatology. 2003; 37:568-76.
33. Hung CH, Lee CM, Lu SN, Wang JH, Tung HD, Chen CH, Changchien CS. Combination therapy with interferon-alpha and ribavirin in patients with dual hepatitis B and hepatitis C virus infection. J Gastroenterol Hepatol. 2005; 20:727-32.
34. Chuang WL, Dai CY, Chang WY, Lee LP, Lin ZY, Chen SC, Hsieh MY, Wang LY, Yu ML. Viral interaction and responses in chronic hepatitis C and B coinfected patients with interferon-alpha plus ribavirin combination therapy. Antivir Ther. 2005; 10:125-33.





