Ansgar Rieke, Koblenz
Hepatitis C und Niere
Die Hepatitis C kann Nierenschäden verursachen sowie eine bestehende Niereninsuffizienz verschlechtern. Dennoch werden Patienten mit stark eingeschränkter Nierenfunktion nur selten behandelt. Mittlerweile stehen hier neue, gut verträgliche Medikamente zur Verfügung. Die Heilung kommt nicht nur dem Patienten zugute. Sie senkt auch das Transmissionsrisiko in der Dialyseeinheit.
Das renale Parenchym exprimiert CD-81- und FR-B1-Rezeptoren, die es Hepatitis C-Viren ermöglichen, an der Zelloberfläche zu binden und mittels Endozytose die Zellen der Niere zu infizieren. Tatsächlich lässt sich HCV-RNA in Mesangiumzellen, Tubulusepithel, Endothelzellen des Glomerulums und dem Tubulusapparat der Niere nachweisen. Wahrscheinlich über Toll-like-Rezeptoren (TLRS) und die Bildung von Eiweißmolekülen wird eine Immunreaktion des Körpers ausgelöst, die individuell unterschiedlich verläuft und ein sehr variables Bild einer renalen Pathologie auslöst: So finden sich in Nierenbiopsien Mikrodissektionen im glomerulärem Schlingenkonvolut als TLR3-Spezifität und Formen einer membrano-proliferativen Glomerulonephritis (MPGN) als typische Manifestationsform einer Hepatitis C an der Niere. Besteht eine HCV getriggerte Kryoglobulinämie (zirkulierende Proteine, die bei Kälte präzipitieren), kann dies als Vaskulitis an der Haut (besonders der Extremitäten) Ulcera induzieren. Die Proteine werden an der Niere, im Bereich der mesangialen Matrix oder den glomerulären Kapillaren angelagert und lösen eine Immunreaktion aus. Hepatitis C und Kryoglobuline können so eine „Endotheliitis“ induzieren und durch anti-endotheliale Antikörper und Komplementaktivierung einen renalen Schaden anrichten, der alle Formen einer Glomerulonephritis nach sich ziehen kann, d.h. eine Immunkomplexglomerulonephritis, membrano-proliferative Glomerulonephritis (MPGN), membranöse GN, fokal segmentale Glomerulosklerose (FSGS), IgA-Nephritis sowie Formen einer fibrillären oder immuno-taktoiden Glomerulonephritis und Nierenbeteiligung im Rahmen einer Polyarteriitis nodosa (PAN).
Epidemiologie
Patienten mit einer Hepatitis C haben ein 23 % höheres Risiko eine Niereninsuffizienz zu entwickeln (Park et al,
2015). 11,2 % US-Veteranen mit Hepatitis C hatten im Zeitraum 2004 bis 2006 eine Niereninsuffizienz entwickelt, was
einer Inzidenzrate von 16,7/1000 Patientenjahre entspricht.
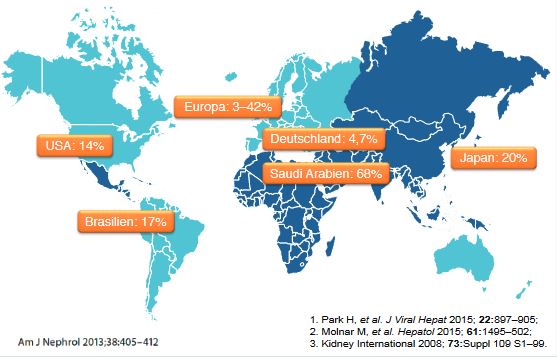
Abbildung 1: Prävalenz von chronischer Hepatitis C bei Dialysepatienten
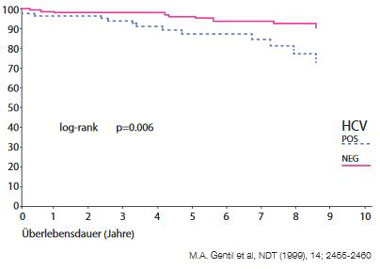
Abbildung 2a: Patientenüberleben nach Nierentransplantation mit und
ohne Hepatitis C.
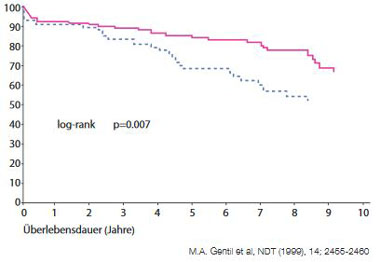
Abbildung 2b: Überleben der transplantierten Niere nach HCV-Status.
Die Seropraevalenz der Hepatitis C bei Dialysepatienten schwankt weltweit zwischen 3 % und 68 %. Sie ist in Saudi-Arabien am höchsten, gefolgt von Japan, Brasilien, USA und Deutschland mit einer Häufigkeit von 4,7 %. Die Daten basieren auf unterschiedlichen Erhebungszeiträumen und es ist ein Trend erkennbar, dass jüngere Publikationen eine niedrigere Seropraevalenz ergeben (Abb. 1).
Bedeutung
Die Hepatitis C verschlechtert die Niereninsuffizienz und erhöht die ESRD- (End-Stage-Renal-Disease) bezogene Mortalität und zwar auch bei Dialysepatienten sowie bei transplantierten Patienten (inkl. vermindertes Transplantatüberleben) (Abb. 2a und b). In einer von Beobachtung amerikanischer Krankenversicherungen fand sich ein signifikanter Zusammenhang von höherer Krankheitslast und negativem Outcome bei der Entwicklung einer Niereninsuffizienz bei Hepatitis C. Die Risiken für Depression, Sepsis, Pneumonie, Schlaganfall, Myokardinfarkt und Tod stiegen mit dem Ausmaß der Niereninsuffizienz. In einer weiteren Studie war die kumulative Mortalität bei Hepatitis C plus Nephritis, nephrotischem Syndrom und Nephrose erhöht (Abb. 3) (Lee et al, 2012).
Bei Dialysepatienten ist die Hepatitis C ein weiterer Faktor für Morbidität und Mortalität sowohl durch leberbezogene Ereignisse wie ein HCC oder Leberzirrhose als auch durch kardiovaskuläre Ereignisse. Möglicherweise ist Hepatitis C mit der Begünstigung einer Insulinresistenz, einem metabolischen Syndrom oder einer chronischen Inflammation Ursache einer verstärkten Atherogenese (Fabrici et al, 2012). Andererseits scheinen Dialysepatienten seltener eine Leberzirrhose zu entwickeln (Okuda et al, 2004).
Klinische Aspekte
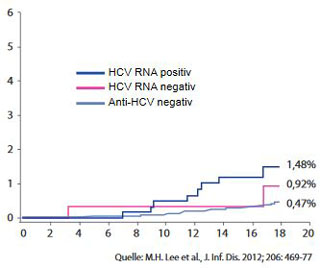
Abbildung 3: Erhöhte Mortalität bei Patienten mit Nierenerkrankung
mit/ohne Hepatitis C
Eine Niereninsuffizienz entwickelt sich bei Hepatitis C unspektakulär und ohne das typische Bild einer akuten Glomerulonephritis mit Hämaturie und Proteinurie. Nur jeder vierte Patient hat diese Symptome. Die „stille Schädigung“ der Nieren zeigt sich dann ausschließlich in einem Anstieg der Retentionswerte bzw. im Abfall der GFR - ganz gleich, ob sie durch die Formeln nach Cockgroft Gault, MDRD oder CKD-EPI gemessen wurde. Im Verlauf können unzureichende Blutdruckeinstellung, Einnahme von NSAR bei HCV-assoziierten Arthritiden, Nikotin oder Diabetes mellitus die Nierenfunktion weiter negativ beeinflussen.
Die akute Hepatitis C bei Niereninsuffizienz verläuft überwiegend anikterisch und nur mit milder Erhöhung der GPT,
meist unterhalb einer 10-fachen Erhöhung der Norm. Zu einer Serokonversion zu anti-HCV kommt es bei 90 % der
Dialysepatienten nach einem bis sieben Monaten (Lemos et al, 2007). Der Verdacht einer Infektion muss durch die HCV-PCR
bestätigt werden. In einer Studie mit monatlichen Kontrollen an 281 Dialysepatienten konnte gezeigt werden, dass in drei
Fällen die HCV-RNA der einzige Marker der Infektion war (Moreira et al, 2003). Monatliche Kontrollen der GPT und
sechsmonatliche Kontrolle auf anti-HCV sind als Screening bei Dialysepatienten ratsam. Die spontane Elimination des
Virus ist bei Dialysepatienten noch unwahrscheinlicher als bei Patienten mit normaler Nierenfunktion und wird nur in
etwa 5 % der Fälle beobachtet (Lemos et al, 2008).
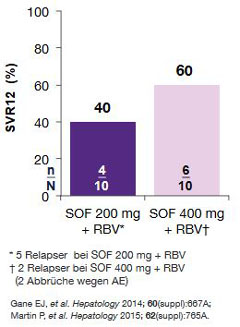
Abbildung 4:
Phase-2b-Studie mit Sofosbuvir + Ribavirin bei naiven/vorbehandelten Patienten mit GT 1/3 mit schwerer
Niereninsuffizienz (eGFR????? . keine Dialyse/keine ESRD) mit/ohne Zirrhose. Es wurden keine SAE, jedoch bei 7 Patienten
ein HB-Abfall <8,5 g/dl beobachtet.
GPT (= ALT)-Werte sind bei Dialysepatienten oft niedriger und eignen sich deshalb nicht zur Abschätzung der hepatischen Inflammation. Die Messung der HCV-PCR wird durch die Dialyse beeinflusst. Es zeigen sich insgesamt niedrigere Werte, ja sogar oft nicht messbare Ergebnisse (33 % bis 67 %, Fabrici et al, 2000), was möglicherweise durch Adhäsion von Viruspartikeln an den Dialysemembranen bedingt ist. Dieser Effekt scheint bei einer chronischen Hämofiltration ausgeprägter zu sein als bei reiner Hämodialyse. So sind auch falsch negative PCR-Untersuchungen bei Dialysepatienten möglich. Nach Nierentransplantation wurde in den meisten Studien eine Beschleunigung der Fibroseprogression und eine erhöhte leberbedingte Mortalität beobachtet (Singh, 2012). Auch das Transplantatüberleben wird negativ beeinflusst.
Therapie
Die Therapie der Hepatitis C-assoziierten Glomerulonephritis orientiert sich zunächst an den allgemeinen Prinzipien einer GN-Therapie mit Blutdruckeinstellung auf Zielwerte um 120/80 mmHg, mit antiproteinurisch wirkenden ACE-Hemmern oder Sartanen in Kombination mit Diuretika und lang wirkenden Calcium-Antagonisten. Der Einsatz von Antikoagulantien bei großer Proteinurie (nephrotisches Syndrom) muss angesichts einer oft fortgeschrittenen Lebererkrankung mit Thrombopenie und portaler Hypertension kritisch gesehen und gegenüber dem Thromboserisiko individuell abgewogen werden. Als einzige kausale Therapie bleibt die antiretrovirale Therapie der Hepatitis C als Grunderkrankung.
Antivirale Behandlung
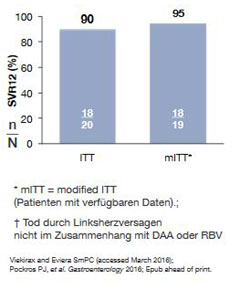
Abbildung 5: RUBY-1: 3D-Regime bei naiven Patienten mit GT1 ohne
Zirrhose mit schwerer Niereninsuffizienz oder Dialyse. Ein Patient verstarb nach Therapie nicht im Zusammenhang mit
DAA-Behandlung.
Die antivirale Therapie verbessert nicht nur die Leber-assoziierte Morbidität und Mortalität, sondern hat auch einen günstigen Einfluss auf die NierenfunktionBisher ist eine Behandlung der Hepatitis C insbesondere bei Nephrologen geprägt durch die katastrophal schlechten Erfahrungen der Interferon-Ribavirin-basierten Therapie. Starke Nebenwirkungen und niedrige SVR-Raten zwischen 31 und 60 % haben das Bild geprägt. Problematisch ist insbesondere Ribavirin. Die Substanz muss bei Niereninsuffizienz niedriger dosiert werden, ist bei Dialysepatienten besonders toxisch und kann schwere anhaltende Anämien bis hin zur aplastischen Anämie auslösen. Nach einer Transplantation war eine Interferon-basierte Therapie in aller Regel wegen der Induktion einer Abstoßungsreaktion ohnehin nicht möglich. So blieb eine solche Therapie in den früheren Leitlinien für Fälle einer fibrosierenden cholestatischen Hepatitis und lebensbedrohliche Vaskulitis vorbehalten und wurde mit hohen Dosen EPO begleitet.
Dies alles hat ein negatives Bild und eine fatalistische Grundstimmung bei Nephrologen hinterlassen, so daß nur
wenige Patienten behandelt wurden. In 12 Ländern wurden zwischen 1996 und 2011 von rund 5000 Hämodialysepatienten mit
Hepatitis C nur 48 antiviral behandelt, das sind nicht mehr als 0,01 %. Auch bei den neueren DAAs ist die
Behandlungsrealität bei Niereninsuffizienz erschütternd. Zwischen 2012 und Dezember 2014 wurden in 21 von 980
Dialysepatienten mit Hepatitis C nur zwei Patienten behandelt.
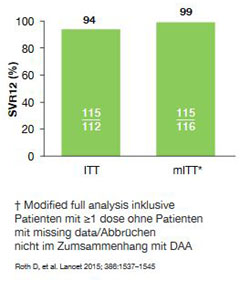
Abbildung 6: C-Surfer: Elbasvir/Grazoprevir bei Patienten
mit schwerer Niereninsuffizienz oder Dialyse.
Dem gegenüber stehen die amerikanischen Guidelines (AASLD) sowie die europäischen Leitlinien (EASL), die betonen, dass eine antivirale Therapie bei Patienten mit Kryoglobulinämie oder anderen Zeichen einer extrahepatischen Endorganmanifestation indiziert ist und priorisiert werden sollte. Hier ist zu ergänzen, dass eine Hepatitis C-Behandlung schon allein deshalb erfolgen sollte, um die Wahrscheinlichkeit der HCV-Transmission in einer Dialyseeinheit zu vermindern.
Neue DAAs und Niere
Bei Patienten mit einer mäßigen Niereninsuffizienz (eGFR > 30 ml/Min/1,73 m2) stehen grundsätzlich alle zugelassenen Therapieoptionen zur Verfügung. Die Behandlungsdauer und die Auswahl der Substanzkombinationen orientieren sich ohne Einschränkung an den vorhandenen Leitlinien bei Patienten ohne Niereninsuffizienz. Problematisch ist der Einsatz von Ribavirin. Hier muss die Dosis angepasst und auf die individuelle Verträglichkeit geachtet werden. In kleinen Studien wurde unter Ribavirin eine Niereninsuffizienz und eine Verschlechterung der Nierenfunktion beschrieben.
Die Spiegel von DAA können bei eingeschränkter Nierenleistung ansteigen (Tab. 1). Bei Patienten mit einer eGFR <
30 ml/Min/1,73 m2 ist Sofosbuvir kontraindiziert. Es wurde dennoch in zahlreichen Real-Life-Studien selbst bei schwerer
Niereninsuffizienz eingesetzt. Die Dosierung lagen bei 400 mg/d, 200 mg/d oder 400 mg jeden 2. Tag mit und ohne
Ribavirin (Abb. 4). Dieser Einsatz ist nicht durch die Fachinformation und Zulassung gedeckt.
| Veränderung der AUC im Vergleich zu Gesunden, % |
Schwere Niereninsuffizienz (eGFR <30 ml/Min/1.73 m2) |
|---|---|
| Ombitasvir | Keine Veränderung |
| Paritaprevir | ↑ ≤50% |
| Ritonavir | ↑ 114% |
| Dasabuvir | ↑ ≤50% |
| Ledipasvir | Nicht relevant |
| Sofosbuvir GS-331007 | ↑ 171% ↑ 451% |
| Simeprevir | ↑ 62% |
| Daclatasvir* | ↑ 51% |
| Grazoprevir | ↑ 65% |
| Elbasvir | ↑ 86% |
| Khatri A, et al. Hepatology 2014; 60(Suppl):320A; Harvoni, Olysio, and Daklinza SMPC (accessed October 2015); Yeh WW, et al. Hepatology 2014; 60(Suppl 4):1940 (poster presentation) | |
Tabelle 1: Pharmakokinetik der DAAs bei schwerer Nierenfunktionsstörung
Die Tripple D-Kombination (OBV-PTV-r + DSV +/-RBV) wurde in der Studie Ruby I bei Genotyp 1 erfolgreich bei 20 Patienten mit schwerer Niereninsuffizienz bzw. Dialysepflichtigkeit eingesetzt. Die SVR-Daten mit 90 % (ITT) bzw. 95 % (mITT) entsprechen denen ohne Niereninsuffizienz (Abb. 5). Die Nebenwirkungen waren moderat und haben nicht zu einem Studienabbruch geführt. Eine Verschlechterung der Nierenfunktion wurde nicht beobachtet. Die Zulassungserweiterung für den Einsatz dieser Substanzkombination ist beantragt und wird im Herbst 2016 erwartet.
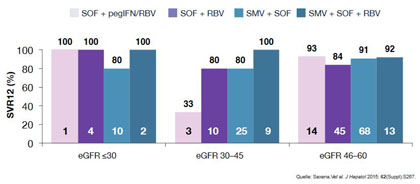
Abbildung 7: RUBY-1: 3D-Regime bei naiven Patienten mit GT1 ohne
Zirrhose mit schwerer Niereninsuffizienz oder Dialyse. Ein Patient verstarb nach Therapie nicht im Zusammenhang mit
DAA-Behandlung.
Ähnlich gute Daten liegen für die neue Fixkombination Elbasvir/Grazoprevir vor. In der Studie C-Surfer wurden 94 % (ITT) bzw. 99 % (mITT) der 122 Patienten mit Genotyp 1 bzw. 4 geheilt (Abb. 6). Das Medikament war exzellent verträglich und zeigte keine bedrohlichen Nebenwirkungen.
Real-Life-Daten
Damit stehen für den Genotyp 1 und 4 zwei potente Substanzkombinationen mit hohen SVR-Daten zur Verfügung, die eine Skepsis beim Einsatz bei niereninsuffizienten Patienten nicht mehr rechtfertigt.
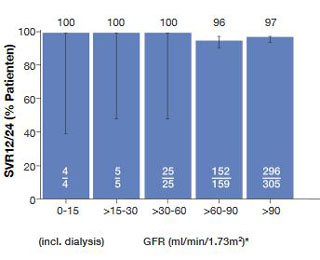
Abbildung 8: Deutsches Hepatitis C-Register:SVR in Abhängigkeit von
Nierenfunktion
In der multinationalen TARGET-Studie erzielten 80 und 100 % der Patienten mit einer GFR < 30 ml/Min/1,73m2 eine SVR (Abb. 7). Bei den Nebenwirkungen korrelierte das Ausmaß der Anämie sowie die Verschlechterung der Niereninsuffizienz mit der GFR - insbesondere bei Sofosbuvir-haltigen Therapieregimen. In Frankreich wurden Sofosbuvir-basierte Therapieregime ebenfalls eingesetzt und führten bei Genotyp 1 bei Dialysepatienten zu SVR-Raten zwischen 86% und 100%. In Deutschland wurden laut deutschem Hepatitis C-Register (DHC-R) bis zum 16. April 2016 insgesamt nur 9 Patienten mit einer GFR < 30 ml/Min/1,73 m2 behandelt. Von diesen 9 haben alle eine SVR erzielt, auch alle 4 Patienten, die an Dialyse behandelt wurden (Abb. 8).
Fazit
Die skeptische Haltung gegenüber einer Behandlung der Hepatitis C bei Patienten mit eingeschränkter Nierenfunktion ist nicht mehr gerechtfertigt. Insbesondere bei Gentoyp 1 und 4 stehen DAAs ohne Einschränkung bei Niereninsuffizienz zur Verfügung.
Extrahepatische Manifestationen der chronischen Hepatitis C
Endokrin sind die autoimmunen Schilddrüsenerkrankungen (insbesondere die Hashimoto-Thyreoiditis), eine Insulinresistenz (Diabetes mellitus) und Störungen der Wachstumshormone (GH-Insuffizienz).
Hämatologisch können lymphoproliferative
Erkrankungen und Non Hodgkin-Lyphome, die idiopathische Thromobzytopenie und monoklonale Gammopathie sowie eine
autoimmun-hämolytische Anämie im Zusammenhang mit Hepatitis C auftreten.
Dermatologisch gehören der Licher ruber
planus, die Porphyria cutanea tarda, uncharakteristische palpable Purpura und Pruritus insgesamt zu den typischen
Manifestationsformen der Hepatitis C.
Rheumatologisch gehen Formen einer HCV-assoziierten gemischten Kryoglobulinämie, positive Rheumafaktoren, Gelenkbeschwerden mit Oligo- und Polyarthritis und Sicca-Syndrom in Vaskulitiden über, die abdominell als Angina abdominalis und an der Haut als Ulcera oder an der Niere als Glomerulonephritis auffallen.
Kardio-pulmonal sind Formen einer Myopathie, Myocarditis, Kardiomyopathie und idiopathische Pulmonalfibrosen beschrieben.
Die psychiatrische Symptomatik mit chronischer Depression, psychomotorischer Verlangsamung und Müdigkeit erfasst alle Lebensbereiche der Patienten und treten unabhängig von Grad der Leberfibrose auf.





