Jörg Petersen, Hamburg
Hepatitis C geheilt Wie geht es danach weiter?
In den Jahren der PEG-IFN und Ribavirintherapien hatte sich bereits gezeigt, dass eine SVR 12, also das Fehlen von HCV-RNA 12 Wochen nach Therapieende, mit hoher Sicherheit eine Ausheilung der chronischen Hepatitis C anzeigt 1. Ein Wiederauftreten von HCV-RNA nach SVR12 wurde bereits dort zumeist als Zeichen der Reinfektion und nicht als später Relapse gewertet. Einschränkend muss hinzugefügt werden, dass sich nicht alle Studien zu der damaligen Zeit auf sichere Virus-Sequenzierungsdaten stützen konnten.
Später HCV-relapse möglich ?
Heute stimmen die amerikanischen und europäischen Zulassungsbehörden FDA und EMA darin überein, dass die SVR12 als Endpunkt von Studien mit dem Ziel der Heilung dient. Die noch aktuelle EASL Empfehlung für das Jahr 2015 (2016 folgt im September) macht recht konservativ noch das Vorliegen einer SVR48 zur Bedingung für eine absolute Bestätigung einer Heilung von der HCV 2. Aber im klinischen Alltag stellt bereits die SVR4 mit den heute verfügbaren HCV-RNA Tests nach DAA Therapie einen recht sicheren und zuverlässigen Zeitpunkt zur Heilung von der chronischen Hepatitis C dar. In Einzelfällen wurde allerdings ein Relapse nach SVR4 beschrieben. Die endgültige Einschätzung dieser Fälle erscheint schwierig, doch die phylogenetische Analysen erlauben den Schluss, dass in Einzelfällen ein Spätrelapse nach SVR4 möglich ist 3,4.
Das heißt, ein Relaps nach SVR4 ist
eine äußerst seltene Ausnahme. Verschiedene real-life Kohorten, die
auf der EASL 2016 präsentiert wurden, verdeutlichen die
Größenordnung: Bei 885 Patienten einer monozentrischen real-life
Kohorte, von denen mit DAA Therapien 92 % (ITT-Analyse) die SVR12
erreichten, wurde kein einziger Relapse nach SVR4 detektiert 4. Ein
Relaps nach SVR12 ist noch seltener. Studien belegen für den
weiteren Verlauf eine sehr hohe Konkordanz von > 99 % für
SVR12 und SVR24 Daten 5.
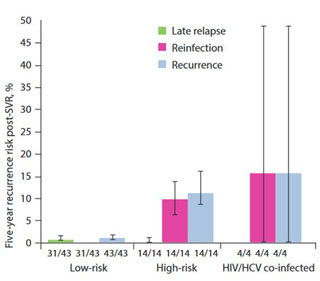
Abbildung 1: Gepoolte Schätzungen des 5 Jahresrisiko der Rekurrenz von HCV nach SVR 12 (Reinfektion versus late relapse). Gezeigt sind auch Anzahl der Studien, die diesen Schätzungen zugrunde liegen. Simmons et al, CID 2016:62:683-94
Für die neuen DAA Therapien gibt es noch keine kontrollierten Langzeitstudien, jedoch ist im März diesen Jahres eine große Metaanalyse zur Fragestellung einer HCV-Reinfektion versus spätem Relapse erschienen 6, in der bereits Studien aus der Übergangsphase zum DAA Zeitalter unter Verwendung Proteasehemmer erster Generation berücksichtigt wurden. Die Hauptaussage dieser Metaanalyse: Die SVR bleib bei der großen Mehrheit der Patienten über einen Beobachtungszeitraum von 5 Jahren stabil. In den Untergruppen von Personen mit IV Drogengebrauch oder homosexuellen Männern mit HIV-Koinfektion kam es zu deutlich höheren Reinfektionsraten, nicht jedoch zu spätem Relapse (Abb. 1). Im Zeitalter der immunmodulatorischen IFN-Therapien wurde bei den Patienten mit HIV-Koinfektion postuliert, dass die HIV-bedingte Immunsuppression ein Einfluss auf höhere Rekurrenzraten im Sinne von Viruspersistenz haben könnte. Mit den neuen DAA-Therapien erübrigen sich solche Überlegungen, da HIV-Patienten in diesem Sinne keine besondere Personengruppe mehr darstellen. Zur Detektion einer Reinfektion rät die EASL derzeit dementsprechend zu jährlichen HCV-RNA Nachkontrollen nur noch in den Risikogruppen 2, nicht aber mehr bei allen geheilten Patienten. Hier ist mit der SVR 24 der allerletzte Testzeitpunkt erreicht.
Rückbildung von Fibrose / Zirrhose?
Die Reversibilität von Fibrose ist in unterschiedlichsten Szenarien von Lebererkrankungen im Sinne eines „proof-of-principle“ nachgewiesen worden. Auch bei Hepatitis C Patienten kann es in der Leber nach SVR zur Inaktivierung, Seneszenz oder Apoptose hepatischer Sternzellen und Myofibroblasten, zu verstärkter Kollagenaseaktivität und Hepatozytenrepopulation und zu einem Remodeling von Mikrogefäßstrukturen kommen, was schließlich in einer Degradation extrazellulärer Matrix mündet und als Fibroseregression kenntlich wird 7.
Bislang gibt es allerdings nur wenige Daten von geheilten HCV Patienten mit gepaarten Leberbiopsien, um den Verlauf von Fibrose quantitativ genauer zu untersuchen. In einer japanischen Studie an 183 Patienten mit SVR zeigten gepaarte Leberbiopsien nach 3,7 Jahren eine durchschnittliche Regression der Fibrose von 0,28 Einheiten pro Jahr 8. Eine weitere Studie an 49 SVR-Patienten mit gepaarten Biopsien zeigte ein ähnliches Bild. Es kam zur Regression bei 80 %, zu keiner Verbesserung der Fibrose in 20 % der Patienten 62 Monate nach Therapieende 9. In einer dritten, kürzlich publizierten Studie an 97 SVR-Patienten kam es zu einer Regression von Fibrose in 45 % der Fälle, zu einem stabilen Bild in 48 %, und zu einer Fibroseprogression in 6 % der untersuchten Patienten 5,8 Jahre nach Therapieende 10. In dieser Studie war zudem die kumulative Inzidenz von hepatozellulären Karzinomen (HCCs) signifikant höher in der Subgruppe von Patienten mit progressiver Fibrose (33 % versus 4 %).
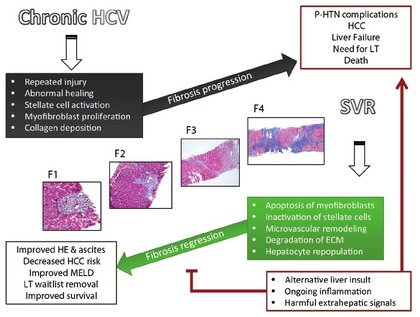
Abbildung 2: Fibroseprogression und Regression bei chronischer Hepatitis C. Aus Gonzalez HC, Duarte-Royo A. Virologic cure of Hepatitis C: Impact on Hepatic Fibrosis and Patient outcomes. Curr Gastroenterol Rep 2016;18:32
Somit scheint es sich bei einer
Fibroseregression nach SVR nicht nur um einen sehr langsamen Prozess
zu handeln, sondern auch um einen heterogenen, nicht uniformen
Vorgang, der individuell bislang nur schwer prognostizierbar ist.
Diese leberpunktions-gestützen Studien werden durch weitere
nichtinvasive Studiendaten mit Fibroscan bestätigt 11.
Einschränkend muss aber erwähnt werden, dass
Leberelastizitätsmessungen nicht unterscheiden können zwischen
Rückgang der Inflammation (Mikroödem) und echter Fibroseregression.
Inwieweit eine komplette Leberzirrhose nach SVR reversibel ist, bleibt vermutlich auch die nächsten Jahre umstritten. Trotz verschiedener Untersuchungstechniken haben die Studien bislang ein sehr breites Spektrum an Ergebnissen erbracht. Einer beobachteten Regression einer Zirrhose steht häufig eine nicht erkennbare Veränderung gegenüber. Dennoch scheint mittlerweile die übereinstimmende Meinung in der Literatur zu sein, dass in Einzelfällen eine Zirrhoseregression mit Verschwinden von micro-shunts, Reduktion von Kollagengehalt, und mit einem sogenannten Remodeling der Leber über einige Jahre nach SVR möglich erscheint (reviewed in 16). Die große Mehrheit von Patienten mit Zirrhose scheint jedoch keine wirkliche Regression zu zeigen 16. Dieser Aspekt ist im Alltag für die weitere Überwachung dieser Patienten von Bedeutung (siehe weiter unten).
Der Verlauf der Fibrose scheint zudem durch die positive oder negative Beeinflussung anderer Leber-assoziierter Komorbiditäten wie Alkoholkonsum, Adipositas, Steatose und Diabetes mellitus getriggert zu werden (Abb. 2).
Leber-assoziierte Morbidität
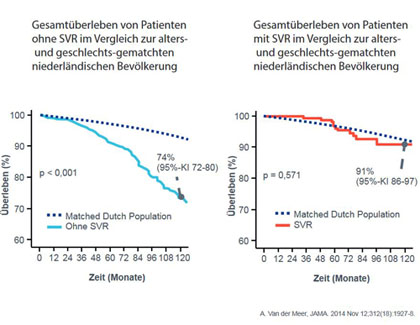
Abbildung 3: Das Überleben von SVR-Patienten ohne Zirrhose ist vergleichbar mit der Normalbevölkerung. Van der Meer A, Wedemeyer H, Feld JJ, et al. JAMA 2014;312:1927-28
Schon in der Interferonzeit wurde beschrieben, dass das leberbedingte Morbiditäts- und Mortalitätsrisiko nach einer Heilung von der Hepatitis C im Vergleich zu nicht erfolgreich therapierten Patienten sinkt. Zuletzt haben van der Meer und Koautoren 2014 gezeigt 12, dass sich nach einer SVR das Gesamtüberleben von HCV-Patienten nicht mehr von einer alters- und geschlechts-gematchten Bevölkerungsgruppe ohne SVR unterscheidet – allerdings trifft diese Beobachtung nur für Patienten ohne Zirrhose zu (Abb. 3).
In einer kürzlich veröffentlichten Metaanalyse mit mehr als 33.000 erfolgreich therapierten HCV-Patienten 13 betrug die 5-Jahresmortalität in der Gesamtkohorte 1,98 %, im Vergleich zu 4,9 % in der Subgruppe der Patienten mit Zirrhose. Das Risiko, an einem HCC zu erkranken, betrug nach 5 Jahren 2,9 % in der Gesamtkohorte, jedoch 5,3 % in der Zirrhosegruppe. In einer schottischen Kohorte von 1215 therapierten HCV-Patienten war das im Vergleich zu einer Normalbevölkerungsgruppe gematchte Morbiditätsrisiko für eine leberassoziierte Hospitalisierung für Zirrhosepatienten nach SVR 10,5 fach erhöht und für Patienten ohne Zirrhose nach SVR 5,9 fach erhöht 14. Schließlich zeigten Daten aus einer taiwanesischen Studie an 642 geheilten HCV-Patienten ein 5-Jahresrisiko für die Entstehung eines HCC von 22,6 % in zirrhotischen versus 3,2 % in nicht-zirrhotischen Patienten 15.
Aus diesen Daten wird klar ersichtlich, dass Patienten mit Zirrhose vor HCV-Therapie auch nach Heilung von der Hepatitis C ein weiterhin erhöhtes Morbiditäts- und Mortalitätsrisiko aufweisen und gezielt Surveillanceprogrammen zugeführt werden müssen. Wenn auch die Determinanten für eine HCC-Entstehung nach SVR nicht entschlüsselt sind, scheinen neben der Schwere der Grunderkrankung Kofaktoren wie Alkoholkonsum, Diabetes, NASH und Steatose eine Rolle zu spielen 16.
Surveillance Empfehlungen
| AASLD | EASL | APASL | |
|---|---|---|---|
| Screening-Methode | US | US | US und AFP |
| Intervall (Monate) | 6 | 6 | 6 |
Abbildung 4: Wie soll gescreent werden – internationale Leitlinienempfehlungen der AASLD, EASL, und
APASL
Die EASL empfiehlt ein zeitlich unbegrenztes HCC-Screening für Patienten mit Zirrhose sowie für Patienten mit fortgeschrittener Fibrose, üblicherweise in sechsmonatlichen Intervallen, auch nach SVR. Die Rationale für dieses Screeningintervall: Die mittlere Verdopplungszeit eines HCC liegt bei etwa 140-200 Tagen. Ein Screeningintervall von 12 Monaten würde die Sensitivität des Screenings um etwa 20 % (von etwa 70 % auf 50 %) reduzieren 17. Die zusätzliche Bestimmung des Marker Alpha-Fetoprotein (AFP) wird aufgrund der geringen Spezifität zunehmend umstritten diskutiert. Die aktuellen europäischen EASL- und amerikanischen AASLD-Leitlinien empfehlen im Gegensatz zur asiatischen APASL-Leitlinie diese Bestimmung nicht mehr (Abb. 4). Die AFP-Bestimmung wird aber dennoch vielerorts routinemäßig weiterhin durchgeführt (so auch in der Institution des Autors), weil durch wiederholte Abnahmen in Einzelfällen doch eine frühe Tumorentwicklung sichtbar werden kann.
Eine regelmäßige HCC-Surveillance wird auch empfohlen unabhängig vom Fibrosegrad, wenn Komorbiditäten wie Alkoholabusus und Diabetes vorliegen 2. Die portale Hypertension stellt einen starken Risikofaktor für die Entstehung eines HCCs dar 18. Diese Patienten sollten besonders gründlich gescreent werden, derzeitig werden für diese Subgruppe dreimonatige Intervalle diskutiert. Im klinischen Alltag würde dies allerdings zu einem erheblichen Mehraufwand führen.
Die Zukunft wird zeigen, ob HCV-Patienten mit weit fortgeschrittener Zirrhose, die in den IFN-Zeiten keiner Therapie zugeführt werden konnten, nunmehr aber mit den DAAs in vielen Fällen geheilt werden können, nach SVR eine gesonderte, engmaschigere HCC-Überwachung benötigen. Für diese Patientengruppe mit nur noch marginal kompensierter Zirrhose ist bislang unklar, wie groß der eigentliche Benefit einer Heilung von der Hepatitis C in Bezug auf die Reduktion der Morbidität und Mortalität tatsächlich ist. Diese Frage werden künftige Langzeitstudien beantworten. Die Empfehlungen der EASL beschreiben derzeit explizit die Situation einer SVR bei fortgeschrittener Zirrhose, aber aus Mangel an zuverlässigen Daten, gibt es keinen Unterschied zu den anderen Patientenpopulationen. Gleichermaßen gibt es bislang auch keine Empfehlungen zu einer ggf. reduzierten Überwachungsstrategie von Patienten mit SVR, bei denen es zu einer detektierbaren Regression von Fibrose gekommen ist.
Erhöhtes HCC-Risiko nach DAA?
Auf der EASL 2016 und in den einschlägigen hepatologischen Journalen wird derzeit eine Beobachtung sehr kontrovers diskutiert: In zwei Studien aus Spanien und Italien 19,20 wurden bei Patienten mit fortgeschrittener Zirrhose und zuvor therapierten HCCs nach erfolgreichen DAA Therapien frühzeitig erneut HCCs beobachtet. Innerhalb von sechs Monaten nach Therapieende kam es bei einem Drittel der Patienten zum unerwartet frühzeitigen Wiederauftreten der Lebertumoren. In beiden Studien zeigte sich dieses Risiko auch nach HCV Eradikation.
Im Interferonzeitalter war das Leberkrebsrisiko nach HCV-Heilung, vermutlich auch durch die immunmodulatorische und in weitestem Sinne antikanzerogene IFN-Wirkung deutlich erniedrigt. Eine direkt kanzerogene Wirkung der nur kurzfristig eingesetzten neuen DAAs ist bislang nicht bekannt weder aus klinischen noch aus präklinischen Studien. Auch sind alle DAA-Therapien als Klasseneffekt genannt, die Patienten in den genannten Studien erhielten sehr verschiedene Therapie-regime. Eine Vermutung könnte hier in die Richtung eines Immune Escape Mechanismus von Tumorzellen gehen. Nach rascher Elimination von HCV und starken Regenerations- und Proliferationsreizen in der bereits sehr vorgeschädigten Leber fehlen gleichzeitig ausreichende immuninduzierte Zelltodsignale.
Die bisherigen Beobachtungen beschränken sich auf Patienten mit Zirrhose und bereits zuvor therapierte HCCs. In der Studie von Buonfiglioli et al 20 wurden allerdings sechs Monate nach Therapieende auch neu aufgetretene HCCs bei 3 % der Patienten detektiert.
Allerdings erhalten seit 2014, im
Gegensatz zum Interferonzeitalter, aufgrund der sehr gut
verträglichen DAA-Therapien Patienten mit deutlich
fortgeschrittenerer Zirrhose im Stadium Child Pugh B oder sogar C die
Chance zur erfolgreichen HCV-Elimination. Somit werden wir in den
nächsten Jahren vermutlich auch mehr Patienten mit
Zirrhosebedingten Komplikationen inklusive HCC in den
Statistiken „erfolgreich“ therapierter HCV-Patienten finden, da
es wohl einen noch genauer zu definierenden „point-of-no-return“
für Patienten mit dekompensierter Zirrhose gibt, hinter dem ein
Gesamtbenefit für den individuellen Patienten fraglich erscheint 21
.
Dieser Aspekt ist vermutlich unabhängig von den zuvor geschilderten
Beobachtungen in den beiden Studien, sondern bezieht sich auf das
individuelle Risiko bei fortgeschrittener Zirrhose.
Interessanterweise zeigen zwei weitere jüngst publizierte Studien keinen Anhalt für eine erhöhte HCC Rate bei Patienten mit fortgeschrittener oder dekompensierter Zirrhose 22,23, womit diese sehr wichtige Diskussion bislang nicht entschieden ist und sicherlich weitergeführt werden muss. Dementsprechend hat auch die Europäische Arzneimittelagentur EMA im April 2016 diese Beobachtungen aufgegriffen und eine systematische Untersuchung dieser HCC-Fälle für alle DAAs angeordnet 24.





