Dietrich Hüppe, Herne
Deutsches Hepatitis C-Register
Behandlungsrealität in Deutschland

Dietrich Hüppe, Herne
In Deutschland gibt es das DHC-R, in den USA TRIO und TARGET. Was unterscheidet die Kohorten?
Dr. Hüppe: Der wichtigste Unterschied liegt auf der Hand: In TARGET und TRIO sind fast ausschließlich amerikanische Patienten erfaßt. Das spiegelt nicht den Behandlungsalltag in Deutschland wieder. Weitere Unterschiede sind: TARGET und TRIO starteten früher, da dort die DAA früher verfügbar waren, und in den USA nehmen fast nur Kliniken teil, während im DHC-R neben Kliniken und Uni.Kliniken überwiegend niedergelassene Ärzte Patienten dokumentieren und somit die Versorgungsrealität in Deutschland gut abbilden.
Die ersten SVR-Daten wurden im Frühjahr auf dem internationalen Leberkongress in Barcelona vorgestellt. Hat Sie da etwas überrascht?
Dr. Hüppe: Zunächst waren wir waren sehr zufrieden, dass uns wie geplant ein Überblick über die ganze Bandbreite der HCV-Therapie in Deutschland gelungen ist. Ca. ein Drittel der in Deutschland behandelten Patienten dürften im Register dokumentiert sein. Aufgrund des unterschiedlichen Zeitpunktes der Medikamentenzulassung sind alle Therapieregime repräsentiert, von Interferon plus Sofosbuvir bis hin zum 3D-Regime.
Die meisten Patienten hatten Genotyp 1 und wir waren erleichtert, dass sich die SVR-Raten der Studien auch im DHC-Register realisieren ließen. Selbst in der initialen Phase der Interferon-freien Therapie, in der sehr viele Zirrhotiker mit Simeprevir/Sofosbuvir oder Daclatasvir/Sofosbuvir behandelt wurden, wurden SVR-Raten um 90% erzielt. Negativ überrascht hat dagegen das Ergebnis bei Genotyp 2.
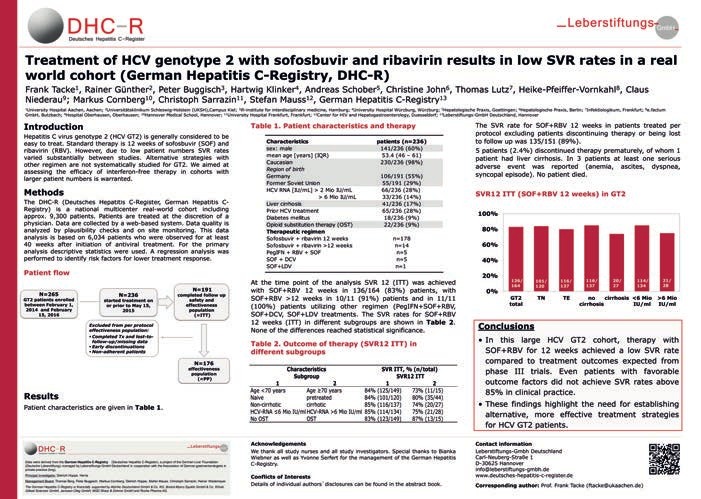
Bei GT 2 war die SVR-Raten mit Sofosbuvir/Ribavirin geringer als in den Studien. Wie kommt das?
Dr. Hüppe: Die SVR nach 12 Wochen Sofosbuvir plus Ribavirin beim Genotyp 2 lag in den von der Fallzahl her kleinen Zulassungsstudien bei bis zu 95%, im DHC-Register jedoch nur bei rund 80%. Der Grund für dies schlechte Abschneiden ist bislang nicht klar. Wir gehen der Frage nach, ob in dieser Gruppe gehäuft die sogenannte St. Petersburg-Virusvariante vorliegen, also eine Chimäre aus GT 1 und 2, die phänotypisch als Genotyp 2 erfaßt wird.
Was hat sich beim Genotyp 3 bewährt?
Dr. Hüppe: Hier waren 24 Wochen
Sofosbuvir/Ribavirin mit 80 % Heilungsrate nicht ausreichend.
Sofosbuvir/Daclatasvir 12 Wochen führte dagegen genauso wie in den
Studien bei über 90 % der Patienten ohne Zirrhose zur Heilung.
Einige Patienten wurden auch mit dem „englischen“ Schema,
nämlich 12 Wochen Sofosbuvir plus Interferon und Ribavirin
behandelt, und zwar auch mit excellenten Ergebnissen, selbst bei
Zirrhose.
Haben Sie auch Daten zu den seltenen Genotypen 4, 5 und 6?
Dr. Hüppe: Beim Gentoyp 4 wurden über 100 Patienten erfasst. Die große Mehrzahl wurde mit dem AbbVie-Regime oder Sofosbuvir/Ledipasvir geheilt. Genotyp 5 oder 6 waren nur Einzelfälle, so dass keine zuverlässige Aussage möglich ist. Ich kann nur sagen, diese wenigen Patienten erhielten meist ein Sofosbuvir-basiertes Regime mit gutem Erfolg.
Bei über 9000 Patienten im Register sind sicherlich auch Subgruppen-Analysen interessant....
Dr. Hüppe: Wir haben zunächst die Subgruppe der Älteren ins Auge gefasst. Früher waren ja die über 70-jährigen insbesondere auf Grund der zu erwartenden Nebenwirkung und Multimorbidität schwieriger zu behandeln. Mit den DAA ist das nicht so. Alter ist kein negativer Prädiktor mehr, die Therapie gelingt sehr gut mit hoher Therapietreue der Patienten.
In den Leitlinien wird die zusätzliche Gabe von Ribavirin oft als Option genannt? Wird Ribavirin in Deutschland noch viel eingesetzt?
Dr. Hüppe: Diese Frage läßt sich
nicht abschließend beantworten. In der Dokumention ergibt sich kein
erkennbarer Unterschied in den Heilungsraten mit/ohne Ribavirin..
Wurde zu Beginn des Registers häufiger länger behandelt (24 Wochen)
und Ribavirin hinzugefügt, so reduzierte sich die Therapiedauer und
Ribaviringabe im Verlauf des Registers, weil die Behandler mehr
Vertrauen in die Effizienz der
Behandlung gewonnen haben.
Welche Auswertungen laufen noch und auf welche sind Sie besonders gespannt?
Dr. Hüppe: Es laufen noch sehr viele Auswertungen. HIV-Koinfizierte und Suchtpatienten wurden meist nicht zu Beginn der DAA-Ära behandelt, so dass wir erst jetzt größere Patientenzahlen analysieren können. Besonders spannend finde ich die Frage, ob sich die Leberstruktur im Laufe der Therapie verändert. Wir haben von vielen Patienten das Ergebnis einer Fibroscan-Untersuchung vor und zum Ende der Behandlung, um den Fibroserückbau in der Leber nach erfolgreicher Therapie zu erfassen.
Im DHCR gab es eine Pause in der Dokumentation. Warum?
Dr. Hüppe: Die Dokumentation neuer Patienten musste im September 2015 gestoppt werden. Das Register wird über Verträge mit den DAA-Herstellern finanziert. Im September 2015 war die Zahl der mit Gilead Sciences vereinbarten Dokumentationen erreicht und die Firma hat vertraglich die Anzahl der Sofosbuvir basierten Dokumentationen nicht erhöht. Das kam für uns überraschend. Bei der Planung des Registers vor Beginn der DAA-Ära war nicht abzusehen, welche Medikamenten wann zugelassen und welche Substanzen sich im Markt durchsetzen würden. Insbesondere die Möglichkeit der Therapieverkürzung bei Genotyp 1 mit Sofosbuvir/Ledispasvir (Harvoni®) war nicht vorherzusehen.
Jetzt geht es aber weiter. Können alle Regime dokumentiert werden?
Dr. Hüppe: Seit August ist das Register für neue Patienten wieder geöffnet. Das Studienprotokoll wurde modifizert und jetzt können viele Therapieoptionen wieder dokumentiert werden, Ausnahmen bilden Therapien mit Sofosbuvir allein (mit oder ohne Ribavirin) und die Gilead-Fixkombination Sofosbuvir/Ledipasvir . Hier sind genügend Daten für wissenschaftliche Auswertungen vorhanden. Für die neue Kombination Sofosbuvir/Velpatasvir verhandeln wir zurzeit mit Gilead, um eine Dokumentation im Register möglich zu ermöglichen.
Wie sieht die Zukunft des DHC aus? Wie lange wird weiter dokumentiert werden?
Dr. Hüppe: Nicht nur die Effizienz der Hepatitis C-Therapie ist wichtig. Wir möchten auch erforschen, welchen Nutzen die Behandlung langfristig hat. Deshalb soll die Dokumentation auch nicht 24 Wochen nach Therapieende aufhören. Die Patienten sollen jährlich nachbeobachtet werden. Wir sollen wissen, wie die Lebererkrankung verläuft, ob sich die Leberstruktur bessert und weniger Leberkarzinome auftreten. Wir wollen wissen, ob sich die Lebensqualität der Patienten langfristig verbessert und ob es Hinweise auf Langzeit-Toxizitäten gibt.
Vielen Dank für das Gespräch!
Das Deutsche Hepatitis C-Register wird von der Deutschen Leberstiftung über die Leberstiftungs-GmbH Deutschland in Kooperation mit dem bng (Berufsverband niedergelassener Gastroenterologen Deutschlands e. V.) geführt.
Finanziell unterstützt wird das Register von den Firmen AbbVie Deutschland GmbH & Co. KG, Bristol-Myers Squibb GmbH & Co.KGaA, Gilead Sciences GmbH, Janssen-Cilag GmbH, MSD Sharp & Dohme GmbH und Roche Pharma AG





