Peter Buggisch, Hamburg
Interferon-frei im klinischen Alltag
Mit der Zulassung neuer direkt antiviraler Substanzen (DAA) in rascher Folge seit Januar 2014 hat sich die Hepatitis C- Therapie in Deutschland nahezu völlig zur Interferonfreien Behandlung gewandelt. Gerade vor dem Hintergrund der Zulassung einiger dieser neuen Therapieoption nur auf dem Boden von Phase 2-Studien (z.B. Simeprevir, Daclatasvir) aber auch fehlender Antworten zu speziellen Patientengruppen wurden die Daten zum Einsatz dieser DAAs der 2. Generation mit Spannung erwartet.
Die DAA der ersten Generation Boceprevir und Telaprevir hatten im klinisichen Alltag („Real Life“) im Vergleich mit den Zulassungsstudien schlechtere Ergebnisse und auch Sicherheitsprobleme (z.B. Niere) gezeigt. Bei den letzten Tagungen der AASLD und der EASL wurden jetzt zahlreiche Real Life-Ergebnisse zur Sofosbuvir (SOF)-basierten Therapie aus verschiedenen Ländern gezeigt und gaben einen ersten Eindruck über den Einsatz im Alltag, selbst wenn aus einigen Kohorten bisher nur vorläufige Resultate vorliegen.
Erfolg im Alltag
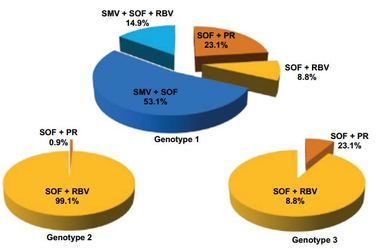
Abbildung 1:TARGET-Verteilung der Regime. - Jensen et al . AASLD 2014. Abstract 45
Grundsätzlich bestätigen die Kohortendaten die exzellenten Resultate der Zulassungsstudien der neuen Medikamente. Auch im Praxisalltag lassen sich Heilungsraten von 85+ % erzielen! Die Verträglichkeit und die Akzeptanz durch die Patienten sind sehr gut, nur sehr wenige Patienten brechen die Therapie ab. Erfreulicherweise fanden sich auch keine wesentlichen neuen Sicherheitssignale, wenn man von der kürzlichen Warnung vor dem Einsatz von Amiodaron (und u.U. anderen Antiarrhythmika) zusammen mit Sofosbuvir absieht.
Die Real Life-Daten reflektieren außerdem gut die VerfüG-BArkeit in den jeweiligen Ländern sowie Einschränkungen in den Einsatzgebieten z.B. durch Restriktion auf bestimmte Fibrosestadien.
US-Daten
In den USA war 2014 die Interferon-freie Behandlung über lange Zeit nur mit Sofosbuvir plus Ribavirin oder Sofosbuvir plus Simeprevir möglich. Daclastasvir ist in den USA nicht zugelassen und Ledipasvir ist erst seit Oktober 2014 erhältlich. Die beiden großen amerikanischen Kohorten TARGET und TRIO, die mehrere tausend Patienten umfassen, zeigen deshalb bisher nur Ergebnisse zur Kombination von Sofosbuvir+Ribavirin sowie Sofosbuvir + Simeprevir ± Ribavirin.
TARGET
TARGET
ist ein Netzwerk mehrerer akademischer und nicht akademischer
Leberzentren unter Einschluss einiger weniger europäischer Zentren.
Das Netzwerk wird von verschiedenen Pharmaunternehmen
unterstützt und beteiligt auch Patientenorganisationen.
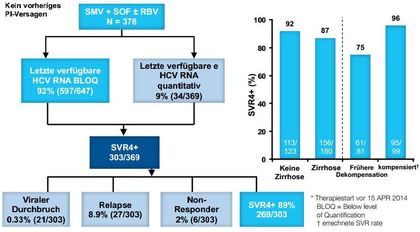
Abbildung 2:TARGET-SMV + SOF ± RBV bei Genotyp 1. - Jensen, et al. AASLD 2014. Abstract 45
Insgesamt wurden weit über 2000 Patienten eingeschlossen. Davon wurden die meisten Interferon-frei behandelt. Das Verteilungsmuster ist in Abb. 1 dargestellt. Die Interferon-basierten Therapien nahmen über die Zeit deutlich ab. Die SVR-Raten (hauptsächlich noch SVR 4) liegen beim Genotyp 1 bei der Kombination Simeprevir/Sofosbuvir bei 89 % (Abb. 2) und damit ziemlich nahe an den Ergebnissen der Phase-2-Studie COSMOS. Viele Faktoren, die früher negative Prädiktoren waren (z.B. Alter, Adipositas), scheinen keine Rolle mehr zu spielen. Allerdings schneiden Patienten mit Zirrhose und insbesondere früherer Dekompensation immer noch schlechter ab. Weitere negative Prädiktoren sind Vortherapien mit Proteaseinhibitoren und der Subtyp 1a, vermutlich wegen der Q80K-Mutation.
Auf dem Internationalen Leberkongress der EASL wurden jetzt zwei weitere interessante Subgruppenanalysen von TARGET vorgestellt: Patienten mit dekompensierter Zirrhose und Patienten mit fortgeschrittener Niereninsuffizienz. Bei den fortgeschrittenen Patienten war die Kombination Sofosbuvir plus Ribavirin deutlich unterlegen (Abb. 3). Dies ist gerade beim Genotyp 3 von Relevanz, da es sich um die derzeitig einzige vom G-BA positiv bewertete Kombination handelt. Die Ergebnisse für Patienten in unterschiedlichen Stadien der Niereninsuffizienz sind dagegen erstaunlich gut (Abb. 4). Allerdings sollte Sofobuvir unterhalb einer GFR von 30 ml/Min nicht eingesetzt werden.
TRIO
TRIO
ist ein amerikanisches Netzwerk, das insbesondere die abgebenden
Apotheken mit einbezieht. Es wurden über 950 Patienten dokumentiert
und es gibt etwas mehr Daten zu Therapieabbrüchen. Insgesamt
bestätigt TRIO die Erkenntnisse der TARGET-Analyse mit sehr guten
SVR-Raten, überzeugender Sicherheit und Verträglichkeit sowie
niedrigen Abbruchraten (Abb. 5). Im Gesamtkollektiv starben 9/954
(<1 %)
Patienten, alle nicht im Zusammenhang mit der Behandlung. Im
Unterschied zu TARGET konnte in TRIO kein wesentlicher Unterschied
zwischen 1a und 1b belegt werden.
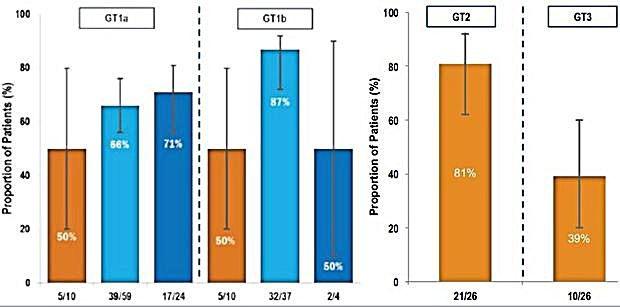
Abbildung 3:HCV-TARGET (nur dekompensierte Zirrhose) : SVR12 nach Genotyp und Vorbehandlung. - Reddy, et al. EASL 2015. Abstract 007
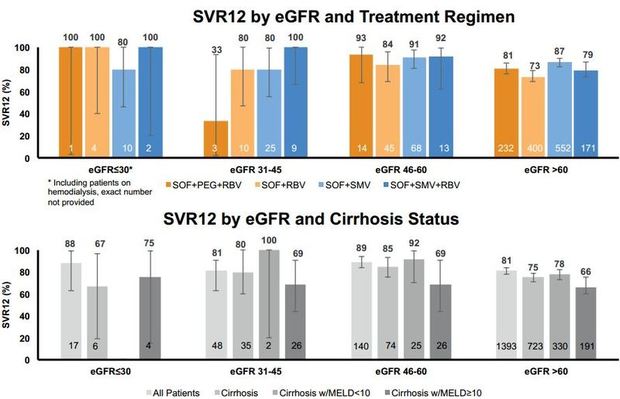
Abbildung 4:TARGET - SVR12 nach eGFR und Therapie oder eGFR und Zirrhose. - Saxena et al. EASL 2015. Abstract LP08
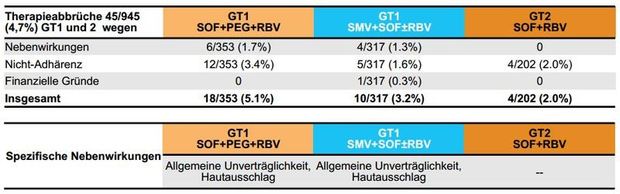
Abbildung 5:TRIO-Abbrüche und Nebenwirkungen. - Dieterich et al. EASL 2015. Abstract P0775
Französische Daten
Im französischen Real Life-Programm ANRS HEPATHER sollen insgesamt 15.000 Patienten eingeschlossen und über 7-8 Jahre beobachtet werden. Derzeit sind bereits über 7.000 Patienten erfasst. Trotz dieser großen Patientenanzahl wurden bisher nur für relativ wenige Patienten SVR-Daten präsentiert. Im Unterschied zu den US-Kohorten wurden in Frankreich auch viele Patienten mit der Kombination Sofosbuvir + Daclatasvir behandelt. Beim Genotyp 3 ist diese Kombination von besonderem Interesse. Hezode (Hezode C, EASL 2015, LP05) stellte eine Subgruppe mit 601 Patienten mit Genotyp 3 vor, von denen über 70 % eine Zirrhose hatten. Die Ergebnisse für diese schwierige Gruppe mit 76 % bzw. 88 % SVR 4 sind vielversprechend, auch wenn nur wenige Patienten Ribavirin erhielten und die bisher vorgestellte Fallzahl eher klein war.
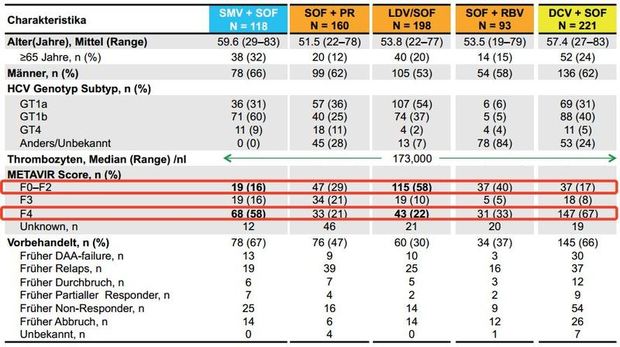
Abbildung 6:SOFGER-Kohorte: Patientencharakteristika zu Baseline. - Buggisch et al. EASL 2015. Abstract P0777
Englische Daten
Das englische Early Access Programm wurde zur Behandlung von Patienten mit dekompensierter Zirrhose initiert. 437 Patienten wurden eingeschlossen und rund 95% der Patienten hatten tatsächlich auch eine dekompensierte Zirrhose. Das Stadium war bei rund 70 % Child-Pugh B oder C. Fast 40 % hatten aktuell Aszites. Es handelt sich also um ein wirklich sehr krankes Patientenkollektiv, zu deren Behandlung die Ärzte frei zwischen Sofosbuvir + Daclatasvir ± Ribavirin und Sofosbuvir/Ledipasvir ±Ribavirin für 12 Wochen wählen konnten. Beim Genotyp 1 entschieden sich deutlich mehr für die Variante Sofosbuvir/Ledipasvir + Ribavirin, während beim Genotyp 3 mehr Ärzte Sofosbuvir + Daclatasvir + Ribavirin favorisierten. Die Ergebnisse zeigen erstaunlich gute Resultate, auch wenn sich bei diesem kranken Kollektiv geringere SVR-Raten (ca. 82% Genotyp 1, ca. 70 % Genotyp 3) realisieren ließen. Wichtig ist in diesem Zusammenhang sicherlich die Erkenntnis, dass sich kurzfristig trotz erfolgreicher Behandlung nur bei etwa 40 % der Patienten eine klinische/laborchemische Besserung einstellt und dass es bei einigen wenigen Patienten (insbesondere mit niedrigem Albumin) sogar zur Verschlechterung kommt.
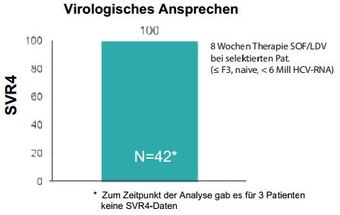
Abbildung 7: Deutsche Real-World-Daten zur 8 Wochen Therapie mit SOF/LDV. - Buggisch P et et al. EASL 2015, LP 32
Deutsche Daten
Obwohl
das deutsche Hepatitis C Register (DHCR) erst später als die
anderen Kohorten startete, gibt es schon einige Real Life-Daten aus
Deutschland. In der SOFGER-Kohorte, an der sich fünf BNG-Zentren und
die Universtitätsklinik Frankfurt beteiligten, spiegelt sich der
Behandlungsalltag in Deutschland vor dem Register-Start wieder (Abb.
6).
Nach September 2014 wurde in Deutschland nicht mehr mit Interferon behandelt. Interferon-frei wurden initial vor allem Patienten mit höhergradiger Fibrose behandelt, jedoch im Lauf der Zeit und insbesondere nach der Zulassung der Fixkombination Sofosbuvir/Ledipasvir sieht man einen Trend zu Behandlung auch niedriger Fibrosestadien. Im Compassionate Use Programm (europäisch) erzielte man mit Sofosbuvir + Daclatasvir über 24 Wochen bei Patienten mit fortgeschrittener Erkrankung SVR12-Raten von fast 95 % allerdings mit noch kleinen Fallzahlen (Welzel TM., EASL 2015, P0722). Vorgestellt wurden auch erste Real Life-Daten zu Sofosbuvir/Ledipasvir über 8 Wochen bei selektierten Patienten ( ≤ F3, HCV-RNA < 6 Mio IU/ml, keine Vortherapie) mit exzellenten SVR-4 Ergebnissen (100 %) (Abb. 7).





