Christoph Boesecke, Bonn
Akute Hepatitis C
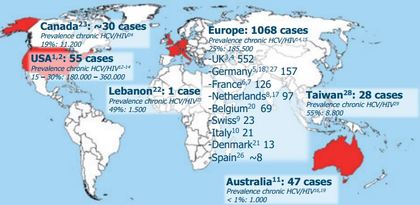
Abbildung 1: Akute Hepatitis C bei MSM weltweit
Nach wie vor wird weltweit die große Mehrheit der sexuell übertragenen akuten HCV-Infektionen bei HIV- positiven MSM berichtet (Abb. 1) 1-29. Diese Fälle von AHC scheinen mit ungeschütztem Geschlechtsverkehr und dem Konsum von Freizeitdrogen zusammenzuhängen, hierbei insbesondere sexuelle Praktiken mit hohem Risiko für Blut-Blutkontakte wie Fisten und ungeschützter Analverkehr sowie das nasale Schnupfen oder intravenöse Spritzen von sogenannten Freizeit-Drogen (z.B. Kokain, Ketamin, Crystal Meth), welche früher als seltene und unzureichende Übertragungswege angesehen wurden 30. Eine Überschneidung von Risikofaktoren könnte tatsächlich ein wichtiger Aspekt für die sexuelle Übertragung von HCV sein. In der vom RKI geführten Fall-Kontroll-Studie 30 berichteten 30 % der Patienten mit sexuell übertragener AHC-Infektion von zwei oder drei Risikofaktoren, wobei dies lediglich von 6 % der Kontrollgruppe berichtet wurde. Weiterhin scheint es, dass Übertragungen in sozialen Netzwerken unabhängig von injizierendem Drogengebrauch vorkommen. Phylogenetische Analysen identifizierten MSM-spezifisches Clustern von HCV-Stämmen 31. Bemerkenswerterweise waren virale Sequenzen von IDU oder endemischen HCV-Stämmen nicht Bestandteil auch nur eines dieser Cluster 32,33.
Zusätzlich zeigten phylogenetische Analysen der australischen Studie zur akuten Hepatitis C (ATAHC), bei der ein signifikanter Anteil der MSM den intravenösen Drogenkonsum als wahrscheinlichsten Hepatitis-C-Übertragungsweg bezeichnete, dass es auch hier MSM-spezifische Cluster gibt, unabhängig vom zugrundeliegenden Übertragungsweg 14.
Diagnose
Eine akute Hepatitis C wird definiert als die ersten sechs Monate nach einer Infektion mit HCV. Da der genaue Infektionszeitpunkt oft schwer zu ermitteln ist, ist es häufig schwierig, zwischen einer wirklich akuten Hepatitis-C-Infektion und einer frühen chronischen Infektion zu unterscheiden. Die Serokonversion von Anti-HCV-Negativität zu Anti-HCV-Positivität, die die Entwicklung von Antikörpern widerspiegelt, kann als definitive Diagnose angesehen werden. Da jedoch das Erkennen von Serokonversion aufgrund einer seltenen und nur sehr milden, unspezifischen klinischen Symptomatik in der klinischen Praxis nicht häufig vorkommt, sollte eine HCV-RNA-Testung via PCR durchgeführt werden, wenn der Verdacht auf eine AHC besteht und die Anti-HCV-Antikörper noch negativ sind. Andererseits impliziert eine Anti-HCV-Positivität nicht notwendigerweise eine langanhaltende chronische Infektion, sondern kann ebenso in der akuten Phase beobachtet werden. Zusätzlich können erhöhte Aminotransferasen ein hilfreicher Indikator für eine akute Hepatitis C sein. Im Rahmen der alle 3-6 Monate stattfindenden HIV-Routinekontrolle können diese ALT-Erhöhungen rasch und einfach erfasst werden. Bei HIV-positiven Patienten ist es zudem noch weniger wahrscheinlich, dass sie eine klinisch auffällige AHC-Infektion mit den Zeichen einer Lebererkrankung wie Abgeschlagenheit, Oberbauchschmerzen und Sklerenikterus haben 1,11. Zusätzlich kann die Anti-HCV-Serokonversion bei HIV-positiven Patienten signifikant verzögert sein; 5 % der Fälle sind nach einem Jahr immer noch Anti-HCV negativ, trotz anhaltender Virusreplikation 57. Nichtsdestotrotz scheinen mindestens einmal jährliche Anti-HCV-Antikörper- und halbjährliche ALT-Messungen, gefolgt von HCV-RNA-Testungen, bei HIV-positiven Menschen ein sinnvoller Ansatz für ein AHC-Screening zu sein 34. Diese Empfehlung basiert auf Daten der Britischen St Mary’s Akute Hepatitis C Kohorte (SMACC), wo 88 % der Patienten erhöhte ALT-Werte in den ersten 3 Monaten nach Infektion hatten, z.T. mit ALT-Höchstwerten, die mehr als 5 mal so hoch waren als der obere Referenzwert 33. In Anbetracht des Fehlens von Konsensempfehlungen sollte das Screening für klinisch asymptomatische AHC bei Risikogruppen wie HIV-negativen MSM und IDU zumindest jährliche Anti-HCV-Antikörper-Tests umfassen. HVC-RNA-Tests können nach definierten Hochrisikokontakten oder klinischem Verdacht durchgeführt werden, entsprechend den Empfehlungen nach beruflichem Kontakt (z. B. Nadelstichverletzung), wo 2-4 Wochen nach Ereignis auf HCV-RNA getestet wird 35. Sehr interessant ist, dass Kliniker weltweit eine zweite Welle von AHC-Infektionen (sogenannte Reinfektionen) bei HIV-positiven MSM beobachten, die erfolgreich behandelt worden waren oder deren erste AHC in der Vergangenheit spontan ausgeheilt war 36-39.
Natürlicher Verlauf
Die Raten spontaner Ausheilung sind niedrig, die Chronifizierungsrate bei HIV-koinfizierten Menschen liegt um die 85 % 13,54,40-43. Das wissenschaftliche Interesse, Prädiktoren der Viruseliminierung zu identifizieren, ist hoch, da dies erlauben würde, nur jene Patienten antiviral zu behandeln, die HCV nicht spontan eliminieren. Leider sind die meisten dieser Studien aufgrund kleiner Patientenzahlen nicht aussagekräftig genug, um prädiktive Faktoren sicher zu identifizieren. Mit der spontane HCV-Eliminierung assoziiert wurden bisher symptomatische Erkrankung, weibliches Geschlecht, nicht-schwarze Ethnizität, Eliminierung von HCV-RNA innerhalb von 4 Wochen nach Auftreten der klinischen Symptome, Vorkommen von neutralisierenden Antikörpern, T-Zell-Ansprechen, NK-Zellaktivitäten und das Vorkommen von distinktiven NK-Zellrezeptor- und HLA-Liganden, positives HBsAg und Herkunftsregion (sonstige europäische Regionen versus Südeuropa/Argentinien) 44-60. Zusätzlich wurden in zwei Studien bei HIV-koinfizierten Menschen hohe ALT- und CD4 T-Zellzahl als Prädiktoren für spontane Eliminierung beschrieben 61,62.
In den letzten Jahren identifizierten Genom-weite Assoziationsstudien bei HCV-Monoinfektion einzelne Nukleotid-Polymorphismen (SNP) in der Nähe des IL28B Gens, das entscheidend an der Wirt-eigenen Immunverteidigung gegen HCV beteiligt ist 61-66. Menschen mit CC-Genotyp des SNP rs12979860 hatten eine mehr als dreimal so hohe Wahrscheinlichkeit HCV-RNA zu eliminieren, verglichen mit Menschen mit C/T- oder T/T-Genotyp 40,64-67. Ähnliche Beobachtungen hinsichtlich des Einflusses von IL28B auf spontane Eliminierungsraten wurden bei HIV-koinfizierten Menschen gemacht 15,26. Interessanterweise könnten diese SNP-Unterschiede die unterschiedlichen spontanen Eliminierungsraten bei verschiedenen Ethnien erklären, da die Häufigkeit der protektiven Allele zwischen den ethnischen Gruppen variiert mit einer geringeren Häufigkeit bei Menschen aus Afrika im Vergleich zu Europäern 57.
Bislang gibt es nur widersprüchliche Daten zum Fortschreiten einer Leberfibrose nach AHC bei HIV-Koinfektion. Kohortendaten aus den USA zeigen in der Leberbiopsie moderat fortgeschrittene Fibrosen bei 82 % der Patienten (n=11) bei höherem Alter, längerer Dauer der HIV-Infektion und längerer ART-Expositionsdauer 68. Daten der europäischen AHC-Kohorte sollten Patienten und Kliniker über das Risiko einer Leberzirrhose nach AHC allerdings beruhigen, da bisher keine Hinweise auf eine beschleunigte Fibroseprogression gefunden wurden 69.
Um Epidemiologie, natürlichen Verlauf und Behandlungsergebnisse der akuten HCV-Infektion in einem aussagekräftigeren Setting vertiefend zu untersuchen (nsbesondere auch im Lichte der neuen direkt wirksamen Virostatika (DAAs) für die chronische HCV Infektion), führt die Gruppe des Europäischen AIDS Behandlungsnetzwerks (NEAT ID) ihre multizentrische prospektive Kohortenstudie fort. In dieser Kohorte werden HIV-positive und -negative Patienten mit dokumentierter akuter Hepatitis C Infektion zunächst über eine Zeitdauer von drei Jahren nach Diagnose der akuten HCV-Infektion beobachtet (PROBE-C Studie, ClinicalTrials.gov Identifier: NCT01289652).
Beginn der Behandlung
Vorläufige Daten aus dieser Kohorte zeigen, dass die Behandlungsrate in der akuten Phase insbesondere in den letzten beiden Jahren stark zurückgegangen ist. Dies reflektiert die nebenwirkungsarmen, hocheffektiven und kurzen Therapiemöglichkeiten, die sich mit den neuen DAAs in der chronischen Phase bieten. Zunehmend mehr Patienten entscheiden sich im ärztlichen Gespräch gegen eine interferonhaltige 6- bis 12-Monatstherapie und warten auf eine kurze, gut verträgliche und erfolgreiche interferonfreie DAA-basierte Therapie in der dann chronischen Phase. Dies ist nicht ganz unkritisch, denn Patienten, die nicht sofort in der frühen chronischen Phase therapiert werden, bleiben länger virämisch mit konsekutiv fortbestehendem Transmissionsrisiko. In Ermangelung von Daten zu interferonfreier DAA-Therapie bei akuter HCV-Infektion bleibt für Patienten mit Therapiewunsch vorerst nur die duale Therapie mit pegyliertem Interferon und Ribavirin.
Hierbei ist dann natürlich der Zeitpunkt, bis wann eine spontane Eliminierung zu erwarten ist, für den Therapiebeginn von hoher klinischer Wichtigkeit. Zahlreiche Kohortendaten geben Hinweise auf die Chronifizierungswahrscheinlichkeit der AHC anhand des spontanen HCV-RNA-Verlaufs nach der Diagnose. In einer europäischen Kohorte von 92 HIV-positiven Patienten mit akuter HCV waren die Sensitivität und Spezifität der HCV-RNA-Bestimmung 4 und 12 Wochen nach Diagnose ähnlich stark, um den Verlauf der akuten HCV vorherzusagen 70,71. Neun von 10 Patienten, die 4 Wochen nach Diagnose eine spontane Regression der HCV-RNA von mindestens 2 log zeigten, eliminierten HCV anschließend. 92 % der Patienten, die 12 Wochen nach Diagnose noch HCV-RNA-positiv waren, entwickelten eine chronische Hepatitis C. Ähnliches zeigte die SMACC Kohorte, in der ein rascher Abfall der HCV-RNA (> 2log innerhalb von 100 Tagen nach Infektion) bei 112 HIV-infizierten Patienten ebenfalls als Prädiktor für eine spontane Eliminierung identifiziert wurde, zusammen mit der CD4 T-Zellzahl und erhöhten Bilirubin- und ALT-Werten 62.
Im Lichte dieser vorliegenden Daten empfehlen Experten vom Europäischen AIDS-Behandlungsnetzwerk (NEAT) daher, dass allen HIV-Patienten mit Therapiewunsch eine Behandlung mit pegyliertem Interferon plus Ribavirin angeboten wird, wenn der spontan Abfall der HCV-RNA in Woche 4 weniger als 2 log beträgt bzw. wenn die HCV-RNA in Woche 12 nach Diagnose immer noch positiv ist (siehe Abbildung 1) 35.
Art der Behandlung
| Studien
Name | Coordinator | DAAs | HCV
Genotyp | Dauer (Wochen) | HIV
Status |
|---|---|---|---|---|---|
| DAAHS | Erasmus MC | BOC + pegIFN
+ RBV | 1 | 12 | pos |
| CHAT | UKB | TPV + pegIFN
+ RBV | 1 | 12 | pos |
| DARE-C I | Kirby Institute | TPV + pegIFN + RBV | 1 | 8-24 | neg + pos |
| DARE-C 2 | Kirby Institute | SOF + RBV | alle | 6 | neg + pos |
| SWIFT-C | ACTG | SOF + RBV | alle | 8 vs. 12 | pos |
| SOL | UKB | SOF + RBV | 1,4 | 6 | pos |
| Hep-Net
Acute HCV | MHH | SOF + RBV | 1 | 6 | pos |
Tabelle 1:.Aus: Boesecke C, Rockstroh JK. How will we manage acute HCV in men
having sex with men in the era of all oral therapy? J Viral Hepat. 2014 Oct 21
Zur Behandlung der AHC mit DAAs gibt es nur wenig Daten. In einer Kohorte, in der eine Telaprevir-basierte Tripletherapie bei akuter HCV-Genotyp-1-Koinfektion erfolgreich eingesetzt wurde, fehlte leider ein Kontrollarm, um den Zugewinn in der Ansprechrate durch Zugabe des dritten Medikaments im Vergleich zum Goldstandard der dualen Therapie beurteilen zu können 73. Jüngst vorgestellte Daten zum Einsatz einer Boceprevir-haltigen Tripletherapie (allerdings auch wieder ohne Kontrollarm) bei akuter HCV-Koinfektion ergab eine SVR-Rate von lediglich 76,5 % 26/34 nach 12-wöchiger Therapie 74. Damit ist der zusätzliche Gewinn an Ausheilung kleiner als 10 %, wenn man Ansprechraten von ca. 70 % für die duale Therapie veranschlagt. Daten zur interferonfreien DAA-basierten HCV-Therapie in der akuten Phase fehlen gänzlich, wenn auch einige kleinere Studien geplant sind bzw. mit der Rekrutierung begonnen haben (Tab. 1).
Für Patienten mit Therapiewunsch bleibt vorerst die duale Therapie mit pegyliertem Interferon und Ribavirin der Goldstandard entsprechend der jüngsten Version der EACS Guidelines Version 7.1 vom November 2014 (Abb. 2). Bei frühzeitiger dualer Therapie zeigten sich bei der AHC-Koinfektion in klinischen Studien und Kohorten SVR-Raten von 60 % bis 80 % unabhängig vom HCV-Genotyp 2,27,28,61,72. Behandelt wird mit Standarddosen von pegylierten Interferonen (alpha-2b 1,5 µg/kg/Woche oder alpha-2a 180 µg/Woche) und gewichtsadaptiertem Ribavirin (1000 mg/d bei KG≤ 75kg bzw. 1200 mg/d bei KG> 75 kg).
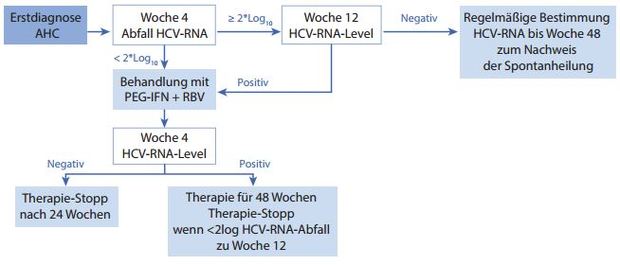
Abbildung 2:Aus: EACS Guidelines, Version 7.1, November 2014
Ribavirin scheint notwendig zu sein, um hohe Ansprechraten bei HIV-koinfizierten Patienten zu erreichen – in Anbetracht von Fallberichten aus Deutschland über unzureichende Monotherapie mit pegyliertem Interferon 72 und einer Pilotstudie zur Monotherapie mit pegyliertem Interferon aus den Niederlanden 15.
Der Einfluss von IL28B auf das Behandlungsergebnis scheint den Daten einer deutschen Kohorte zufolge bei akuter HCV-Koinfektion (anders als bei chronischer HCV-Koinfektion) nicht signifikant zu sein 16, was mit bekannten Daten zum Effekt von IL28b in der Behandlung von ACH bei HIV-negativen Menschen übereinstimmt 40.
Dauer der Behandlung
Analog zum Nutzen der viralen Kinetik in der Vorhersage von spontaner viraler Eliminierung kommen von der European Collaborative Cohort Study Hinweise, dass die virale Kinetik unter Therapie die Wahrscheinlichkeit einer SVR (6 Monate nach Ende der Therapie keine HCV-RNA nachweisbar) und potenziell auch die optimale Therapiedauer einer dualen Therapie bei AHC-Koinfektion bestimmt 75. In dieser Kohorte hatten Patienten mit einer Viruslast von weniger als 600 IU/ml in Woche 4 (RVR = in Woche 4 der Behandlung keine HCV-RNA nachweisbar) eine sehr viel höhere Wahrscheinlichkeit für eine SVR. Im Gegensatz dazu waren Patienten mit einer Virenlast von mehr als 600 IU/ml in Woche 12 deutlich häufiger Therapieversager. Eine Subanalyse zeigt, dass Patienten mit RVR und einer Behandlungsdauer von mindestens 24 Wochen oder länger eine 96 %ige Heilungswahrscheinlichkeit, bei kürzerer Behandlungsdauer jedoch nur von 20 % hatten 75. In einer weiteren Einzelstudie erschien die Therapie für akute HCV bei HIV-infizierten Patienten über 48 Wochen wirksamer als über 24 Wochen 76, während andere Berichte SVR-Raten von größer als 70 % ohne statistisch signifikante Differenz bei unterschiedlicher Therapiedauer angaben 72,77. Jüngste Daten aus Großbritannien stützen die RVR-bedingte Behandlungsdauer, so wie sie vom NEAT Expertengremium empfohlen wird 35,78.
Zusammengefasst sollte bei Therapiewunsch in der akuten Phase zum momentanen Zeitpunkt bei allen HIV-positiven Patienten mit akuter HCV-Koinfektion weiterhin pegyliertes Interferon und Ribavirin gewichtsabhängig eingesetzt werden. Für Patienten mit negativer HCV-RNA in Woche 8 oder 12 und deutlicher Ribavirin-assoziierter Toxizität kann der Stopp von Ribavirin nach Woche 12 eine Option sein. Der Viruslastabfall kann bei HIV-positiven Patienten im Vergleich mit HIV-negativen Patienten verlangsamt sein. Das NEAT-Expertengremium für akute HCV empfiehlt daher, dass 24 Wochen Therapie ausreichen, wenn die RVR erreicht wird. Bei bei Patienten, die RVR nicht erreichen, kann eine Therapiedauer von 48 Wochen erwogen werden (Abb. 1) 35.
Zusammenfassung
Die Übertragung von Hepatitis C findet hauptsächlich bei intravenösen Drogenkonsumenten statt und bei HIV-positiven Männern, die Sex mit Männern haben, unter denen eine akute Hepatitis C-Epidemie in der letzten Dekade zu beobachten war. Es wird geschätzt, dass die Quote von spontaner Ausheilung bei HIV-positiven Menschen um die 15 % beträgt. Keiner der aktuell für die Behandlung der chronischen HCV-Infektion zugelassenen DAAs ist momentan für die Behandlung der akuten Hepatitis C zugelassen. Daten von randomisierten klinischen Studien zur interferonfreien, DAA-basierten Therapie fehlen. Damit ist das derzeitige Standardregime weiterhin pegyliertes Interferon in Kombination mit gewichtsabhängig dosiertem Ribavirin. AHCPatienten, die 4 Wochen nach Diagnose keinen signifikanten Abfall der HCV-RNA zeigen oder bei denen nach 12 Wochen immer noch HCV-RNA nachweisbar ist, sollten bei Therapiewunsch eine duale Therapie starten. Die Dauer der Behandlung sollte anhand des initialen virologischen Ansprechens auf die antivirale Therapie angepasst werden. Allerdings zeigt der klinische Alltag, dass sich zunehmend mehr Patienten im ärztlichen Gespräch gegen eine interferonhaltige 6- bis 12-Monatstherapie entscheiden und auf eine kurze, gut verträgliche und erfolgreiche interferonfreie DAA-basierte Therapie in der dann chronischen Phase setzen. Dies unterstreicht die dringende Notwendigkeit für Studien zum Einsatz der DAAs bei akuter HCV Infektion.
1. 1 Vogel M, Deterding K, Wiegand J, et al. Initial presentation of acute hepatitis C virus (HCV) infection among HIV-negative and HIV-positive individuals: experience from 2 large German networks on the study of acute HCV infection. Clin Infect Dis 2009; 49:317–319; author reply 9.
2. Luetkemeyer A, Hare CB, Stansell J, et al. Clinical presentation and course of acute hepatitis C infection in HIV-infected patients. J Acquir Immune Defic Syndr 2006; 41:31–36.
3. Cox AL, Page K, Bruneau J, et al. Rare birds in North America: acute hepatitis C cohorts. Gastroenterology. 2009 Jan;136(1):26-31.
4. Giraudon I, Ruf M, Maguire H, et al. Increase in diagnosed newly acquired hepatitis C in HIV-positive men who have sex with men across London and Brighton, 2002–2006: is this an outbreak? Sex Transm Infect 2008; 84:111–115.
5. Ruf M, Cohuet S, Maguire H, et al, SNAHC Steering Group. Setting up an enhanced surveillance of newly acquired hepatitis C infection in men who have sex with men: a pilot in London and South East region of England. Euro Surveill 2008;13 (47).
6. Gambotti L, Batisse D, Colin-de-Verdiere N, et al. Acute hepatitis C infection in HIV positive men who have sex with men in Paris, France, 2001–2004. Euro Surveill 2005; 10:115–117.
7. Morin T, Pariente A, Lahmek P, et al. Favorable outcome of acute occupational hepatitis C in healthcare workers: a multicenter French study on 23 cases. Eur J Gastroenterol Hepatol. 2011 Jun;23(6):515-20.
8. Urbanus AT, van de Laar TJ, Stolte IG, et al. Hepatitis C virus infections among HIV-infected men who have sex with men: an expanding epidemic. AIDS 2009; 23:F1–F7.
9. Rauch A, Rickenbach M, Weber R, et al. Unsafe sex and increased incidence of hepatitis C virus infection among HIV-infected men who have sex with men: the Swiss HIV Cohort Study. Clin Infect Dis 2005; 41:395–402.
10. Gallotta G, Gali L, De Bona A, et al. Acute hepatitis C virus in HIV co-infected men who have sex with men: Milan, 1996–2007. In: 4th International HIV and Hepatitis Co-infection; Madrid, Spain; 2008; abstract 47.
11. Matthews G, Hellard M, Haber P, et al. Characteristics and treatment outcomes among HIV-infected individuals in the Australian trial in acute hepatitis C. Clin Infect Dis 2009; 48:650–658.
12. Sherman KE, Rouster SD, Horn PS. Comparison of methodologies for quantification of hepatitis C virus (HCV) RNA in patients coinfected with HCV and human immunodeficiency virus. Clin Infect Dis. 2002 Aug 15;35(4):482-7.
13. Soriano V, Mocroft A, Rockstroh J, et al. Spontaneous viral clearance, viral load, and genotype distribution of hepatitis C virus (HCV) in HIV-infected patients with anti-HCV antibodies in Europe. J Infect Dis 2008,198:1337-1344.
14. Matthews GV, Pham ST, Hellard M, et al. Patterns and characteristics of hepatitis C transmission clusters among HIV-positive and HIV-negative individuals in the Australian trial in acute hepatitis C. Clin Infect Dis. 2011 Mar;52(6):803-11.
15. Arends JE, Lambers FA, van der Meer JT, et al. Treatment of acute hepatitis C virus infection in HIV+ patients: Dutch recommendations for management. Neth J Med. 2011 Jan;69(1):43-9.
16. Neukam K, Nattermann J, Rallón N, et al. Different distributions of hepatitis C virus genotypes among HIV-infected patients with acute and chronic hepatitis C according to interleukin-28B genotype. HIV Med. 2011 Sep;12(8):487-93.
17. Bottieau E, Apers L, Van Esbroeck M, et al. Hepatitis C virus infection in HIV-infected men who have sex with men: sustained rising incidence in Antwerp, Belgium, 2001-2009. Euro Surveill. 2010 Sep 30;15(39):19673.
18. Barfod TS, Omland LH, Katzenstein TL. Incidence and characteristics of sexually transmitted acute hepatitis C virus infection among HIV-positive men who have sex with men in Copenhagen, Denmark during four years (2006-2009): a retrospective cohort study. Scand J Infect Dis. 2011 Feb;43(2):145-8.
19. Dionne-Odom J, Osborn MK, Radziewicz H, et al. Acute hepatitis C and HIV coinfection. Lancet Infect Dis. 2009 Dec;9(12):775-83.
20. Remis R. A Study to Characterize the Epidemiology of Hepatitis C Infection in Canada, 2002. Final Report. Public Health Agency of Canada. http://www.phac-aspc.gc.ca/hepc/pubs/ hepc2002/index-eng.php. Accessed May 20th 2012.
21. Lebanese Republic, Ministry of Public Health. UNGASS Country Progress Report Lebanon March 2010. http://www.unaids. org/en/dataanalysis/monitoringcountryprogress/2010progressreportssubmittedbycountries/lebanon_2010_country_ progress_report_en.pdf. Accessed May 20th 2012.
22. Boesecke C, Stellbrink HJ, Mauss S, et al. Does Baseline HCV Genotype Have an Impact upon Treatment Outcome of Acute HCV Infection in HIV Co-Infected Individuals? 18th Conference on Retroviruses and Opportunistic Infections, Boston, U.S.A. 2011, Abstract #Q-138.
23. Sun HY, Chang SY, Yang TY, et al. Recent Hepatitis C Virus Infection in HIV-Positive Patients in Taiwan: Incidence and Risk Factors. J Clin Microbiol. 2012 Mar;50(3):781-7.
24. Lee HC, Ko NY, Lee NY, et al. Seroprevalence of viral hepatitis and sexually transmitted disease among adults with recently diagnosed HIV infection in Southern Taiwan, 2000-2005: upsurge in hepatitis C virus infections among injection drug users. J Formos Med Assoc. 2008 May;107(5):404-11.
25. Larsen C, Alric L, Auperin I, et al. Acute hepatitis C in HIV-infected men who have sex with men in France in 2006 and 2007. In: 58th Annual Meeting of the American Association for the Study of the Liver, Boston, USA; 2007; abstract 894.
26. Clausen LN, Weis N, Astvad K, et al. Interleukin-28B polymorphisms are associated with hepatitis C virus clearance and viral load in a HIV-1-infected cohort. J Viral Hepat. 2010 Nov 12.
27. van der Helm JJ, Prins M, Del Amo J, et al. The hepatitis C epidemic among HIV-positive MSM: incidence estimates from 1990 to 2007. AIDS. 2011 May 15;25(8):1083-1091.
28. Fierer D, Fishman S, Uriel A, et al. Characterization of an outbreak of acute HCV infection in HIV-infected men in New York city. In: 16th Conference on Retroviruses and Opportunistic Infections; Montreal, Canada; 2009; abstract 802.
29. Hung CC, Chen MY, Hsieh SM, et al. Impact of chronic hepatitis C infection on outcomes of patients with an advanced stage of HIV-1 infection in an area of low prevalence of co-infection. Int J STD AIDS. 2005 Jan;16(1):42-8.
30. Schmidt AJ, Rockstroh JK, Vogel M, et al. Trouble with bleeding: risk factors for acute hepatitis C among HIV-positive gay men from Germany--a case-control study. PLoS One. 2011 Mar 8;6(3):e17781.
31. Caro Perez N, Martinez-Rebollar M, Gregori J, et al. PHYLOGENETIC ANALYSIS OF AN EPIDEMIC OUTBREAK OF ACUTE HEPATITIS C IN HIV-INFECTED PATIENTS BY MASSIVE SEQUENCING. 50th International Liver Congress (ILC), European Association for the Study of the Liver (EASL), Vienna, Austria, 22-26 April 2015; abstract P1287.
32. van de Laar T, Pybus O, Bruisten S, et al. Evidence of a large, international network of HCV transmission in HIV-positive men who have sex with men. Gastroenterology 2009; 136:1609–1617.
33. Vogel M, van de Laar T, Kupfer B, et al. Phylogenetic analysis of acute hepatitis C virus genotype 4 infections among human immunodeficiency virus-positive men who have sex with men in Germany. Liver Int. 2010 Sep;30(8):1169-72.
34. Thomson EC, Nastouli E, Main J, et al. Delayed anti-HCV antibody response in HIV-positive men acutely infected with HCV. AIDS 2009; 23:89–93.
35. The European AIDS Treatment Network (NEAT) Acute Hepatitis C Infection Consensus Panel. Acute hepatitis C in HIV-infected individuals: recommendations from the European AIDS Treatment Network (NEAT) consensus conference. AIDS. 2011 Feb 20;25(4):399-409.
36. Kubitschke A, Bahr MJ, Aslan N, Bader C, Tillmann HL, Sarrazin C, Greten T, Wiegand J, Manns MP, Wedemeyer H. Induction of hepatitis C virus (HCV)-specific T cells by needle stick injury in the absence of HCV-viraemia. Eur J Clin Invest. 2007 Jan;37(1):54-64.
37. Stellbrink HJ, Schewe CK, Vogel M, et al. Increasing numbers of acute hepatitis C infections in HIV-infected MSM and high reinfection rates following SVR. J Int AIDS Soc. 2010; 13(Suppl 4): P200.
38. Lambers F, Prins M, Thomas X, et al. High incidence rate of HCV reinfection after treatment of acute HCV infection in HIV-infected MSM in Amsterdam. AIDS. 2011 Nov 13;25(17):F21-7.
39. Ingiliz P, Krznaric I, Stellbrink HJ, et al. Multiple hepatitis C virus (HCV) reinfections in HIV-positive men who have sex with men: no influence of HCV genotype switch or interleukin-28B genotype on spontaneous clearance. HIV Med. 2014 Jul;15(6):355-61.
40. Grebely J, Petoumenos K, Hellard M, et al; ATAHC Study Group. Potential role for interleukin-28B genotype in treatment decision-making in recent hepatitis C virus infection. Hepatology. 2010 Oct;52(4):1216-24.
41. Jones L, Uriel A, Kaplan D, et al. Natural history and treatment outcome of acute hepatitis C with and without HIV co-infection in a North American cohort. In: AASLD 2008 Meeting; San Francisco, USA; 2008; abstract 1838.
42. Thomson E, Fleming VM, Main J, et al. Predicting spontaneous clearance of acute hepatitis C virus in a large cohort of HIV-1-infected men. Gut. 2011 Jun;60(6):837-45.
43. Thomas DL, Astemborski J, Rai RM, et al. The natural history of hepatitis C virus infection: host, viral, and environmental factors. JAMA 2000,284:450-456.
44. Grebely, J., Matthews, G. V., Petoumenos, K. & Dore, G. J. Spontaneous clearance and the beneficial impact of treatment on clearance during recent hepatitis C virus infection. J. Viral. Hepat. 2009, 17, 896.
45. Dietz J, Lutz T, Knecht G, et al. VIRAL AND HOST PARAMETERS IN ASSOCIATION WITH OUTCOME OF ACUTE HEPATITIS C IN HIV-COINFECTED PATIENTS. 50th International Liver Congress (ILC), European Association for the Study of the Liver (EASL), Vienna, Austria, 22-26 April 2015; abstract P0721.
46. McGovern, B. H. et al. Acute hepatitis C virus infection in incarcerated injection drug users. Clin. Infect. Dis. 2006, 42, 1663–1670.
47. Wang, C. C. et al. Acute hepatitis C in a contemporary US cohort: modes of acquisition and factors influencing viral clearance. J. Infect. Dis. 2007, 196, 1474–1482.
48. Diepolder, H. M. New insights into the immunopathogenesis of chronic hepatitis C. Antiviral Res. 2009, 82, 103–109.
49. Post, J., Ratnarajah, S. & Lloyd, A. R. Immunological determinants of the outcomes from primary hepatitis C infection. Cell. Mol. Life Sci. 2009, 66, 733–756.
50. Rehermann, B. Hepatitis C virus versus innate and adaptive immune responses: a tale of coevolution and coexistence. J. Clin. Invest. 2009, 119, 1745–1754.
51. Bowen, D. G. & Walker, C. M. Adaptive immune responses in acute and chronic hepatitis C virus infection. Nature 2005 436, 946–952.
52. Takaki, A. et al. Cellular immune responses persist and humoral responses decrease two decades after recovery from a single-source outbreak of hepatitis C. Nat. Med. 2000, 6, 578–582.
53. Ray, S. C. et al. Acute hepatitis C virus structural gene sequences as predictors of persistent viremia: hypervariable region 1 as a decoy. J. Virol. 1999, 73, 2938–2946.
54. Farci, P. et al. The outcome of acute hepatitis C predicted by the evolution of the viral quasispecies. Science 2000, 288, 339–344.
55. Harfouch S, Guiguet M, Valantin MA, et al. Lack of TGF-β production by hepatitis C virus-specific T cells during HCV acute phase is associated with HCV clearance in HIV coinfection. J Hepatol. 2012 Feb 9.
56. Schlaphoff V, Lunemann S, Suneetha PV, et al. Dual function of the NK cell receptor 2B4 (CD244) in the regulation of HCV-specific CD8+ T cells. PLoS Pathog. 2011 May;7(5):e1002045.
57. Schulze Zur Wiesch J, Ciuffreda D, Lewis-Ximenez L, et al. Broadly directed virus-specific CD4+ T cell responses are primed during acute hepatitis C infection, but rapidly disappear from human blood with viral persistence. J Exp Med. 2012 Jan 16;209(1):61-75.
58. Khakoo SI, Thio CL, Martin MP, Brooks CR, Gao X, Astemborski J, Cheng J, Goedert JJ, Vlahov D, Hilgartner M, Cox S, Little AM, Alexander GJ, Cramp ME, O‘Brien SJ, Rosenberg WM, Thomas DL, Carrington M. HLA and NK cell inhibitory receptor genes in resolving hepatitis C virus infection. Science. 2004 Aug 6;305(5685):872-4.
59. Stegmann KA, Björkström NK, Ciesek S, Lunemann S, Jaroszewicz J, Wiegand J, Malinski P, Dustin LB, Rice CM, Manns MP, Pietschmann T, Cornberg M, Ljunggren HG, Wedemeyer H. Interferon α-stimulated natural killer cells from patients with acute hepatitis C virus (HCV) infection recognize HCV-infected and uninfected hepatoma cells via DNAX accessory molecule-1. J Infect Dis. 2012 May 1;205(9):1351-62.
60. Kokordelis P, Krämer B, Boesecke C et al. CD3(+)CD56(+) NK-LIKE T CELLS SHOW REDUCED ANTI-VIRAL ACTIVITY IN ACUTELY HCV/HIV INFECTED PATIENTS. 50th International Liver Congress (ILC), European Association for the Study of the Liver (EASL), Vienna, Austria, 22-26 April 2015; abstract P0484.
61. Gilleece YC, Browne RE, Asboe D, et al. Transmission of hepatitis C virus among HIV-positive homosexual men and response to a 24-week course of pegylated interferon and ribavirin. J Acquir Immune Defic Syndr 2005; 40:41–46.
62. Thomson EC, Fleming VM, Main J, et al. Predicting spontaneous clearance of acute hepatitis C virus in a large cohort of HIV-1-infected men. Gut. 2011 Jun;60(6):837-45.
63. Harris, H. E. et al. Does the clinical outcome of hepatitis C infection vary with the infecting hepatitis C virus type? J. Viral. Hepat. 14, 213–220 (2007).
64. Thomas DL, Thio CL, Martin MP, et al. Genetic variation in IL28B and spontaneous clearance of hepatitis C virus. Nature 2009,461:798-801.
65. Rauch A, Kutalik Z, Descombes P, et al. Genetic variation in IL28B is associated with chronic hepatitis C and treatment failure: a genome-wide association study. Gastroenterology 2010,138:1338-1345,e1331-1337.
66. Ge D, Fellay J, Thompson AJ, et al. Genetic variation in IL28B predicts hepatitis C treatment-induced viral clearance. Nature 2009,461:399-401.
67. Beinhardt S, Aberle JH, Strasser M, Dulic-Lakovic E, Maieron A, Kreil A, Rutter K, Staettermayer AF, Datz C, Scherzer TM, Strassl R, Bischof M, Stauber R, Bodlaj G, Laferl H, Holzmann H, Steindl-Munda P, Ferenci P, Hofer H. Serum level of IP-10 increases predictive value of IL28B polymorphisms for spontaneous clearance of acute HCV infection. Gastroenterology. 2012 Jan;142(1):78-85.e2.
68. Fierer DS, Uriel AJ, Carriero DC, et al. Liver fibrosis during an outbreak of acute hepatitis C virus infection in HIV-infected men: a prospective cohort study. J Infect Dis. 2008 Sep 1;198(5):683-6.
69. Boesecke C, Ingiliz P, Mandorfer M, et al. Is there Long-term Evidence of Advanced Liver Fibrosis after Acute Hepatitis C in HIV Coinfection? Conference on Retroviruses and Opportunistic Infections; Boston, MAa, USA; 2014; abstract 396.
70. Vogel M, Boesecke C, Rockstroh JK. Acute hepatitis C infection in HIV-positive patients. Curr Opin Infect Dis. 2011 Feb;24(1):1-6.
71. Vogel M, Page E, Matthews G, et al. Use of week 4 HCV RNA after acute HCV infection to predict chronic HCV infection. In: 17th Conference on Retroviruses and Opportunistic Infections; San Francisco, California, USA; 2010; abstract 640.
72. Vogel M, Nattermann J, Baumgarten A, et al. Pegylated interferon-alpha for the treatment of sexually transmitted acute hepatitis C in HIV-infected individuals. Antivir Ther 2006; 11:1097–1101.
73. Fierer DS. Dieterich DT, Mullen MP, et al. Telaprevir in the treatment of acute hepatitis C virus infection in HIV-infected men. Clin Infect Dis. 2014 Mar;58(6):873-9.
74. Hullegie SJ, Claassen MA, van den Berk GE, et al. SVR12 Results After 12w Boceprevir + P/R in the Dutch Acute Hepatitis C in HIV Study. Conference on Retroviruses and Opportunistic Infections (CROI), Seattle, WA, USA, February 23-26, 2015: abstract 669.
75. Vogel M, Dominguez S, Bhagani S, et al. Treatment of acute HCV infection in HIV-positive patients: experience from a multicentre European cohort. Antivir Ther 2010; 15:267–279.
76. Lambers F, Brinkman K, Schinkel J, et al. Treatment of acute hepatitis C virus infection in HIV-infected MSM: the effect of treatment duration. AIDS. 2011 Apr 21.
77. Matthews GV, Dore GJ. Optimal duration of treatment for acute hepatitis C in human immunodeficiency virus-positive individuals? Hepatology. 2011 Mar;53(3):1055-6; author reply 1056-7. doi: 10.1002/hep.24152.
78. Boesecke C, Rockstroh JK. Treatment of acute hepatitis C infection in HIV-infected patients. Curr Opin HIV AIDS. 2011 Apr 23.





