Johanna Knapstein Und Tim Zimmermann, Mainz
HCV-Therapie im Lebertransplantations-Setting
Mit der Zulassung der direkt antiviral wirksamen Medikamente (direct acting antivirals, DAAs) und Interferon-freier Regime hat sich die Therapie von Hepatitis C (HCV) infizierten Patienten mit Leberzirrhose (LCI) auf der Warteliste und nach Lebertransplantation (LTx) grundlegend verändert.
Gemäß der aktuellen EASL-Clinical Practice Guidelines wird prinzipiell eine antivirale Behandlung der HCV-Patienten auf der Warteliste zur Prävention einer Reinfektion und für alle reinfizierten Patienten nach LTx empfohlen.
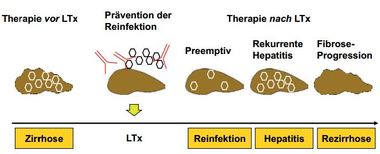
Abbildung 1:Strategien und Zeitpunkte für den Beginn einer antiviralen Therapie.
Dennoch
bleibt die antivirale Therapie bei LCI auf der Warteliste zur LTx und
lebertransplantierten Patienten mit rekurrenter HCV-Infektion
aufgrund der hohen Morbidität und Co-Medikation bei aktuell noch
eingeschränkter Datenlage schwierig.
Der folgende Beitrag soll eine Übersicht über die wesentlichen, aktuell auf dem International Liver Congress (ILC) der European Association for the Study of the Liver (EASL) 2015 in Wien präsentierten, Daten im Kontext der Lebertransplantation geben. Mögliche Zeitpunkte für den Beginn einer antiviralen Therapie sind in Abbildung 1 dargestellt.
Therapie von HCV-Patienten auf der Warteliste
Die Behandlung sollte so früh wie möglich begonnen werden, um einen SVR vor der LTx zu erreichen. Dabei ist jedoch der optimale Zeitpunkt noch ungeklärt und muss individuell entschieden werden, da der zeitliche Rahmen der LTx oft nicht abgeschätzt werden kann.
Während Patienten mit LCI im Stadium Child A und hepatozellulärem Karzinom behandelt werden sollen, muss die Entscheidung bei Patienten mit dekompensierter LCI auf der Warteliste individuell getroffen werden.
Durch die Therapie kommt es in ca. zwei Drittel der Fälle zu einer Verbesserung des MELD-Scores (SOLAR-2). Dies könnte in einer Subgruppe von Patienten, z.B. mit Encephalopathie, Aszites, etc., dazu führen, dass eine dringend notwendige LTx verzögert wird.
Eine besondere Herausforderung ist es dabei, Kriterien für Patienten zu identifizieren, die längerfristig von einer Therapie nicht profitieren und einen „point of no return“ zu definieren. Eine wichtige Rolle könnten hierbei das Patientenalter und der Serum-Albuminwert spielen (Early Access Programme United Kingdom, EAP UK).
a.
mit kompensierter Leberzirrhose
+/-
HCC
Das französische Early Access Programm (EAP) HEPATHER ermöglichte eine Therapie von 409 HCV-Genotyp 1 infizierten Patienten, in 78 % mit LCI (davon 9 % dekompensiert) und in 75 % vorbehandelt, mit SOF in Kombination mit dem pangenotypischen NS5A-Inhibitor Daclatasvir (DCV, 60 mg 1x/Tag) +/- Ribavirin (RBV) über 12 bzw. 24 Wochen. Hierbei wurden SVR4-Raten von 85-100 % erreicht. Bei einer 24-wöchigen Therapie mit SOF/DCV wurde eine höhere SVR4-Rate erzielt als bei einer kürzeren Behandlungsdauer von 12 Wochen. Bei Kombination mit RBV waren die Ergebnisse für 12 und 24 Wochen vergleichbar.
Die OPTIMIST-2 Studie, eine offene Phase 3 Studie, verglich 103 therapienaive und vorbehandelte Patienten mit einer HCV-Genotyp 1 assoziierten LCI, die über 12 Wochen mit einer Kombination aus dem NS5B-Polymerase-Inhibitor Sofosbuvir (SOF, 400 mg 1x/Tag) und dem NS3/4A-Protease-Inhibitor Simeprevir (SMV, 150 mg 1x/Tag) behandelt wurden, mit einem historischen Kontrollkollektiv. Dabei war die Therapie mit SOF/SMV mit einer SVR12-Rate von 84 % dem Kontrollkollektiv (SVR12 70 %) überlegen. Die häufigsten Nebenwirkungen waren Fatigue (20 %), Kopfschmerzen (20 %) und Übelkeit (11 %).
In der amerikanisch-europäischen, multizentrischen, randomisierten, offenen Phase 3 Studie TURQUOISE-II wurden 380 therapienaive oder vorbehandlete HCV-Genotyp 1 infizierte Patienten mit kompensierter LCI (Child Pugh <7) über 12 oder 24 Wochen mit der Kombination von Ombitasvir/Paritaprevir/Ritonavir (OBV/PTV/r, 25/150/100 mg 1x/Tag) + Dasabuvir (D, 250 mg 2x/Tag) + RBV (gewichtsadaptiert 1000 oder 12000 mg/Tag) behandelt. Es resultierten SVR12-Raten von 86 -100 %. Dabei waren die Ergebnisse für eine Therapiedauer von 12 und 24 Wochen vergleichbar bei guter Verträglichkeit. In der Nachbeobachtungsphase bis zu 48 Wochen nach Erreichen einer SVR12, kam es sogar zu einer Verbesserung der Leberfunktion und des Elastogramms.
Die
aktuell laufende randomisierte offene AGATE-I Studie soll
Effektivität und
Sicherheit der antiviralen Therapie mit
OBV/PTV/r + RBV bei 180 therapienaiven und vorbehandelten Patienten
mit HCV-Genotyp 4 Infektion und kompensierter LCI untersuchen.
Einen Überblick über die antivirale Therapie bei kompensierter Zirrhose gibt Tabelle 1.
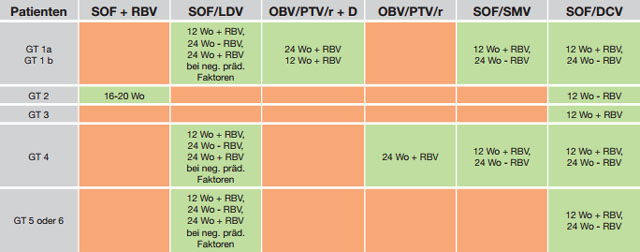
Tabelle 1:Interferonfreie HCV-Therapie bei kompensierter Zirrhose (modifiziert nach den „EASL Recommendations on Treatment of Hepatitis C 2015“)
GT: HCV-Genotyp, Wo: Wochen, neg. präd. Faktoren: negative prädiktive Faktoren für ein Therapieansprechen, SOF: Sofosbuvir (400 mg 1x/Tag), RBV: Ribavirin,
SMV: Simeprevir (150 mg 1x/Tag), LDV: Ledipasvir (90 mg, 1x/Tag), DCV: Daclatasvir (60 mg, 1x/Tag), OBV/PTV/r: Ombitasvir/Paritaprevir/Ritonavir
(25/150/100 mg 1x/Tag), D: Dasabuvir (250 mg 2x/Tag)
Für die Richtigkeit und Vollständigkeit der Angaben übernehmen die Autoren keine Haftung
b. mit dekompensierter Leberzirrhose
Im Rahmen des englischen Early Access Programms (EAP) wurde vom National Health System (NHS) eine 12-wöchige Therapie mit SOF und RBV für 442 Patienten mit dekompensierter Genotyp 1 oder 3 HCV-LCI (Child Pugh > = 7) zur Verfügung gestellt. Zusätzlich konnte der Behandler die von Gilead bzw. BMS bereitgestellten DAAs Ledipasvir (LDV) und DCV frei kombinieren. Insgesamt wurden hierbei SVR12-Raten von über 70 % erzielt. Mehr als 40 % der Patienten zeigten eine Verbesserung der Leberfunktion, wobei Patienten unter 65 Jahren mit einem Serum-Albumin > 35 g/l besser ansprachen und weniger Nebenwirkungen hatten.
In der prospektiven randomisierten multizentrischen SOLAR-2 Studie wurden SVR12-Raten von 72-96 % bei der Therapie von 107 HCV-Patienten der Genotypen 1 und 4 mit dekompensierter Leberzirrhose (Child-Pugh Stadium B und C) mit einer Kombination des NS5A-Inhibitors Ledipasvir (LDV, 90 mg 1x/Tag) mit SOF und RBV (Start mit 600 mg/Tag, im Verlauf Dosissteigerung) über 12 bzw. 24 Wochen vor LTx erzielt. Dabei kam es zu einer Verbesserung des MELD-Scores und des Child-Pugh Stadiums. Nebenwirkungen waren selten und meist RBV oder LCI assoziiert.
Die multizentrische, offene Phase 3 Studie ALLY-1 zeigte für 60 therapienaive oder vorbehandelte Patienten mit fortgeschrittener Genotyp 1-6 HCV-LCI (Child-Pugh A-C, MELD> 8), die über 12 Wochen mit SOF/DCV + RBV (initial 600 mg/Tag, im Verlauf Dosissteigerung auf 1000 mg/Tag in Abhängigkeit vom Hb-Wert und der Kreatinin-Clearance) behandelt wurden, SVR12-Raten von 56-100 %. Dabei erzielten Patienten mit HCV-Genotyp 1a Infektion (SVR12 76 %) oder Child C-Zirrhose die geringsten (SVR12 56 %), Patienten mit HCV-Genotyp 1b und 4 Infektion die höchsten SVR12-Raten (SVR12 100 %).
Perioperative HCV-Therapie
In mehreren Studien wurden einige Patienten, bei denen eine antivirale Therapie mit DAAs auf der Warteliste begonnen wurde, während des Therapiezeitraums transplantiert. Zumeist konnte die Therapie perioperativ fortgeführt und erfolgreich beendet werden. So wurden z.B. in der multizentrischen, offenen Phase 3 Studie, ALLY-1, 4 Patienten unter Therapie mit SOF/DCV und RBV transplantiert. Bei allen Patienten wurde die antivirale Therapie unmittelbar post-LTx für 12 Wochen unabhängig von der Therapiedauer vor LTx fortgeführt. Alle 4 Patienten haben eine SVR12 erreicht.
In einer randomisierten, prospektiven, kontrollierten, multizentrischen US-amerikanischen Phase III Studie wurden Effizienz und Sicherheit einer perioperativen anti-HCV Immunglobulin-Gabe (Civacir®) in 63 Patienten mit einer Genotyp 1, 2 oder 3 HCV-Infektion, die weniger als 24 Wochen vor LTx antiviral behandelt wurden und 4 Wochen präoperativ eine HCV-RNA von <100 IU/ml hatten. Dabei erhielten die Patienten 16 Infusionen (200 oder 300 mg/kg) Civacir® über 10 Wochen. Sowohl in der Kontroll-Gruppe als auch bei den Patienten, die 200 mg/kg Civacir® erhielten kam es in 30 % der Fälle zu einer HCV-Rekurrenz nach LTx. Patienten mit 300 mg/kg wiesen nur in 5 % eine rekurrente HCV-Infektion nach LTx auf, hatten jedoch in 50 % Nebenwirkungen (Fieber, Schulterschmerzen und Übelkeit).
Eine aktuell laufende prospektive italienische Studie untersucht die Sicherheit einer DAA-Therapie mit Beginn am Tag der LTx mit dem Ziel der Prävention einer Transplantatreinfektion.
HCV-Therapie Post-LTx
Zur Therapie der rekurrenten HCV-Infektion post-LTx werden gemäss der aktuellen EASL-Clinical Practice Guidelines verschiedene IFN-freie Regime in Abhängigkeit vom Genotyp empfohlen. Generell sollten alle HCV-positive Patienten nach LTx behandelt werden. Eine Therapie kann jederzeit durchgeführt werden. Der optimale Therapiezeitpunkt ist bis dato nicht näher definiert. Meist wird nach postoperativer Stabilisierung frühestens 3 Monate nach LTx begonnen. Eine frühere Therapie ist möglich und bei Zeichen einer fibrosierend cholestatischen Hepatitis C empfohlen.
In
den meisten Studien wurde eine antivirale Behandlung erst mehr als 2
Jahre post-LTx bei stabilen Patienten begonnen. Eine besondere
Herausforderung stellen nach Transplantation die zahlreichen
Interaktionen der DAAs, insbesondere mit der immunsuppressiven
Medikation, dar. Simeprevir ist in Kom-
bination mit Cyclosporin
kontraindiziert. Bei Einsatz des Abbvie3D-Regime mit dem Ritonavir
geboosterten Proteasehemmer Paritaprevir wird Tacrolimus in einer
Dosis von 0,5 mg 1x/Woche oder 0,2 mg alle 3 Tage während der
antiviralen Therapie empfohlen. Die Cyclosporin A Dosis sollte unter
DAA Therapie auf 1/5 der Ausgangsdosis 1x/Tag reduziert werden.
Prednison darf lediglich in Dosen unter 5 mg/Tag verabreicht werden.
Der Einsatz von mTOR-Inhibitoren während des Therapiezeitraums wird
nicht empfohlen.
In
einer prospektiven multizentrischen Studie wurden in der
französisch-belgischen ANRS CO23 CUPILT-Kohorte bis dato 533
Patienten mit rekurrenter HCV-Infektion der Genotypen 1, 3, 4 und 5
nach LTx mit DAAs behandelt. Davon wurden 296 Patienten mit einer
Kombination aus SOF und DCV +/- RBV über 12 oder 24 Wochen
therapiert. Dabei waren die Ergebnisse für beide Regime mit und ohne
RBV mit SVR12-Raten von 96 %
bzw. 97 %
nach 24 Wochen vergleichbar. Bei der Mehrzahl der Patienten kam es zu
einer klinischen und laborchemischen Verbesserung bei insgesamt
guter Verträglichkeit. Allerdings kam es in 60 %
der Fälle zu einer signifikanten Verschlechterung der
Nierenfunktion und bei mehr als 50 %
der Patienten musste die Dosis der immunsuppressiven Therapie
angepasst werden, sodass ein engmaschiges Monitoring notwendig ist.
Auch die multizentrische, offene Phase 3 Studie ALLY-1 zeigte hohe SVR12-Raten von 91-100 % bei der Therapie von 53 stabilen Patienten mit rekurrenter HCV-Infektion aller Genotypen mind. 3 Monate nach LTx mit SOF/DCV + RBV (initial 600 mg/Tag, im Verlauf Dosissteigerung auf 1000 mg/Tag in Abhängigkeit vom Hb-Wert und der Kreatinin-Clearance) über 12 Wochen. Die Therapie wurde insgesamt gut vertragen und es waren keine Dosisanpassungen der immunsuppressiven Therapie notwendig.
Die prospektive randomisierte multizentrische SOLAR-2 Studie erzielte SVR12-Raten von 95-96% bei der Therapie von 168 Patienten mit rekurrenter Genotyp-1 oder 4 HCV-Infektion nach LTx mit Fibrosestadien F0-3 oder eine Child-A Zirrhose mit SOF/LDV + RBV (gewichtsadaptiert 1000 oder 12000 mg/Tag) über 12 bzw. 24 Wochen. Dabei waren die Ergebnisse nach 12 und 24 Wochen vergleichbar. Bei weiteren 53 Patienten lag bereits eine LCI im Stadium Child B oder C vor. Unter antiviraler Therapie mit SOF/LDV + RBV (Start mit 600 mg/Tag, im Verlauf Dosissteigerung) über 12 oder 24 Wochen erreichten Patienten mit einer Child B-Zirrhose SVR12-Raten von 95 bzw. 100 %, hingegen Patienten mit einer Child C-Zirrhose lediglich 50 bzw. 75 %.
Die Ergebnisse einer US-amerikanischen multizentrischen real-life Kohorte der antiviralen Therapie von 40 Patienten mit rekurrenter HCV-Genotyp 1 Infektion nach LTx mit SOF/SMV über 12 bzw. 24 Wochen zeigte eine SVR12-Rate von 71 % bei guter Verträglichkeit. Dabei konnte allerdings aufgrund der kleinen Fallzahlen nicht differenziert werden, ob die in 2/3 der Fälle kürzere Therapiedauer von 12 Wochen einen Einfluss auf die SVR12-Rate hat. Die meisten Therapieversager erlitten einen Relapse. Es gab keine signifikanten Auswirkungen der antiviralen Therapie auf die Dosen der Immunsuppression.
In der internationalen offenen Phase 2 Studie CORAL-I wurden 34 Patienten mit rekurrenter HCV-Infektion nach LTx mit der Kombination OBV/PTV/r + D + RBV über 24 Wochen behandelt. Dabei waren die Patienten mind. 1 Jahr nach LTx stabil, hatten keine höhergradige Fibrose (Metavir ≤ F2) und waren nach LTx noch nicht antiviral behandelt worden. Die SVR12-Rate betrug 97 %. Nebenwirkungen waren häufig, aber meist mild (Fatigue, Kopfschmerzen, Husten).
Schlussfolgerung
Zusammenfassend sind die Ergebnisse der antiviralen Therapie mit DAAs von Patienten mit HCV-assoziiierter LCI auf der Warteliste zur LTx und Patienten mit rekurrenter HCV-Infektion nach LTx vielversprechend. Die hohen SVR-Raten sind weitestgehend vergleichbar mit dem Nicht-LTx-Setting und lassen auf eine Reduktion von Organverlusten nach LTx und eine in naher Zukunft verringerte Rate an nötigen Lebertransplantationen hoffen. Dennoch bleiben viele Fragen, wie z.B. der optimale Zeitpunkt einer antiviralen Therapie von Patienten auf der Warteliste und nach LTx, offen und bedürfen weiterer Untersuchungen. Auch hinsichtlich der antiviralen Behandlung von Patienten mit dekompensierter LCI und einem MELD-Score > 20 sowie eingeschränkter Nierenfunktion besteht noch großer Bedarf an weiteren Daten.





