Christian P. Strassburg, Bonn
Hepatopulmonales Syndrom und portopulmonale Hypertonie
Der portale Hypertonus als Folge von chronischen Lebererkrankungen oder auch vaskulären Komplikationen im Bauchraum führt zu tiefgreifenden Veränderungen mit erheblicher Mortalitäts- und Morbiditätsrelevanz. Als Folge der Erhöhung des Druckes im Leberstromgebiet und der Portader kommt es unter anderem zu einer splanchnischen Vasodilatation, einer Reduktion des effektiven Blutvolumens und der Perfusion beispielsweise der Niere, zu Elektrolytveränderungen sowie einer Erhöhung von Herzfrequenz und Herzzeitvolumen. Die daraus resultierenden Folgen sind vielfältig und umfassen Aszites, Hyponatriämie, das Risiko einer spontan bakteriellen Peritonitis, gastrointestinale Blutungen bei Varizen und portal hypertensive Schädigung der luminalen Verdauungsorgane, das hepatorenale Syndrom und die Enzephalopathie. Diese Syndrome sind gut bekannt, während die portopulmonale Hypertonie und das hepatopulmonale Syndrom weniger beachtet werden.
Störung der Lungenfunktion
Symptome einer pulmonale Funktionsstörung sind bei Patienten mit Leberzirrhose nicht selten. Bei etwa 70 % der Kandidaten für eine Lebertransplantation besteht Dyspnoe 1. 45-50 % haben auffällige Blutgase und pathologische pulmonale Funktionstests 2. Zudem wird bei 40 % aller Zirrhotiker eine pulmonale Vasodilatation beobachtet 3 und 8-15 % fallen durch Hypoxämie und Leistungsminderung auf 4. Aufgrund plausibler klinischer Erklärungen für pulmonale Funktionsstörungen bei Aszites und Pleuraergüssen ist es wahrscheinlich, dass es in der ärztlichen Wahrnehmung und Sensibilität für pulmonale Erkrankungen bei Zirrhotikern eine differentialdiagnostische Lücke gibt.
Differentialdiagnose
Das differentialdiagnostische Spektrum pulmonaler Störungen beim Leberkranken mit portalem Hypertonus ist breit und umfasst prinzipiell (Abb.1):
- zufällig koexistierende Lungenerkrankungen,
- hepatopulmonale Erkrankungen ohne primär hepatische Ursache,
- hepatopulmonale Erkrankungen mit hepatischer Ursache und
- Komplikationen der Leberzirrhose.
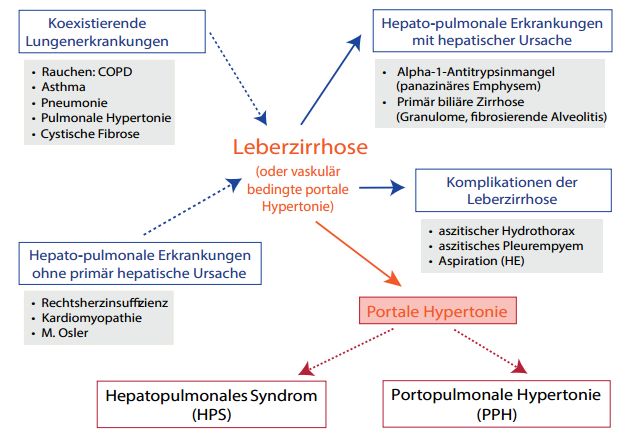 Abbildung 1: Differentialdiagnose pulmonaler Störungen.
Abbildung 1: Differentialdiagnose pulmonaler Störungen.
Zu den koexistierenden Erkrankungen gehören übliche Differentialdiagnosen wie die COPD, Folgen des Tabakgebrauchs, Asthma, pneumonische Infektionen, die idiopathische pulmonale Hypertonie (iPAH) und die cystische Fibrose. Lungenerkrankungen, die auch eine Leberpathologie beinhalten können, ohne dass diese die Lungenerkrankung bedingt, sind die Rechtsherzinsuffizienz, die Kardiomyopathie und der M. Osler-Weber-Rendu. Lungenerkrankungen, bei denen die Ursache in der Leber zu finden ist, sind beispielsweise der Alpha-1-Antitrypsinmangel und die primär biliäre Zirrhose (hier Granulome und eine mögliche fibrosierende Alveolitis). Schließlich sind Komplikationen der Leberzirrhose wie der aszitische Hydrothorax, das aszitische Pleuraempyem und auch die Aspiration bei Enzephalopathie anzutreffen. Zu trennen von diesen Entitäten sind die portopulmonale Hypertonie und das hepatopulmonale Syndrom 5.
Hepatopulmonales Syndrom
1966 wurde in Obduktionspräparaten bei Patienten mit Leberzirrhose eine pulmonale Vasodilatation beschrieben 6 und seit 1977 ist das hepatopulmonale Syndrom (HPS) als nosologische Entität beschrieben 7. Ein HPS findet sich bei 4 bis 32 % aller Kandidaten für eine Lebertransplantation 8.
Klinisch ist das HPS durch eine Belastungsdyspnoe (auch ohne Aszites), Spider Angiome und Trommelschlägelfinger, einen paO2 unter 60 mmHg bei Raumluft und Zyanose gekennzeichnet 9. Bemerkenswert ist das Symptom der Orthodeoxie, bei der der pO2 Wert um 5 % oder 4 mm Hg geringer ist, wenn sich der Patient aufrichtet. Gleichermaßen ist eine Plathypnoe typisch, bei der die Dyspnoe beim Aufrichten gegenüber der horizontalen Lage zunimmt. Das Orthodeoxie-Plathypnoe-Syndrom ist ein entscheidendes klinisches Symptom des HPS 5,7,9,10. Das Thorax-Röntgenbild ist bei HPS in der Regel unauffällig.
Pathogenese
Ursachen dieser Erkrankung sind massive Vasodilatationen und Shunts der pulmonalen (kapillären und präkapillären) Gefäße infolge eines Gefäßremodellings. Angeschuldigt wird hier ein durch Stickoxid (NO) vermittelter Mechanismus 3,6,11, der durch Endotheline und heraufregulierte endotheliale NO-Syn-thasen vermittelt wird. Tatsächlich konnte gezeigt werden, dass bei zirrhotischen Patienten NO in der Expirationsluft erhöht ist 11,12. Auch ein bakterieller Einfluss wird diskutiert, da durch eine antibiotische Behandlung die NO-Synthase-Aktivität vermindert werden kann, was allerdings kein therapeutisches Prinzip des HPS darstellt 9. Der Oxygenierungsstörung liegt somit eine Vasodilatation einerseits und eine Rechts-Links-Shunt-Bildung andererseits zugrunde.
Schweregrad
Beim HPS liegt meist unter Raumluft ein paO2 von geringer als 80 mm Hg und/oder ein alveolar-arterieller Sauerstoffgradient von größer 15 mm Hg vor. Eine Einteilung des Schwergrads kann über den Sauerstoffpartialdruck erfolgen. Milde Formen weisen einen paO2 von über 80 mm Hg, mittlere einen von 60-80 mm Hg, schwere 50-60 mm Hg und schwerste einen paO2 von unter 50 mm Hg auf.
Das HPS wird diagnostisch durch die Kontrastmittel-gestützte Echokardiographie gesichert. Hierbei werden abnorme pulmonale Vasodilatationen dokumentiert. Es kommt zu einem frühen Auftauchen des Kontrastmittels („bubbles“) im linken Ventrikel (ca. 3-6 Schläge nach Rechtspassage). Beim nuklearmedizinischen Lungen-Perfusions-Scan kommt es zu einer abnormalen (> 6 %) Aufnahme im Gehirn. Die Szintigraphie wird jedoch nicht regelmäßig diagnostisch eingesetzt. Die Diagnose ist in der Praxis durch die Kombination aus Orthodeoxie-Plathypnoe-Syndrom und pathologischer kontrastverstärkter Echokardiographie zu stellen 9.
Behandlung
Die Prognose des HPS ist schlecht. Das mittlere Überleben wird mit 24 Monaten, das 5-Jahresüberleben mit 23 % angegeben 13. Welchen Anteil daran die Leberzirrhose mit portalem Hypertonus und seinen Folgen hat, ist schwer abzuschätzen.
Therapeutisch existieren für das HPS keine effektiven medikamentösen Strategien. Anekdotisch berichtete Therapieversuche mit Antibiotika, Betablocker, Cyclooxygenasinhibitoren, Steroiden, Knoblauch, NO-Inhibitoren und Stomatostatin blieben ohne befriedigendes Ergebnis 14. Da der portale Hypertonus ursächlich an der Entstehung des Syndroms beteiligt ist, wird eine Senkung angestrebt. Die Implantation eines transjugulären portasystemischen Stent-Shunts (TIPS) ist allerdings kritisch zu sehen. Durch die Hyperzirkulation besteht die Gefahr, die pathophysiologischen Mechanismen der pulmonalen Vasodilatation zu begünstigen 15. Zudem ist diese Option ebenso wie die Embolisation der pulmonalen Shunts nicht ausreichend evaluiert. In der Regel ist eine symptom-orientierte langfristige Sauerstofftherapie notwendig 9.
Die einzig verfügbare kausale Therapie ist die Lebertransplantation, die den portalen Hypertonus beseitigt 16. Das Stellen der Indikation erfordert die interdisziplinäre Begutachtung durch ein erfahrenes Transplantationsteam. Da das HPS nicht sofort durch eine Lebertransplantation korrigiert wird, sind Patienten mit HPS durch eine erhöhte post-Transplantationsmortalität gekennzeichnet 17. Diese ist dann besonders hoch, wenn vor Transplantation der paO2 unter 50 mm Hg war und in der Lungenszintigraphie mehr als 20 % Speicherung im Gehirn nachweisbar war. Das in Deutschland zur Leberallokation eingesetzte MELD-System (model for end-stage liver disease) sieht keine Priorität für HPS-Patienten vor. Es gibt jedoch in den Richtlinien zur Lebertransplantation eine Sonderkategorie (standard exception; SE). Eine Standard Exception kann bei folgenden Voraussetzungen beansprucht werden:
- der arterielle paO2 unter Raumluft im Sitzen unter 60 mmHg
- keine weitere Lungenkrankheit
- intrapulmonale Shunts unter Ausschluss intrakardialer Shunts in der Echokardiographie
- nachgewiesene Lebererkrankung 16.
Unter diesen Bedingungen wird eine 15 % MELD-Priorität zuerkannt, die alle drei Monate um 10 % steigt und zwar unabhängig von Laborwerten (INR, Bilirubin, Kreatinin). In einer US-amerikanischen Studie betrug das 5-Jahresüberleben nach Lebertransplantation bei HPS-Patienten 76 % 13.
Portopulmonale Hypertonie
Die portopulmonale Hypertonie (PPH) wird pathophysiologisch durch vollständig andere Mechanismen als das HPS ausgelöst. Es wird durch eine Erhöhung des pulmonalen Gefäßdruckes und Widerstandes erzeugt 5. Die PPH ist keine genetische Erkrankung, sondern wie das HPS eine erworbene Störung 10. Dies unterscheidet sowohl PPH und HPS vom M. Osler-Weber-Rendu. Definitionsgemäß liegt bei Patienten mit portaler Hypertonie und Druckerhöhung im kleinen Kreislauf eine PPH vor, wenn andere Ursachen der pulmonalen Hypertonie wie hyperdyname Kreislaufsituation, Hyperhydratation, Linksherzerkrankungen, Lungenerkrankungen und/oder Hypoxämie, Lungenembolien und weitere seltene Ursachen ausgeschlossen sind.
Symptome
In frühen Stadien der PPH können die Patienten asymptomatisch sein oder nur Symptome der Lebererkrankung zeigen. Am häufigsten wird eine belastungs-abhängige Dyspnoe beobachtet. Später treten Abgeschlagenheit, Palpitationen, thorakale Schmerzen oder thorakales Druckgefühl hinzu. Die Angaben zur Häufigkeit der PPH bei Patienten mit Leberzirrhose schwanken zwischen 1 % bis 6 % 8,9.
Pathogenese
Die Pathogenese der PPH ist bis heute nicht abschließend aufgeklärt. Zu den Hypothesen zählen der sogenannte „Shear stress“ der Pulmonalgefäße im Rahmen der Zirrhose-bedingten Hyperzirkulation, autoimmune Mechanismen, eine genetische Disposition, vasoaktive Mediatoren aus dem Splanchnikusstromgebiet, die unter Umgehung des hepatischen Metabolismus in höherem Maße die Lungenstrombahn erreichen, Zytokine und Wachstumsfaktoren und eine humorale Imbalance mit Überschuss von vasokonstriktorischen Mediatoren (z.B. Endothelin-1) und Mangel an Vasodilatoren (z.B. NO und Prostazyklin).
Diagnostik
| normal | mild | moderat | schwer | |
| WHOFC | — | I,II | II,III | III,IV |
| PAPm (mmHg) | < 20 | 25-34 | 35-44 | >45 |
| HI (l min-1 m2) | 2,5-4,0 | > 2,5 | >2,5 | <2,0 |
| PVR (dyne s-1 cm-5) | <240 | 240-500 | 500-800 | >800 |
| RAP (mmHg) | 0 - 5 | 0 - 5 | 5 - 8 | > 8 |
| WHO FC= World Health Organisation Functional Class mPAP= mittlerer pulmonal-arterieller Druck HI=Herzindex PVR= pulmonal-vaskulärer Widerstand RAP= rechts-atrialer Widerstand |
||||
Tabelle 1: Kriterien einer milden, moderaten und schweren portopulmonalen Hypertonie. (nach5)
Während die Diagnose der idiopathischen portalen Hypertonie meist klinisch und sonographisch erfolgt, ist für die Diagnose der PPH eine invasive Diagnostik mittels Rechtsherzkatheter notwendig. Eine pulmonale Hypertonie liegt definitionsgemäß vor, wenn im Rechtsherzkatheter der mittlere pulmonal arterielle Druck (mPAP) in Ruhe gemessen ≥ 25 mmHg beträgt 18. Hierbei müssen neben dem erhöhten mPAP ein erhöhter pulmonalvaskulärer Widerstand (> 240 dyn x s x cm-5), ein normaler pulmonalkapillärer Verschlußdruck (≤ 15 mm Hg) und /oder ein erhöhter transpulmonaler Gradient (mPAP minus pulmonal-kapillärer Verschlussdruck: > 12 mm Hg) vorliegen.
Die Echokardiographie ist bei entsprechendem Verdacht die beste nicht-invasive initiale Untersuchungsmethode. Sie dient gleichzeitig als Hinweis bzw. Ausschluss linkskardialer Erkrankungen als Ursache für eine pulmonale Hypertonie. Echokardiographische Kontrollen alle 6 bis 12 Monate werden bei Patienten, die zur Lebertransplantation gelistet sind, zum Ausschluss einer entstehenden pulmonalen Hypertonie empfohlen 9. Ab einem echokardiographisch gemessenem rechtsventrikulärem Druck von > 50 mm Hg unklarer Genese wird die Durchführung einer Rechtsherzkatheter-Untersuchung empfohlen 9.
Die Diagnose der PPH erfolgt sehr oft erst Jahre nach Diagnosestellung eines portalen Hypertous. Der Einteilung des Schweregrades der PPH wird in Tabelle 1 gezeigt.
Behandlung
Die PPH hat eine schlechte Prognose. Die 5-Jahres-Überlebensrate betrug in einer retrospektiven Screeningstudie, in der die Diagnose der PPH mittels Rechtsherzkatheter gestellt wurde, ohne spezifische Therapie 14 %. Die Hälfte der Patienten verstarb innerhalb des ersten Jahres. Der mPAP und der pulmonal vaskuläre Widerstand dieser Patienten lagen im Mittel bei 50 mmHg und 550 dyn x sec x cm-5 19.
Obwohl Patienten mit PPH in den meisten randomisierten und kontrollierten Therapiestudien zur pulmonalen arteriellen Hypertonie (PAH) nicht untersucht wurden, wird empfohlen, diese wie PAH-Patienten zu behandeln. Hierbei kommen Prostazykline, Endothelinrezeptorantagonisten, Phosphodiesterase-Inhibitoren und HMG-CoA-Reduktaseinhibitoren infrage. Bei den neueren Wirkstoffen ist das Risiko einer Lebertoxizität inzwischen geringer.
In ausgewählten Fällen ist die Lebertransplantation eine definitive Option der Behandlung 16. Diese ist allerdings risikoreich und sollte nur an erfahrenen Zentren mit einem interdisziplinären Transplantationsteam mit entsprechender Erfahrung in der Behandlung der PAH geplant werden 20. Auch hier ist eine Priorität mit dem MELD-System zur Leberallokation nicht zu erreichen und es gibt daher ebenso wie für das HPS eine Standard Exception-Kategorie 16. Zur Erlangung der Standard Exception (SE) müssen fünf Bedingungen erfüllt sein:
- mPAP (mit oder ohne Therapie)
25-35 mm Hg - pulmonaler Gefäßwiderstand
≥ 240 dyn/sec - pulmonalkapillärer Wedgedruck
≤ 15 mm Hg - Erhebung der Werte durch Rechtsherzkatheter
- Nachweis einer Lebererkrankung.
Die PPH-SE führt zu einer Priorität von 25 % (3 Monatsmortalität) und einem Zuwachs alle 3 Monate von 10 %. Ein mPAP von > 50 mm Hg ist eine Kontraindikation für die Lebertransplantation. Die Indikation muss sorgfältig im Einzelfall abgewogen werden, unter Einbeziehung des Erfolges eingeleiteter medikamentöser Therapien.
- Sood GK. TIPS in treatment of gastric varices. Gastroenterology 1998; 115(6): 1606-7.
- Hourani JM, Bellamy PE, Tashkin DP, Batra P, Simmons MS. Pulmonary dysfunction in advanced liver disease: frequent occurrence of an abnormal diffusing capacity. The American journal of medicine 1991; 90(6): 693-700.
- Abrams GA, Trauner M, Nathanson MH. Nitric oxide and liver disease. The Gastroenterologist 1995; 3(3): 220-33.
- Lange PA, Stoller JK. The hepatopulmonary syndrome. Annals of internal medicine 1995; 122(7): 521-9.
- Hoeper MM, Krowka MJ, Strassburg CP. Portopulmonary hypertension and hepatopulmonary syndrome. Lancet 2004; 363(9419): 1461-8.
- Berthelot P, Walker JG, Sherlock S, Reid L. Arterial changes in the lungs in cirrhosis of the liver--lung spider nevi. The New England journal of medicine 1966; 274(6): 291-8.
- Kennedy TC, Knudson RJ. Exercise-aggravated hypoxemia and orthodeoxia in cirrhosis. Chest 1977; 72(3): 305-9.
- Krowka MJ, Mandell MS, Ramsay MA, et al. Hepatopulmonary syndrome and portopulmonary hypertension: a report of the multicenter liver transplant database. Liver transplantation : official publication of the American Association for the Study of Liver Diseases and the International Liver Transplantation Society 2004; 10(2): 174-82.
- Halank M, Strassburg CP, Hoeper MM. [Pulmonary complications of liver cirrhosis: hepatopulmonary syndrome, portopulmonary hypertension and hepatic hydrothorax]. Der Internist 2010; 51 Suppl 1: 255-63.
- Rodriguez-Roisin R, Krowka MJ. Hepatopulmonary syndrome--a liver-induced lung vascular disorder. The New England journal of medicine 2008; 358(22): 2378-87.
- Rolla G, Brussino L, Colagrande P, et al. Exhaled nitric oxide and oxygenation abnormalities in hepatic cirrhosis. Hepatology 1997; 26(4): 842-7.
- Rolla G, Brussino L, Colagrande P, et al. Exhaled nitric oxide and impaired oxygenation in cirrhotic patients before and after liver transplantation. Annals of internal medicine 1998; 129(5): 375-8.
- Swanson KL, Wiesner RH, Krowka MJ. Natural history of hepatopulmonary syndrome: Impact of liver transplantation. Hepatology 2005; 41(5): 1122-9.
- Rodriguez-Roisin R, Krowka MJ, Herve P, Fallon MB, Committee ERSTFP-HVDS. Pulmonary-Hepatic vascular Disorders (PHD). The European respiratory journal 2004; 24(5): 861-80.
- Lasch HM, Fried MW, Zacks SL, et al. Use of transjugular intrahepatic portosystemic shunt as a bridge to liver transplantation in a patient with severe hepatopulmonary syndrome. Liver transplantation : official publication of the American Association for the Study of Liver Diseases and the International Liver Transplantation Society 2001; 7(2): 147-9.
- Strassburg CP. [Patient selection and indications for liver transplantation]. Der Chirurg; Zeitschrift fur alle Gebiete der operativen Medizen 2013; 84(5): 363-71.
- Krowka MJ, Fallon MB. Liver transplantation for hepatopulmonary syndrome (HPS): what is the MESSAGE? American journal of transplantation : official journal of the American Society of Transplantation and the American Society of Transplant Surgeons 2008; 8(5): 911-2.
- Badesch DB, Champion HC, Sanchez MA, et al. Diagnosis and assessment of pulmonary arterial hypertension. Journal of the American College of Cardiology 2009; 54(1 Suppl): S55-66.
- Swanson KL, Wiesner RH, Nyberg SL, Rosen CB, Krowka MJ. Survival in portopulmonary hypertension: Mayo Clinic experience categorized by treatment subgroups. American journal of transplantation : official journal of the American Society of Transplantation and the American Society of Transplant Surgeons 2008; 8(11): 2445-53.
- Krowka MJ. Evolving dilemmas and management of portopulmonary hypertension. Seminars in liver disease 2006; 26(3): 265-72.





