International Liver Meeting 2014
 Hepatitis
C – Bald kein Problem mehr!?
Hepatitis
C – Bald kein Problem mehr!?
Die Stimmung der über 10.000 Teilnehmer auf dem Internationalen Leberkongress in London hätte nicht besser sein können. Eine Erfolgsmeldung jagte die andere. Heilungsraten von nahezu 100 % mit einfachen, quasi nebenwirkungsfreien oralen Regimen über wenige Wochen waren die Regel. Sicherlich hatte man das erwartet, dennoch war das Gesamtbild beeindruckend. Ein medizinischer Traum ist in Erfüllung gegangen.
In greifbarer Nähe
Derzeit laufen die Zulassungsanträge mehrerer direkt antiviraler Substanzen (DAA). Diese Substanzen bzw. Regime wurden in Phase-3-Studien meist beim in den Industrieländern dominanten Genotyp 1 geprüft. Am weitesten in der Entwicklung mit voraussichtlicher Zulassung Ende 2014/Anfang 2015 sind:

- ABT450/r/Ombitasvir plus Dasabuvir
Proteasehemmer/Ritonavir-Booster/NS5A-Inhibitor plus nicht-nukleosidischer Polymerasehemmer
Dasabuvir
Tabletten: 2-0-1
AbbVie - Sofosbuvir/Ledipasvir
NS5B-/NS5A-Inhibitor
Tabletten: 1-0-0
Gilead Sciences - Daclatasvir/Asunaprevir
NS5A-/Proteasehemmer
Tabletten: 2-0-1
Bristol-Myers Squibb
Zu diesen Regimen wurden große Phase-3-Studien vorgestellt. Die Heilungsraten lagen über 90 % auch ohne Ribavirin und Nebenwirkungen waren vernachlässigbar. In einigen Studien zeigte sich ein Trend zu einem etwas schlechteren Ansprechen bei Patienten mit fortgeschrittener Zirrhose. Ob bei dieser Patientenpopulation eine Kombination besser ist als eine andere, lässt sich derzeit nicht beurteilen. In den Studien waren u.a. die Zahl der Zirrhose-Patienten sowie das Stadium der Lebererkrankung unterschiedlich, ganz abgesehen davon, dass es sich nicht um direkte Vergleiche handelt. Im Hinblick auf die Resistenz scheinen Polymorphismen keine Rolle mehr zu spielen, wenn die Kombination potent genug ist.
ABT450/r/Ombitasvir plus Dasabuvir
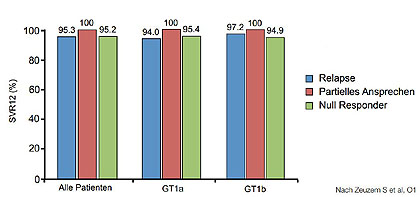 Abbildung 1:SAPPHIRE II: SVR12 bei Vorbehandelten in Abhängigkeit vom GT1-Subtyp und früherem Ansprechen
Abbildung 1:SAPPHIRE II: SVR12 bei Vorbehandelten in Abhängigkeit vom GT1-Subtyp und früherem Ansprechen
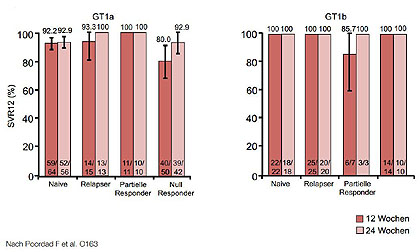 Abbildung 2:TURQUOISE II: SVR12 bei Zirrhotikern in Abhängigkeit vom GT1-Subtyp.
Abbildung 2:TURQUOISE II: SVR12 bei Zirrhotikern in Abhängigkeit vom GT1-Subtyp.
Zur AbbVie 3DAA-Kombination wurden die Phase-3-Studien SAPPHIRE-I (Therapienaive, 12 Wochen mit Ribavirin) und SAPPHIRE-II (Vorbehandelte,12 Wochen mit Ribavirin) und TURQUOISE-II (Kompensierte Zirrhose, 12 vs. 24 Wochen mit Ribavirin) vorgestellt (Feld JJ et al, O60; Zeuzem S et al, O1; Poordad et al, O163) . Die Studie TURQOUISE-II mit 380 Patienten war die erste Untersuchung allein an Zirrhotikern.
In allen drei Studien lagen die Heilungsraten weit über 90 %. Selbst die Zirrhotiker wurden fast alle geheilt - auch frühere Null-Responder sowie Patienten mit portaler Hypertension und eingeschränkter Leberfunktion (Abb. 1 und 2). Hinsichtlich der Therapiedauer waren 24 Wochen bei früheren Null-Responder etwas besser. Virologische Durchbrüche waren selten. Versager hatten meist einen Relaps und bei vielen Patienten wurden Therapie-assoziierte Mutationen gefunden und zwar gegen alle Bestandteile der Kombination. Die Vertäglichkeit war sehr gut, auch in der Gruppe der Zirrhotiker. Die Reduktion der Ribavirin-Dosis hatte keinen negativen Einfluss.
Nach Transplantation
Auch bei Lebertransplantierten mit HCV-Rezidiv war die 3DAA-Kombination von AbbVie plus Ribavirin sicher und erfolgreich. Die Dosis von Tacrolimus sowie Cyclosporin wurde wegen Interaktionen mit dem geboosterten Proteasehemmer adjustiert. Nach 24 Wochen Therapie hatten 25/26 (96 %) der auswertbaren Patienten die SVR12 erreicht. Lediglich ein Relaps wurde beobachtet (Kwo P et al, O114).
Genotyp 4
In der kleinen Untersuchung PEARL I erreichten 91 % bzw. 100 % der therapienaiven Patienten mit GT4 ohne Zirrhose ohne bzw. mit Ribavirin die SVR12 nach 12 Wochen ABT-450/r plus Ombitasvir. Die Daten der vorbehandelten Patienten konnten noch nicht ausgewertet werden (Hezode C et al, O58).
Sofosbuvir/Ledipasvir
Sofosbuvir/Ledipasvir wurde in ION-1 an therapienaiven (12
vs. 24 Wochen mit/ohne Ribavirin), ION-2 an Proteasehemmer Vorbehandelten (12
vs. 24 Wochen mit/ohne Ribavirin)und in ION-3 an therapienaiven Patienten ohne
Zirrhose (8 vs. 12 Wochen) geprüft (Mangia A et al, O164; Afdhal N et al, O109;
Kowdley KV et al, O56).
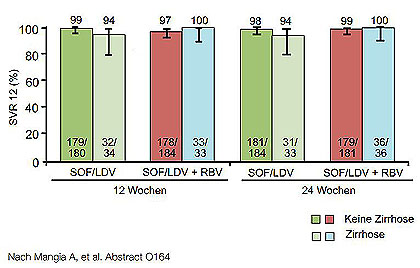 Abbildung 3:ION 1: SVR12 bei therapienaiven Patienten mit GT1 in Abhängigkeit vom Zirrhose-Status.
Abbildung 3:ION 1: SVR12 bei therapienaiven Patienten mit GT1 in Abhängigkeit vom Zirrhose-Status.
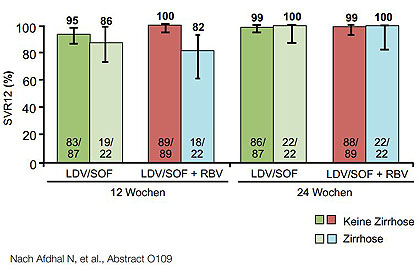 Abbildung 4:ION 2: SVR12 bei mit Proteasehemmern vorbehandelten Patienten mit GT1 in Abhängigkeit vim Zirrhose-Status.
Abbildung 4:ION 2: SVR12 bei mit Proteasehemmern vorbehandelten Patienten mit GT1 in Abhängigkeit vim Zirrhose-Status.
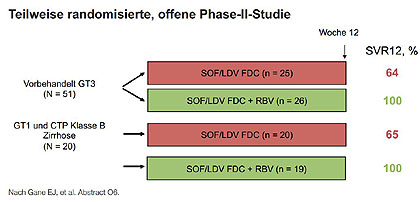 Abbildung 5:ELECTRON 2: SOF/LDV FDC ± RBV bei schwer zu behandelnden Patienten.
Abbildung 5:ELECTRON 2: SOF/LDV FDC ± RBV bei schwer zu behandelnden Patienten.
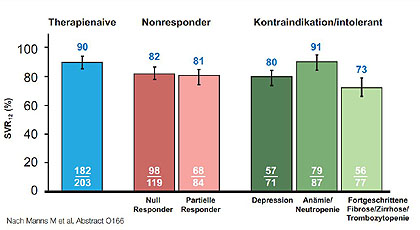 Abbildung 6:HALLMARK-DUAL: SVR12 in Abhängigkeit von Subgruppe.
Abbildung 6:HALLMARK-DUAL: SVR12 in Abhängigkeit von Subgruppe.
Die SVR12-Raten lagen in allen drei Studien über 95 % - mit einer Ausnahme. In ION-2 hatten mit Proteasehemmer vorbehandelte Patienten mit Zirrhose bei 12 Wochen Therapie eine mit 82 % signifikant geringere SVR12 (Abb. 3 und 4). Bei naiven Patienten ohne fortgeschrittene Fibrose scheinen dagegen auch 8 Wochen Behandlung auszureichen.
Ribavirin hatte keinen zusätzlichen Effekt. Fast alle Therapieversager waren Relapser. Der Relaps war häufig mit NS5A-Resistenzmutationen verbunden, während keine Sofosbuvir-assoziierten Resistenzen beobachtet wurden. Vorbestehende Polymorphismen hatten keinen Einfluss auf den Therapieerfolg.
Schwierige Situationen
In der kleinen Studie ELECTRON-2 wurde die Fixkombination
Sofosbuvir/Ledipasvir an schwer zu behandelnden Patienten geprüft und zwar an
Patienten mit GT3, mit GT1 und dekompensierter Zirrhose sowie GT1 nach
Sofosbuvir/Ribavirin-Versagen. Bei GT3 scheint die Kombination allein nicht
auszureichen. Erst die Zugabe von Ribavirin erhöhte die SVR12 in akzeptable
Bereiche (62 % vs.
100 %). Auch bei
dekompensierten Patienten war der Erfolg nicht befriedigend. Nur 13/20
Patienten (65 %)
hatten eine SVR12. Bei sieben Patienten wurde ein Relaps beobachtet.
Nach einem Therapieversagen unter Sofosbuvir/Ribavirin 12 Wochen konnten alle Patienten mit GT1 durch 12 Wochen Sofosbuvir/Ledipasvir geheilt werden (Gane E et al, O6) (Abb. 5). Bei GT2/3 reichte insbesondere bei Leberzirrhose die längere Retherapie mit Sofosbuvir/Ribavirin über 24 Wochen nicht aus. Erst durch die Zugabe von Interferon konnten die SVR-Raten auf bis zu 93 % gesteigert werden (Esteban R et al, O8).
Daclatasvir/Asunaprevir
Daclatasvir/Asunaprevir wurde in HALLMARK-DUAL bei Patienten mit GT1b (naiv/vorbehandelt/Nullresponder mit/ohne Fibrose) über 24 Wochen gegeben. Die SVR12 lag bei 73 % (Zirrhose mit Thrombozytopenie) bis 90 % bei Naiven (Abb. 6). Virologische Durchbrüche und Relaps waren selten (Manns M et al, O166). Diese Kombination wird in Deutschland voraussichtlich nicht in absehbarer Zeit zur Verfügung stehen, nachdem das Unternehmen die Zulassung von Asunaprevir als Einzelsubstanz in Europa nicht beantragen wird.
Die 3er-Kombination von Daclatastvir/Asunaprevir plus dem nicht-nukleosidischen NS5B-Inhibitor BMS-791325 wird derzeit in den Phase-3-Studien UNITY-1 und -2 an naiven und vorbehandelten Patienten mit und ohne Zirrhose untersucht. Dieses Regime soll dann auch in Europa zugelassen werden. Erste Ergebnisse mit dieser Kombination gab es bei Genotyp 4. Hier erreichten alle 21 Patienten der Studie die SVR12 (Hassanein T et al, P1163).
Noch in diesem Jahr
Bereits im Sommer/Herbst 2014 werden in Europa der Proteasehemmer Simeprevir und der NS5A-Inhibitor Daclatasvir zugelassen werden. Viele Patienten warten bereits auf diese Substanzen, denn sie sind in Kombination mit Sofosbuvir auch bei vorbehandelten Zirrhotikern hocheffektiv. Ob die Interferon-freie Kombination von Simeprevir bzw. Daclatasvir mit Sofosbuvir im Zulassungstext berücksichtigt wird oder nicht, bleibt abzuwarten. Man geht derzeit jedoch davon aus, dass die europäischen Behörden diese Therapien zumindest den Patienten, die sie am nötigsten brauchen, zugänglich d.h. erstattungsfähig machen werden. Zur Zulassung kommen wird auch der Proteasehemmer Faldaprevir von Boehringer Ingelheim. Zu dieser Substanz gibt es jedoch keine Daten zur Kombination mit Sofosbuvir und sie wird auch nicht in Kombination mit anderen DAA weiter entwickelt.
Sofosbuvir/Simeprevir
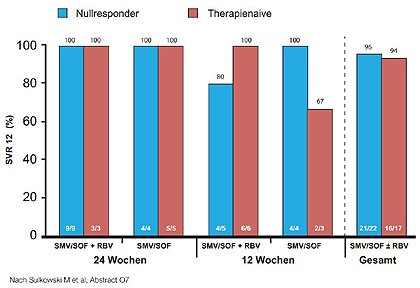 Abbildung 7:COSMOS Kohorte 2. SVR12 in Abhängigkeit von GT1-Subtyp und Q80K zu Baseline.
Abbildung 7:COSMOS Kohorte 2. SVR12 in Abhängigkeit von GT1-Subtyp und Q80K zu Baseline.
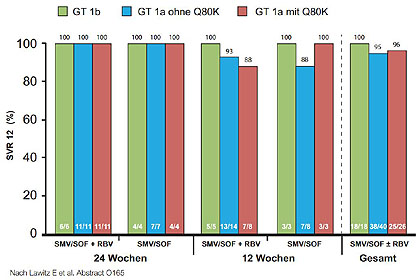 Abbildung 8:COSMOS Kohorte 2. SVR12 bei Therapienaiven und Nullrespondern mit fortgeschrittener Fibrose.
Abbildung 8:COSMOS Kohorte 2. SVR12 bei Therapienaiven und Nullrespondern mit fortgeschrittener Fibrose.
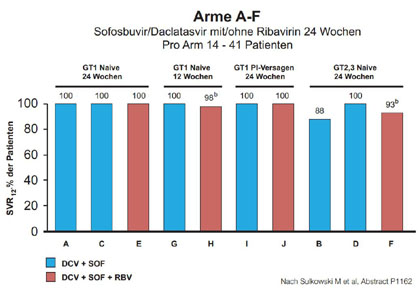 Abbildung 9:Daclatasvir/Sofosbuvir. SVR in Abhängigkeit von Genotyp und Therapiestatus.
Abbildung 9:Daclatasvir/Sofosbuvir. SVR in Abhängigkeit von Genotyp und Therapiestatus.
In den USA steht diese Kombination schon länger, in Europa seit kurzem zur Verfügung. In den COSMOS-Studien wurde Sofosbuvir/Simeprevir (NS5B-/Proteasehemmer) bereits an einer kleiner Zahl schwer zu behandelnden Patienten geprüft. 80 Nullrespronder ohne Zirrhose (Kohorte 1) sowie 87 Naive/Vorbehandelte mit fortgeschrittener Fibrose (Kohorte 2) wurden 12 bzw. 24 Wochen mit/ohne Ribavirin behandelt (Sulkowski M et al, O7; Lawitz E et al, O165). Die SVR12-Raten lagen bei 79 % -100 % (Abb. 7 und 8). Ribavirin brachte keinen zusätzlichen Nutzen. Nullresponder mit GT1a und dem Q80K-Polymorphismus hatten etwas schlechter abgeschnitten. Bei den Patienten mit Fibrose/Zirrhose waren diese Parameter allerdings keine Prädiktoren mehr. Die Phase-3-Studien OPTIMIST-1 und -2 mit dieser Kombination sind bereits angelaufen.
Sofosbuvir/Daclatasvir
Sofosbuvir/Daclatasvir wurden in einer Studie bei verschiedenen Patientengruppen untersucht, u.a. an Patienten mit Tripletherapie-Versagen. Die SVR-Rate von 100 % bei diesen Patienten wurde bereits auf dem letzten europäischen EASL-Kongress präsentiert (Abb. 9). In diesem Jahr gab es noch ein Poster, in dem die gute Verträglichkeit der Kombination dokumentiert wurde (Sulkowski M et al, P 1162). In einer weiteren Arbeit wurden Patienten mit Rezidiv-Hepatitis nach Transplantation behandelt. Die Kombination war sehr effektiv und hatte keinen Einfluss auf die Immunsuppressiva. Die Autoren empfehlen einen frühen Therapiebeginn noch vor Cholestase oder Dekompensation (Pellicelli et al, P1312). Sofosbuvir/Daclatasvir wird derzeit von Bristol-Myers Squibb weiter untersucht und zwar in den Phase-3-Studien ALLY 1-3 an Patienten mit GT 1-6 vor/nach Lebertransplantation, an Patienten mit GT3 und HIV/HCV-Koinfizierten.
Sofosbuvir/RBV bei schwer Kranken
Erste Daten zum Einsatz von Sofosbuvir im klinischen Alltag liegen bislang lediglich aus dem Compassionate Use-Programm bei schwer kranken Patienten vor. Im Rahmen des Programms wurden wurden 104 Patienten (GT1-4) mit schwerer Rezidivhepatitis nach Lebertransplantation behandelt. Einige davon hatten eine fibrosierende cholestatische Hepatitis bzw. eine dekompensierte Zirrhose. Bei mehr als der Hälfte besserte sich der Zustand und 62 % erreichten eine SVR12 (Forns X et al, O62). In Boston waren es 50 Patienten mit fortgeschrittener Zirrhose (GT1-4), 60 % davon im Child Pugh Stadium B mit portaler Hypertension. Nach 24 Wochen Behandlung war HCV bei allen Patienten im Stadium CPT A sowie bei 93 % im Stadium CPT B nicht mehr nachweisbar. Ein Patient war Non-Responder zu Woche 8. (Afdhal N et al, O68). Die Verträglichkeit und Sicherheit von Sofosbuvir/Ribavirin waren sehr gut und auch die SVR-Raten konnten gesteigert werden.
Prädiktoren
Fast alle bekannten Prädiktoren des Therapieansprechens auf die duale Therapie mit Interferon und Ribavirin haben im Interferon-freien Zeitalter ihre Bedeutung verloren. Das Ansprechen auf eine Vortherapie, der IL28B-Status, die Höhe der Viruslast, das frühe virologische Ansprechen unter Therapie usw. sind keine Prädiktoren mehr. Als wichtigster Prädiktor bleibt der Genotyp, wobei die Unterscheidung zwischen GT1a und GT1b bei den neueren Regimen ebenfalls an Bedeutung verliert. Patienten mit Leberzirrhose haben in allen Stadien der Erkrankung sehr gute Erfolgchancen, wobei Patienten mit fortgeschrittenem Leberschaden länger und intensiver behandelt werden zu müssen.
Das frühe Ansprechen auf die Therapie ist ebenfalls kein Prädiktor mehr. Selbst die sehr frühe virale Kinetik scheint nicht weiter zu helfen. In der VALENCE-Studie, in der Patienten mit GT3 12 bzw. 24 Wochen mit Sofosbuvir/Ribavirin behandelt wurden, war das frühe Ansprechen zu Woche 1, 2 oder 4 kein zuverlässiger Prädiktor für eine SVR (Zeuzem S et al, P1119)
Resistenz

Vorbestehende Polymorphismen haben nach dem bisherigen Erkenntnisstand lediglich bei Simeprevir ohne ein weiteres DAA Relevanz. Bei GT1a mit Q80K waren die SVR-Raten bei Simeprevir plus pegIFN und Ribavirin signifikant niedriger als ohne diesen Polymorphismus. Bei Simeprevir plus Sofosbuvir dagegen waren die SVR-Raten bei den Patienten mit und ohne diesem Polymorphismus vergleichbar. Der Einfluss von Polymorphismen zu Baseline war auch bei vielen anderen neuen Regimen untersucht worden. Es fand sich kein negativer Einfluss auf die Heilungschance.
Ein Therapieversagen bei den neuen DAA-Regimen ist meist kein Non-Response, sondern ein Relaps, manchmal ein Druchbruch. Beides ist in der Regel mit Resistenz-assoziierten Mutationen verbunden. Diese sind je nach Regime mehr oder weniger häufig. Wie lange die Mutationen bestehen und ob sie möglicherweise weitergeben werden, ist derzeit noch unklar. Persistierende Multi-Resistenzen könnten jedoch die Therapie-Optionen einschränken.
Weitere Entwicklungen
Die Pipeline ist prall gefüllt mit neuen Substanzen. Weiter in der Entwicklung fortgeschritten sind u.a. Sofosbuvir plus GS-5816 (NS5A-Inhibitor). Die SVR12-Raten lagen in einer Dosisfindungsstudie bei > 86 % bei allen Genotypen (Everson GT et al, O111). Mit den beiden MSD-Substanzen MK-5172 (Proteasehemmer) und MK-8742 (NS5A-Inhibitor) wurden in C-WORTHY innerhalb von 12 Wochen selbst bei Nullrespondern mit GT1 Heilungsraten über 90 % erreicht (Lawitz E et al, O61).
| EASL-LEITLINIEN | |
|---|---|
| GENOTYP | OPTIONEN |
| Genotyp 1 | PegIFN/Ribavirin + Sofosbuvir 12 Wochen (A1) Therapienaive & Relapser: PegIFN/Ribavirin + Simeprevir: 12 Wochen, gefolgt von 12 Wochen pegIFN/Ribavirin (A1) Partielle & Nullresponder: PegIFN/Ribavirin + Simeprevir: 12 Wochen, gefolgt von 36 Wochen pegIFN/Ribavirin (B1) Sofosbuvir & Simeprevir: 12 Wochen. (ggf plus Ribavirin bei Nonrespondern und bei Zirrhose). (B1) Sofosbuvir & Daclatasvir: Therapienaive 12 Wochen; Vorbehandelte 24 Wochen. (ggf. plus Ribavirin bei Nonrespondern und bei Zirrhose). (B1) PegIFN/Ribavirin + Daclatasvir 12 Wochen (NUR Genotype 1b) , (B1) gefolgt von 12 Wochen pegIFN/Ribavirin (B2) Sofosbuvir & Ribavirin 12 Wochen NUR bei Interferon-Unverträglichkeit, wenn keine anderen Interferon-freien Optionen zur Verfügung stehen (B2) |
| Genotyp 2 | Sofosbuvir & Ribavirin: 12 Wochen (16-20 Wochen bei Zirrhose, insbesondere bei Vorbe-handelten) (A1) PegIFN/Ribavirin + Sofosbuvir 12 Wochen bei Zirrhose und/oder Vorbehandelten (B1) |
| Genotyp 3 | Sofosbuvir & Ribavirin: 24 Wochen (nicht bei vorbehandelten Zirrhotikern, keine spezi-fische Alternative) (A2) PegIFN/Ribavirin + Sofosbuvir 12 Wochen (A2) Sofosbuvir & Daclatasvir 12 Wochen (24 Wochen bei Vorbehandelten) (B1) |
| Genotyp 4 | PegIFN/Ribavirin + Sofosbuvir 12 Wochen (B1) PegIFN/Ribavirin + Simeprevir: 12 Wochen gefolgt von 12 Wochen pegIFN/Ribavirin (B1) Partielle & Nullresponder: PegIFN/Ribavirin + Simeprevir: 12 Wochen gefolgt von 36 Wochen pegIFN/Ribavirin (B1) PegIFN/Ribavirin + Daclatasvir; 12 oder 24 Wochen (Response-gesteuerte Therapie) (B1) Sofosbuvir & Ribavirin 24 Wochen bei Interferon-Unverträglichkeit (C2) Sofosbuvir & Simeprevir: 12 Wochen (ggf. plus Ribavirin bei Nonrespondern und bei Zirrhotikern). (B2) Sofosbuvir & Daclatasvir: 12 Wochen bei Therapienaiven; 24 Wochen bei Vorbehandel-ten. (ggf. plus Ribavirin bei Nonrespondern und bei Zirrhotikern) (B2) |
| Genotyp 5 Genotyp 6 | PegIFN/Ribavirin + Sofosbuvir12 Wochen (B1) Sofosbuvir& Ribavirin: 12 Wochen (C2) |
Tabelle 1:Aktuelle EASL-Leitlinien zur Therapie der Hepatitis C
HIV/HCV-Koinfektion
Die HIV/HCV-Koinfektion ist keine Besonderheit mehr. Die SVR-Raten bei Mono- und Koinfizierten sind vergleichbar. Das bestätigt unter anderem die kleine Studie mit dem anspruchsvollen Namen ERADICATE. Alle der 50 HCV-therapienaiven HIV/HCV-Koinfizierten hatten auf die 12-wöchige Behandlung mit Sofosbuvir/Ledipasvir angesprochen und alle bislang ausgewerteten Patienten haben die SVR4 erreicht (Osinusi A et al, O14). In der Zukunft werden bei Koinfizierten vermutlich lediglich mögliche Interaktionen zwischen DAA und den antiretroviralen Substanzen zu beachten sein. In C-WORTHY wurden bereits Mono- und Koinfizierte innerhalb einer Studie behandelt. Alle 59 Patienten hatten unter Raltegravir+2NRTI keine nachweisebare HI-Viruslast und 97 % bzw. 90 % erreichten mit bzw. ohne Ribavirin nach 12 Wochen MK-5172 (Proteasehemmer) und MK-8742 (NS5A-Inhibitor) die SVR4 (Sulkowski M et al, O63).
Hepatitis B
Die Hepatitis B war ein Randthema auf diesem von der Hepaititis C dominierten Kongress. Vorgestellt wurden unter anderem drei größere Studien zur dualen Therapie von Interferon plus Polymerasehemmer – allerdings mit widersprüchlichem Ergebnis. Nachdem das Design dieser Untersuchungen (und möglicherweise auch der HBV-Genotyp) sehr unterschiedlich sind, ist eine Schlussfolgerung schwierig.
Pro duale Therapie
In der kontrollierten ERES Studie erhielten 175 HBeAg-positive Patienten zunächst 24 Wochen Entecavir. Dann wurde so weiterbehandelt oder pegyliertes Interferon dazu gegeben. Nach 48 Wochen wiederum wurde mit Entecavir allein weiterbehandelt und zwar Responder (HBV-DNA < 200 IU/ml und HBeAg-Verlust) bis Woche 72, Nonresponder bis Woche 96.
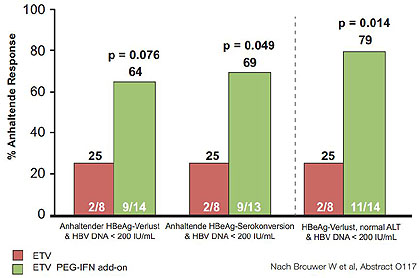 Abbildung 11:BZ ERES-Studie. Duale Therapie führt zu besserer Immunkontrolle.
Abbildung 11:BZ ERES-Studie. Duale Therapie führt zu besserer Immunkontrolle.
Zu Woche 48 hatten 19 %
in der Interferon-Gruppe und 10 %
in der Entecavir-Monotherapie-Gruppe den kombinierten Endpunkt erreicht und am
Ende der Studie waren es 25 %
vs. 64 %. Kombiniert
man weitere Endpunkte wie
HBeAg-Serokonversion oder normale Transaminasen wird die Differenz zugunsten
der dualen Therapie noch größer (Abb. 11) (Brouwer W et al, O117).
In einer weiteren Arbeit wurden 192 HBeAg-positive Patienten, die mindestens zwei Jahre ein Nukleosidanalogon eingenommen hatten ohne HBeAg-Verlust bzw. – Konversion, entweder so weiterbehandelt oder 48 Wochen zusätzlich mit einem pegylierten Interferon. 24 Wochen danach hatten 60 % der Patienten in der Kombinations-Gruppe und 14 % der Patienten in der Monotherapie-Gruppe HBeAg verloren und eine HBV-DNA < 2000 IU/ml. In der Interferon-Gruppe war bei 28 % sogar HBsAg verschwunden, in der Monotherapie-Gruppe bei keinem. Ein guter Responseprädiktor war das quantitative HBsAg. Alle Patienten mit < 1000 IU/ml zu Baseline erreichten den primären Endpunkt (Li G et al O117).
Contra duale Therapie
In dieser Studie wurden 280 HBeAg-positive Patienten zunächst mit Adenfovir, Entecavir oder Placebo behandelt. Zu Woche 4 erhielten sie zusätzlich Interferon für 50 Wochen und setzten nach zwei Wochen dualer Therapie den Polymerasehemmer/Placebo ab. 24 Wochen nach Ende der Behandlung war es bei 27 % in der Placebo/Interferon-Gruppe, bei 23 % in der Adefovir/Interferon-Gruppe und bei 28 % in der Entecavir/Interferon Gruppe zur HBeAg-Serokonversion gekommen. Die Theorie der Autoren, dass eine nicht komplett supprimierte Virämie bei Interferon-Start einen günstigen Einfluss auf die Serokonversion haben könnte, hat sich somit nicht bestätigt (Su W et al, O113).
Interferon Lambda
Das neue Interferon wird bei der Hepatitis C keine Rolle mehr spielen. Und bei der Hepatitis B scheint die Verträglichkeit zwar besser, die Effektivität aber nicht höher zu sein. Bei 163 HBeAg-positiven Patienten kam es während der 48-wöchigen Behandlung unter Lambda-Interferon zwar zu einem rascheren Abfall des quantitativen Hbs-Antigens, doch hatten 24 Wochen nach der Therapie nur halb so viele Patienten eine HBe-Serokonversion wie unter herkömmlichen pegyliertem Inferferon alpha (Chan HLY et al, O115).





