Kai-Henrik Peiffer und Christoph Sarrazin,
Frankfurt
Bedeutung von Polymorphismen – Q80K und andere RAV
Mit der Einführung der ersten direkt antiviralen Agenzien (DAAs) Telaprevir und Boceprevir im Jahr 2011 zur Therapie chronisch Genotyp 1 (GT1) Hepatitis C Virus (HCV) infizierter Patienten wurde eine neue Ära in der HCV Therapie begonnen 1-4. Zunehmend wurde beim Einsatz von DAAs die Präexistenz bzw. die Selektion Resistenz-assoziierter Varianten (RAVs) als bedeutender Risikofaktor für ein Therapieversagen identifiziert 5, 6. Durch die Entwicklung und Kombination weiterer DAAs verschiedener Wirkklassen (Proteaseinhibitoren, NS5A-Inhibitoren und nukleosidische und nicht-nukleosidische NS5B-Polymeraseinihibitoren) wurden in den letzten Jahren die Behandlungsmöglichkeiten auf schwierig zu behandelnde Patientenpopulationen und auf HCV Genotyp 2-6 infizierte Patienten ausgeweitet. Trotz hoher SVR-Raten durch den Einsatz verschiedener DAAs, stellen präexistente RAVs weiterhin ein Risikofaktor für ein Therapieversagen bei Interferon (IFN)-haltigen und IFN-freien Therapieregimen dar.
Q80K und Tripletherapie mit Simeprevir
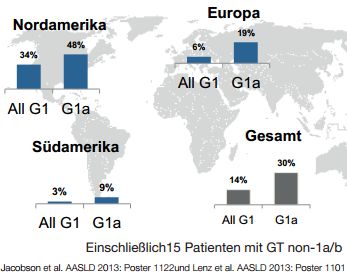 Abbildung 1: Prävalenz und geographische Verteilung der Q80K-Variante. Modifiziert nach Lenz et. al 2013
Abbildung 1: Prävalenz und geographische Verteilung der Q80K-Variante. Modifiziert nach Lenz et. al 2013
Die konventionelle Simeprevir (SMV)-basierte Tripletherapie mit PEG-Interferon und Ribavirin führte in den Zulassungsstudien zu einer signifikanten Steigerung der SVR Raten bei HCV GT1 therapienaiven und sogenannten Relapse-Patienten auf ca. 80 %. Auch Patienten, die auf eine vorangegangene IFN-basierte Therapie mit einem virologischen Nicht-Ansprechen reagierten, konnten häufig geheilt werden 7-9. Ähnliche SVR-Raten wurden bei HCV GT4-infizierten Patienten beobachtet 10. Eine Subgruppenanalyse der SMV-basierten Triple-Therapie bei europäischen therapienaiven HCV GT1 Patienten zeigt jedoch verminderte SVR-Raten für den Subtyp GT1a im Vergleich zu GT1b infizierte Patienten (79,8 % vs. 89,6 %). In der Subgruppe der Subtyp 1a-infizierten Patienten ist hier die Präexistenz der Resistenz-assoziierten Variante Q80K mit einer deutlich verminderten SVR Rate verbunden (64,3 % beim Vorliegen von Q80K vs. 82,4 % ohne Q80K). Die Heilungsraten von Subtyp 1a Patienten mit der Q80K Variante in der Triple-Therapie waren unter der Gabe von Simeprevir dabei insgesamt nicht signifikant höher als ohne Simeprevir 9. Das Vorhandensein von RAVs im Rahmen der SMV-Zulassungsstudien wurde mittels populations-basierter Sequenzierung genauer analysiert 11. Insgesamt konnten mit Ausnahme der Q80K-Variante nur wenige (1,3 %) präexistente RAVs vor Therapie gefunden werden. Die Q80K-Variante wurde dagegen in 13,7 % der HCV GT1 Patienten identifiziert und hierbei fast ausschließlich bei GT1a (GT1a 29,5 % vs. GT1b 0,5 %). Zudem zeigten sich große regionale Unterschiede in der Prävalenz der Q80K-Variante mit der größten Häufung im nordamerikanischen Raum (Abb. 1). Da die Mehrzahl der Patienten mit präexistenter Q80K-Variante im Falle des Therapieversagens zusätzliche RAVs aufwiesen (in 83,7 % der Fälle R155K), scheint die alleinige Präexistenz von Q80K nicht suffizient für ein Therapieversagen zu sein, jedoch das Aufkommen anderer RAVs zu begünstigen 12.
Q80K bei IFN-freien Regimen
Im Rahmen der COSMOS-Studie wurden HCV GT1-infizierte Patienten mit einer 12- bzw. 24-wöchigen Kombination aus SMV und dem nukleotidischen NS5B-Polymeraseinibitor Sofosbuvir (SOF) +/- Ribavirin behandelt 13. Hohe SVR-Raten (> 90 %) wurden unabhängig von der Therapiedauer und von der Zugabe von Ribavirin beobachtet. Trotz der hohen SVR-Raten insgesamt zeigte sich ein Trend für die Präexistenz der Q80K-Variante in diesem Kollektiv als Risikofaktor für ein virologisches Nichtansprechen. Während bei keinem der GT1b infizierten Patienten mit dieser Therapie ein virologisches Therapieversagen nachweisbar war, fand sich bei 4 von 6 Therapieversagern mit dem Subtyp 1a eine Q80K Variante vor Therapiebeginn. Damit lag zwar die SVR-Rate mit einer Q80K-Variante immer noch über 90 %. Die Q80K-Variante scheint jedoch das Risiko eines virologischen Rückfalls etwas zu erhöhen, was aktuell in einer großen Phase 3 Studie weiter überprüft wird.
Andere präexistente RAVs
Grundsätzlich scheinen präexistente Varianten auch bei anderen IFN-freien Therapieregimen ein Prädiktor für ein virologisches Therapieversagen darzustellen. In der kürzlich vorgestellten HALLMARK-Studie wurden insgesamt 643 HCV GT1b- infizierte therapienaive, ehemalige sogenannte Nonresponder und Patienten mit Kontraindikationen gegen Interferon, mit der dualen Kombination aus dem NS5A-Inhibitor Daclatasvir und dem Proteaseinhibitor Asunaprevir behandelt 14. Bei guter Verträglichkeit der Therapie zeigten sich hohe SVR-Raten von 82-90 %. Bei 73 Patienten konnten vor Therapiebeginn bereits resistenten Varianten gegenüber dem NS3- oder NS5A-Inhibitor nachgewiesen werden (11 %). Interessanterweise lag die SVR bei diesen 73 Patienten nur bei 38 % und damit deutlich niedriger als im Gesamtkollektiv.
Auch in den Phase-3-Studien zu der IFN-freien Kombination aus dem Ritonavir-geboosterten Proteaseinhibitor ABT-450, dem NS5-Inhibitor Ombitasvir und dem nicht-nukleosidischen NS5B-Polymeraseinhibitor Dasabuvir mit Ribavirin fanden sich sehr hohe SVR-Raten mit 92-96 % bei HCV GT1-infizierten Patienten 15-17. Patienten mit einem virologischen Nichtansprechen wiesen bei dieser Kombination in 70-100 % mindestens eine RAV gegen eines der DAAs auf. Die Korrelation von präexistenten resistenten Varianten mit dem virologischen Therapieansprechen wurden bisher leider noch nicht berichtet.
Ähnliche Erfahrungen wurden auch in den Zulassungsstudien zu der Kombination aus dem NS5A-Inihbitor Ledipasvir und Sofobuvir bei HCV GT1 infizierten Patienten gemacht. Bei insgesamt sehr hohen SVR-Raten von 94-98 % wiesen 14-18 % der Patienten präexistente RAVs gegenüber dem NS5-Inhibtor auf. Die Präexistenz dieser RAVs war mit leicht verminderten SVR-Raten von 90-96 % assoziiert 18-20.
Zusammenfassung
Mit Entwicklung und Zulassung verschiedener DAAs verbessern sich die Kombinationsmöglichkeiten zur Behandlung der chronischen HCV-Infektion entscheidend. Dabei können sehr hohe SVR-Raten (> 90-95 %) erreicht werden. Das Vorliegen von Resistenz-assoziierten Varianten (RAVs) stellt – neben anderen Prädiktoren wie einer Leberzirrhose – möglicherweise einen Risikofaktor für ein Therapieversagen dar. Die Wahrscheinlichkeit einer Präexistenz von resistenten Varianten gegenüber dem NS3 Proteaseinhibitor Simeprevir beträgt dabei bis zu 20 % bei Patienten mit HCV Subtyp 1a und liegt für die Kombinationstherapie aus einem Protease- und NS5A-Inhibitor bei 11-18 %.
Patienten mit präexistenten resistenten Varianten weisen typischerweise immer noch hohe SVR-Raten um die 90 % auf. Für die Zukunft wäre es jedoch denkbar, dass durch eine Resistenzanalyse auch minimale virologische Rückfallrisiken vermieden werden können, was bei den kostenintensiven direkt antiviralen Kombinationstherapien durchaus eine kosteneffektive Maßnahme darstellen könnte. Um hierzu entsprechende Daten zu erheben und eine optimale Therapieauswahl zu ermöglichen kann eine Resistenzanalyse im Labor der Medizinischen Klinik 1 am Frankfurter Uniklinikum kostenfrei durchgeführt werden.
- Bacon BR, Gordon SC, Lawitz E, Marcellin P, Vierling JM, Zeuzem S, et al. Boceprevir for previously treated chronic HCV genotype 1 infection. The New England journal of medicine 2011;364:1207-1217.
- Jacobson IM,
McHutchison JG, Dusheiko G, Di Bisceglie AM, Reddy KR, Bzowej NH, et al.
Telaprevir for previously
untreated chronic hepatitis C virus infection. The New England journal of medicine 2011;364:2405-2416. - Poordad F, McCone J, Jr., Bacon BR, Bruno S, Manns MP, Sulkowski MS, et al. Boceprevir for untreated chronic HCV genotype 1 infection. The New England journal of medicine 2011;364:1195-1206.
- Zeuzem S, Andreone P, Pol S, Lawitz E, Diago M, Roberts S, et al. Telaprevir for retreatment of HCV infection. The New England journal of medicine 2011;364:2417-2428.
- Barnard RJ,
Howe JA, Ogert RA, Zeuzem S, Poordad F,
Gordon SC, et al. Analysis of boceprevir resistance associated amino acid variants (RAVs) in two phase 3 boceprevir clinical studies. Virology 2013;444:329-336. - Sarrazin C, Kieffer TL, Bartels D, Hanzelka B, Muh U, Welker M, et al. Dynamic hepatitis C virus genotypic and phenotypic changes in patients treated with the protease inhibitor telaprevir. Gastroenterology 2007;132:1767-1777.
- Forns X, Lawitz E, Zeuzem S, Gane E, Bronowicki JP, Andreone P, et al. Simeprevir With Peginterferon and Ribavirin Leads to High Rates of SVR in Patients With HCV Genotype 1 Who Relapsed After Previous Therapy: A Phase 3 Trial. Gastroenterology 2014.
- Zeuzem S, Berg T, Gane E, Ferenci P, Foster GR, Fried MW, et al. Simeprevir increases rate of sustained virologic response among treatment-experienced patients with HCV genotype-1 infection: a phase IIb trial. Gastroenterology 2014;146:430-441 e436.
- Foster G,
Jacobson I, Dore G, Fried M, Manns M, Marcellin P, et al. Simeprevir (TMC435)
with Peginterferon/Ribavirin for
treatment of chronic HCV genotype 1 infection in treatment-naive European patients in the Quest 1 and 2 Phase III trials. J Hepatol 2014;60:S456. - Moreno C,
Hezode C, Marcellin P, Bourgeois S, Francque S, Samuel D, et al. Once-daily
simeprevir (TMC435) with Peg-
interferon/Ribavirin in treatment-naive or experience chronich HCV genotype 4-infected patients: fnal results of a phase III trial. J Hepatol 2014;60:S535. - Lenz O, Fevery B, Verbinnen T, Tambuyzer L, Vijgen L, Peeters M. Resistance analyses of HCV isolates from patients treated with simeprevir in phase 2b/3 studies. Hepatology 2013;58:743-744A.
- Lenz O, Verbinnen T, Fevery B, Tambuyzer L, Vijgen L,
Peeters M, et al. Virology analyses of simeprevir in phase 2b and 3 studies. J Hepatol 2014;60:S139-140. - Sulkowski M, Jacobson I, Ghalib R, Rodriguez-Torres M, Younossi Z, Corregidor A, et al. Once daily simeprevir (TMC435) plus sofosbuvir (GS7977) with or without ribavirin in HCV genotype 1 prior null responders with Metavir F0-2: COSMOS study subgroup analysis. J Hepatol 2014;60:S4.
- Manns M, Pol S, Jacobson I, Marcellin P, Gordon S, Peng C, et al. All-Oral Dual Therapy With Daclatasvir and Asunaprevir in Patients With HCV Genotype 1b Infection: Phase 3 HALLMARK-DUAL Study Results J Hepatol 2014;60:S524-525.
- Feld JJ, Kowdley KV, Coakley E, Sigal S, Nelson DR, Crawford D, et al. Treatment of HCV with ABT-450/r-ombitasvir and dasabuvir with ribavirin. The New England journal of medicine 2014;370:1594-1603.
- Poordad F, Hezode C, Trinh R, Kowdley KV, Zeuzem S, Agarwal K, et al. ABT-450/r-Ombitasvir and Dasabuvir with Ribavirin for Hepatitis C with Cirrhosis. The New England journal of medicine 2014.
- Zeuzem S,
Jacobson IM, Baykal T, Marinho RT, Poordad F, Bourliere M, et al. Retreatment
of HCV with ABT-450/r-
ombitasvir and dasabuvir with ribavirin. The New England journal of medicine 2014;370:1604-1614. - Afdhal N, Reddy KR, Nelson DR, Lawitz E, Gordon SC, Schiff E, et al. Ledipasvir and sofosbuvir for previously treated HCV genotype 1 infection. The New England journal of medicine 2014;370:1483-1493.
- Afdhal N, Zeuzem S, Kwo P, Chojkier M, Gitlin N, Puoti M, et al. Ledipasvir and Sofosbuvir for Untreated HCV Genotype 1 Infection. The New England journal of medicine 2014.
- Kowdley KV, Gordon SC, Reddy KR, Rossaro L, Bernstein DE, Lawitz E, et al. Ledipasvir and Sofosbuvir for 8 or 12 Weeks for Chronic HCV without Cirrhosis. The New England journal of medicine 2014.





