Julian
Schulze zur Wiesch und Stefan Lüth, Hamburg
Leberzirrhose – Was bringen die neuen Substanzen?
Viele unserer Patienten, insbesondere diejenigen Patienten in den Leber- und „High Volume“ HCV-Therapiezentren, haben bereits eine Leberzirrhose. Patienten mit dekompensierter Leberzirrhose werden als einzig kausale Therapie für die Lebertransplantation evauliert. Patienten mit kompensierter Leberzirrhose werden dagegen häufig auf die bevorstehende Zulassung besserer Therapieoptionen vertröstet. Doch wie gut sind die neuen Therapien bei Patienten mit Leberzirrhose und wer sollte noch mit Interferon behandelt werden?
Erste Tripletherapien
HCC-Risiko bleibt
Eine erfolgreiche HCV-Therapie kann die Entwicklung einer Leberzirrhose verhindern und zu einer Stabilisierung der Leberzirrhose führen. Dies verringert die Mortalität, verzögert die Lebertransplantation. Es kommt seltener zur hepatischen Dekompensation oder dem Auftreten eines Diabetes mellitus bei Patienten mit fortgeschrittenem Leberschaden. Die Gefahr eines hepatozellulären Karzinoms (HCC) ist durch die Heilung der Hepatitis C allerdings nicht gebannt. So entwickelten in einer aktuellen paneuropäischen Kohortenanalye mit 1000 longitudinal nachverfolgten geheilten HCV-Patienten mit fortgeschrittener Zirrhose insgesamt 8,5% der Patienten innerhalb von acht Jahren ein HCC. In der Gruppe der älteren Patienten waren es sogar 12,2% (Abb. 1). Ähnlich hohe HCC-Raten (bzw. sogar höhere Raten bei Patienten mit dekompensierter Zirrhose) wurden auch bei Patienten mit Nukleos(t)idanaloga behandelter HBV-Infektion beobachtet. Regelmäßige Screening-Untersuchungen auch nach Heilung sind daher dringend inzidiziert.
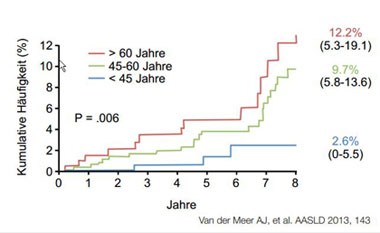
Abbildung 1: 1 HCC-Entwicklung bei Zirrhotikern nach SVR im Abhängigkeit vom Alter.
Die Erfahrungen mit der HCV-Tripletherapie mit Boceprevir oder Telaprevir bei fortgeschrittener Lebererkrankung zeigen, dass eine Therapie grundsätzlich möglich ist, die SVR-Raten jedoch deutlich niedriger liegen, insbesondere bei vorherigen Non-Respondern. Zudem muss mit dem gehäuften Auftreten von schweren Nebenwirkungen gerechnet werden, bis hin zu fatalen Ausgängen. Prädiktoren für Komplikationen waren Zeichen der hepatischen Dekompensation und portalen Hypertension, ein niedriges Albumin <35 g/dl, Thrombozytenzahlen <90.000/µl und schlecht eingestellter Diabetes (8,9). Die Patienten sollten daher gut vorbereitet über die Risiken einer Therapie aufgeklärt und gegebenenfalls in einem Transplantationszentrum vorgestellt werden. Die Gabe von Thrombopoetin, das kürzlich unter dem Handelsnamen Eltrombopag® zugelassen wurde, kann in wenigen Einzelfällen Sinn machen (unter engmaschiger Kontrolle des Pfortaderflusses), aber nicht generell empfohlen werden.
Dünne Daten bei Zirrhose
In Lauf des Jahres 2014 werden mehrere neue Therapieoptionen mit/ohne Interferon zur Verfügung stehen. In die Zulassungsstudien der neuen direkt antiviralen Substanzen wurden auch Patienten mit Leberzirrhose eingeschlossen, allerdings in geringer Zahl, in wenig fortgeschrittenen Stadien und mit unterschiedlichen Kriterien, so dass wirklich zuverlässige Aussagen kaum möglich sind. Dennoch muss man angesichts der dringlichen Therapieindikation bei Zirrhose diese Daten für Therapieentscheidungen heranziehen.
Genotyp 2/3
In den USA wurde Sofosbuvir für Patienten mit Genotyp 2 und 3 ohne Interferon in Kombination mit Ribavirin zugelassen. In den Zulassungsstudien FISSION (n=499) hatten 20%, in POSITRON (n=278) 15% und in FUSION (n=201) 34% der Patienten eine Zirrhose. Ausgeschlossen waren die Patienten mit fortgeschrittener Zirrhose, d.h. einer Dekompensation in der Anamnese, Kreatinin ≥ 1,5 ULN, Albumin ≤3.2 g/dl, Thrombozyten ≤ 75.000/µl.
Insgesamt war das Ergebnis von 12 Wochen Sofosbuvir/Ribavirin bei therapienaiven Zirrhotikern mit GT2 genauso gut wie bei den naiven Patienten ohne Zirrhose. Die SVR-Raten lagen durchgehend über 90%. Zu den vorbehandelten Zirrhotiker liegen dagegen widersprüchliche Daten vor. Während in FUSION mit einer SVR-Rate von 60% (6/10) die die Gruppe der Zirrhotiker schlechter abschnitt, wurden in VALENCE mit dem gleichen Regime 88% (7/8) geheilt. In LONESTAR 2 führte eine Sofosbuvir-basierte Tripletherapie über 12 Wochen bei 13/14 Patienten zur SVR.
Problem GT3
Patienten mit Gentotyp 3 und insbesondere Zirrhotiker mit Genotyp 3 sind schwerer zu behandeln, als man ursprünglich dachte. In FISSION hatten 30%, in POSITRON 21% der Genotyp 3-Patienten eine Zirrhose. In FUSION war die Lebererkrankung bei 19% der 12 Wochen lang Behandelten und bei 61% der 16 Wochen lang Behandelten fortgeschritten. Hier waren 12 Wochen Sofosbuvir/Ribavirin 12 Wochen eindeutig zu kurz. Daher lautet auch die amerikanische Empfehlung, Patienten mit Genotyp 3 24 Wochen lang zu behandeln. Bei den vorbehandelten Zirrhotikern hat diese Verlängerung jedoch „nur“ zu einer Steigerung der SVR-Rate auf 60% (27/45) geführt. Die Sofosbuvir-basierte Tripletherapie über 12 Wochen wie in LONESTAR 2 scheint hier möglicherweise eine bessere SVR-Chance zu bieten (83%; 10/12), allerdings mit den Nachteilen von Interferon.
GT4
Unklar bleibt, wie wir unsere Patienten mit einer GT4 Infektion in Zukunft behandeln sollen. Auf der AASLD wurden zusätzliche, vielversprechende Daten zu einer aktuell durchgeführten Interferon-freien Therapie mit Sofosbuvir/Ribavirin für 12/24 Wochen bei Genotyp 4 (Ruane et al. A1090) mit einer SVR12-Rate von 79% im 12-Wochen-Arm präsentiert. Allerdings bleibt anzunehmen, dass Patienten mit Leberzirrhose höhere SVR-Raten unter der Sofosbuvir-basierten Tripletherapie für 12 Wochen erreichen könnten.
GT1
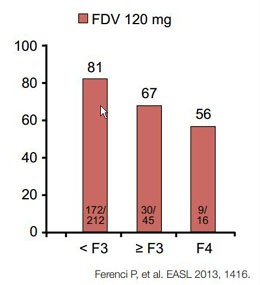
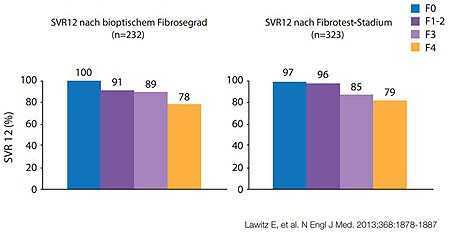 Abbildung2:NEUTRINO. Sofosbuvir/PEG-Interferon/Ribavirin über 12 Wochen bei GT 1,4,5 und 6. SVR12 in Abhängigkeit vom Fibrosegrad.
Abbildung2:NEUTRINO. Sofosbuvir/PEG-Interferon/Ribavirin über 12 Wochen bei GT 1,4,5 und 6. SVR12 in Abhängigkeit vom Fibrosegrad.
Für den Gentoyp 1 werden in absehbarer Zeit Sofosbuvir, Simeprevir
und Fald-
aprevir (möglichweise auch Daclatasvir) zur Verfügung stehen. Zugelassen werden
zunächst nur Interferon-basierte Kombinationen (Ausnahme: Sofosbuvir/Ribavirin bei Interferon-Unverträglichkeit), wobei
all diese Regime bei vorbehandelten Zirrhotikern schlechter abschneiden als bei
Patienten ohne Leberschaden. Einen relativ geringen negativen Einfluss schien
die Zirrhose in NEUTRINO zu haben. Hier erreichten von den therapienaiven Zirrhotikern
nach einer 12-wöchigien Sofosbuvir-basierten Tripletherapie 80% (43/54) die SVR
im Vergleich zu 92% ohne Zirrhose. Bei genauer Analyse zeigt sich jedoch auch
hier eine Verschlechterung des Ansprechens in Abhängigkeit vom Fibrosegrad
(Abb. 2).
Die in der amerikanischen Zulassung mögliche Option, Sofosbuvir/Ribavirin ohne Interferon bei GT 1 Patienten mit Interferon-Unverträglichkeit einzusetzen, geht auf die Daten der PHOTON-Studien an HIV/HCV-Koinfizierten zurück. In dieser Untersuchung erreichten insgesamt 76% der GT1-Patienten die SVR, und zwar 82% bei GT1a, 54% bei GT1b und 75% bei IL28B-non cc. Nur 4% (n=5) der therapienaiven Patienten in PHOTON hatten eine Zirrhose und dies war ein negativer Prädiktor.
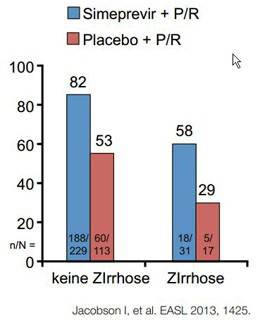
Neue Proteasehemmer
Simperevir und Faldaprevir, beides Proteasehemmer der zweiten
Generation, wurden in Response-gesteuerten Therapie-algorithmen geprüft, wobei
die große Mehrzahl der Patienten die Therapie auf 12 Wochen Tripletherapie
gefolgt von 12 Wochen dualer Behandlung verkürzen konnte. Insgesamt führten die
Proteasehemmer ähnlich wie die Vorgänger Boceprevir und Telaprevir bei
therapienaiven Patienten zu einer Verbesserung der SVR gegenüber der dualen
Therapie um rund 30% (schlechter bei Simeprevir und Q80K-Polymorphismus). Erneut
sprachen sowohl die therapienaiven und insbesondere auch die vorbehandelten
Zirrhotiker schlechter an (Abb. 3a und b). Ein Lichtblick ist hier die im
Vergleich zu den ersten Proteasehemmern deutlich bessere Verträglichkeit der
Proteaseinhibitoren der zweiten Generation.
|
|
Off-Label-Optionen
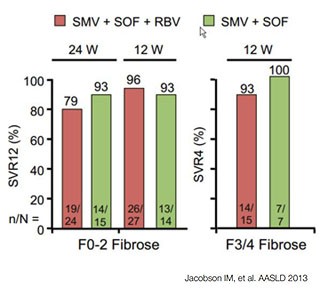 Abbildung 4:COSMOS. Simeprevir und Sofosbuvir mit/ohne Ribavirin bei Nullrespondern mit und ohne Fibrose.
Abbildung 4:COSMOS. Simeprevir und Sofosbuvir mit/ohne Ribavirin bei Nullrespondern mit und ohne Fibrose.
Bei diesen schwierig zu behandelnden Patienten mit GT1 stellt sich die brennende Frage nach sogenannten Off-Label-Therapien, zu denen schon vielversprechende Daten vorliegen. In der COSMOS-Studie konnten mit 12 Wochen Sofosbuvir plus Simeprevir selbst bei früheren Nullrespondern mit fortgeschrittener Fibrose bei über 90% eine SVR4 erreicht werden (Abb. 4). Eine weitere Option ist die Kombination von Sofosbuvir mit Daclatasvir, einem NS5A-Inhibitor, der derzeit nur für den „Compassionate Use“ erhältlich ist, aber möglicherweise doch noch in diesem Jahr in Europa auf dem Markt kommt. Eine kleine Studie an Tripletherapieversagern hat unter einer 24-wöchigen Behandlung mit dieser Kombination eine SVR-Rate über 90% ergeben (Abb. 5).
In der Pipeline
Sofosbuvir mit Ledipasvir als NS5A-Inhibitor ist derzeit als Fixkombination in der Entwicklung und wird vermutlich
im Lauf 2015 zur Verfügung stehen. Die bisherigen SVR-Raten sehen
vielversprechend aus. In LONESTAR und ELECTRON wurden mit dieser Kombination
über 90% der Patienten geheilt (auch Patienten nach Tripletherapieversagen).
Bei besonderen Populationen wie Zirrhotikern deuten die Daten allerdings darauf
hin, dass nicht kürzer als 12 Wochen und ggf. mit Ribavirin oder einem weiteren
DAA behandelt werden sollte. Eine weitere interessante Kombination ist
Daclatasvir (NS5A Inhibitor)/Asunaprevir (NS3-Proteaseinhibitor). In einer
japanischen Studie erreichten hier über 85% der Patienten eine SVR und auch
Zirrhotiker und Ältere sprachen gut an. Zudem werden noch viele weitere
DAA-Kombinationen entwickelt, die durchwegs sehr gute Zwischenergebnisse
zeigen.
LeberTransplantation
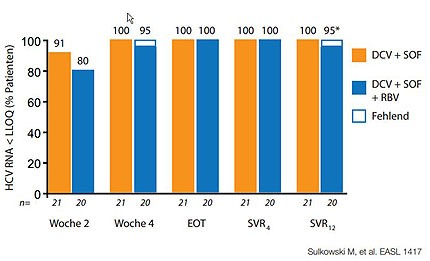 Abbildung 5:Sofosbuvir plus Daclatasvir bei Tripletherapieversagern.
Abbildung 5:Sofosbuvir plus Daclatasvir bei Tripletherapieversagern.
Für Patienten auf der Transplantationsliste gibt es entscheidende Fortschritte. In einer offenen Phase 2-Studie wurden wegen eines HCC zur Transplantation (LTX) gelistete Patienten mit HCV verschiedener Genotypen bis zu 48 Wochen mit Sofosbuvir/Ribavirin behandelt. 23/37 (62%) Patienten, die bei Transplantation HCV-RNA-negativ waren, erreichten die SVR12. Hier gilt es zu beachten, dass bei keinem der behandelten Patienten eine dekompensierte Zirrhose vorlag.
Patienten mit Post-Transplantations-hepatitis scheinen ebenfalls
von der Behandlung mit Sofosbuvir/Ribavirin mit/ohne PEG-Interferon zu profitieren.
Im Compassionate Use-Program in den USA wurden 42 Patienten und in einer
weiteren Studie 40 Patienten mit Rezidiv-Hepatitis behandelt. Bis zu 70% der
Patienten hatte eine SVR4. Die zusätzliche Gabe von PEG-Interferon hatte in
dieser kleinen Untersuchung keinen zusätzlichen Effekt (Abb. 6 a und b).
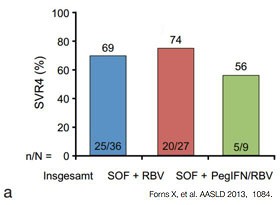 | 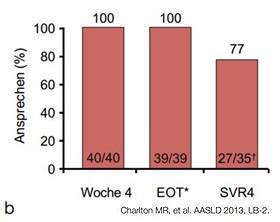 |
Abbildung 6a und b:Sofosbuvir + RBV ± PegIFN bei Post-Transplantationshepatitis. a. Compassionate Use-Programm. SVR4-Ergebnisse b. Offene Pilotstudie. SVR4-Ergebnisse.
Fazit
Die Anzahl der laufenden Studien ist groß und die Aussichten auch für schwer zu behandelnde Patienten sehr gut. Wer warten kann, sollte warten. Die Therapien werden effektiver und kürzer. Und die Verträglichkeit scheint kein Problem zu schein.
Bei Zirrhotikern kann man nur selten warten. Hier muss man entscheiden, ob man die verfügbaren Substanzen im Rahmen der Zulassung einsetzt oder „Off-Label“ behandelt. Letztes birgt die Gefahr eines angesichts der Kosten der neuen Medikamente nicht unerheblichen Regresses. Es bleibt in diesen Fällen somit nur der Antrag bei der Krankenkasse oder der Antrag auf Compassionate Use (z.B. von Daclatasvir). Solche Ausnahmen sind insbesondere zu erwägen bei den vorbehandelten GT 1- und GT 3-Patienten mit fortgeschrittener Zirrhose. Abgesehen von diesen Ausnahmen wird Interferon für viele Patienten mit Leberzirrhose zunächst ein Bestandteil der Therapie bleiben. Für die Zukunft bleibt zu hoffen, dass in die Studien mit den neuen DAA vermehrt Problempopulationen wie Patienten mit Leberzirrhose eingeschlossen werden.