Jörg
Petersen, Hamburg
Isolierung eines funktionellen
Rezeptors für Hepatitis B und Hepatitis D
Die zufällige Entdeckung des Hepatitis B-Virus liegt mittlerweile über 45 Jahre zurück, doch bis heute gibt es kein In Vitro-Modell, das den viralen Replikationszyklus abbildet. Mit der Identifikation eines Entry-Rezeptors ist man diesem Ziel einen Schritt näher gekommen und hat möglicherweise auch einen neuen Therapieansatz gefunden.
Der Replikationszyklus des kompletten Hepatitis B-Virus (HBV) konnte in den letzten Jahrzehnten zum großen Teil entschlüsselt werden. Es fehlte jedoch bis vor kurzem noch ein entscheidender Baustein für die Komplettierung der Rezeptor-vermittelte Endozytose, den Eintritt von infektiösen Virionen in den Hepatozyten. Mit den 2012 und 2013 erschienen Arbeiten einer chinesischen Arbeitsgruppe der National Institutes of Biological Sciences in Peking mit Identifizierung eines Rezeptors scheint nun dieser Baustein gefunden worden zu sein1,2.
Infektionsmodelle
Hepatitis B Viren können nach DNA-Transfektion in verschiedenen Hepatoma-Zelllinien exprimiert werden, aber in vivo sind lediglich primäre humane Hepatozyten, Tupaia-Hepatozyten und eine Leberprogenitorzelllinie, die HepaRG Zellen, infizierbar (Abb. 1 und 2) (Review in 3). Die Wirtsfaktoren, die an den ersten Schritten der Infektion beteiligt sind, sind allerdings trotz der großen Fortschritte in der molekularen Charakterisierung der HBV-Replikation und der viralen Morphogenese immer noch weitgehend unverstanden. So konnten bislang keine aussagefähigen und robusten In Vitro-Modelle etabliert werden, die den kompletten viralen Replikationszyklus aufzeigen.
Mit dem humanen HBV verwandte Hepadnaviren (hepatotrope DNA-Viren) von Woodchuck und Ente konnten zwar als Interaktionsmodelle für Virus-Wirt-interaktionen genutzt werden, da sie einige funktionelle und strukturelle Ähnlichkeiten mit dem humanen Hepatitis B-Virus aufweisen, aber funktionelle Daten suggerieren, dass entscheidende Schritte des Zelleintritts differieren. Auch zelluläre Rezeptoren für das Entenmodell konnten für HBV nicht nachvollzogen werden (Review in 4). Warum blieb der Rezeptor für Hepatitis B und Hepatitis D so lange unbekannt? Sicherlich spielten hier die hohe virale Spezies-Spezifität sowie der ausgeprägte Lebertropismus von HBV eine entscheidende Rolle.
 Abbildung 1: Tupaia belangeri | 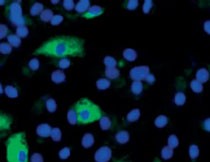 Abbildung 2a: HepG2 Zellen infiziert mit Hepatitis B Viren |  Abbildung 2b: Huh/ Zellen infiziert mit Hepatitis D Viren |
Eintritt in die Zelle
Das Hepatitis B-Virus enthält DNA und Polymerase in einem viralen Kapsid des Core-Proteins. Diese zentrale Region ist umgeben von einem Envelope-Protein, das ein großes (L), mittleres (M), und kleines (S) Envelope-Protein enthält (oben rechts, M und S nicht gezeigt). Das Virus bindet an einen Rezeptor an der Oberfläche von Hepatozyten mit Hilfe der präS1-Domäne des L-Proteins. Yan und Zhong und Kollegen konnten nun zeigen, dass ein Protein mit Namen NTCP einen funktionellen Rezeptor für HBV und HDV darstellt. Nach Eintritt des Virus in die Zelle wird die DNA auf noch wenig bekannte Art in den Nukleus von Hepatozyten transportiert, wo diese DNA in eine covalently closed circular (ccc) DNA konvertiert wird. Diese DNA stellt dann die Matrize zur Produktion genomischer und subgenomischer RNA dar, die wiederum für die drei Envelope-Proteine kodiert. Diese Proteine werden im endoplasmatischen Retikulum (ER) synthetisiert, wie auch die prägenomische RNA, die für Coreprotein und Polymerase kodiert. Der Komplex von prägenmischer RNA und Polymerase bildet zusammen mit dem Coreprotein das virale Kapsid, die Polymerase konvertiert die prägenomische RNA in virale genomische DNA, bevor das Kapsid, mit viralen Envelopeproteinen versehen, aus dem Hepatozyten ausgeschleust wird.
Es ist seit längerem bekannt, dass die präS1-Domäne des großen (L) HBs-Antigens eine essentielle Rolle für den Viruseintritt spielt. Interessanterweise konnte ein Peptid vom präS1-Protein die HBV-Infektion in humanen Hepatozyten und chimären uPA/SCID-Mäusen inhibieren5,6. Auch HDV nutzt die HBV-Hüllmembran über vermutlich ähnliche Eintrittswege. In den letzten Jahren sind mehrere Arbeiten erschienen, die vermuten lassen, dass die HBV-Bindung an Hepatozyten über Proteoglykane des Heparanssulfats vermittelt wird7,8. Verschiedene Oberflächenproteine sind in der Vergangenheit als mögliche Interaktionspartner für das HBV S-Protein beschrieben worden, ohne dass sich daraus ein einziger essentieller Faktor nachweisen ließ4.
Chinesische Arbeitsgruppe
Eine kürzlich erschienene Arbeit aus den National Institutes of Biological Sciences in Peking, China, durch Yan und Zhong und Kollegen1 konnte einen neuen Rezeptor für Hepatitis B und Hepatitis D beschreiben und charakterisieren. Basierend auf früheren Studien der Arbeitsgruppe von Urban et al9 konnten die Pekinger mit Hilfe von „Photo Cross Linking Assays“ und durch die Nutzung synthetischer präS1-Peptide zuerst in Tupaia-Hepatozyten und dann in humanen Hepatozyten mögliche am Entry beteiligte Faktoren untersuchen. Massenspektrometrische Untersuchungen wurden mit einer Tupaia-Protein-Datenbasis, die per „Deep Sequencing“ des Tupaia-Transkriptoms erarbeitet wurde, verglichen. So gelang es den Autoren der Studie, Sodium Taurocholate Cotransporting-Polypeptide oder NTCP (bereits bekannt unter dem Kürzel SLC10A1) als ein Hepatozyten-Oberflächenmolekül zu identifizieren, das mit einer Domäne von präS1 innerhalb des L-Proteins bindet.
NTCP als Rezeptor
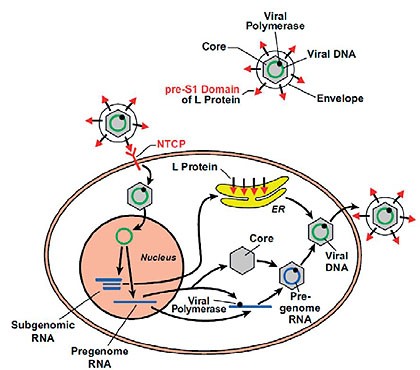 Abbildung 3:Die Rolle von NTCP im Replikationszyklus von HBV.
Abbildung 3:Die Rolle von NTCP im Replikationszyklus von HBV.
NTCP stellt einen bekannten Gallensäurentransporter dar, der in der sinusoidalen (basolateralen) Hepatozytenmembran lokalisiert ist (Abb. 3). Die Fähigkeit von NTCP zur Bindung an HBV-präS1 konnte zunächst durch Untersuchungen an NTCP-transfizierten 293T-Zellen bestätigt werden. Weiterhin konnte durch Silencing der NTCP-Expression in primären Tupaia-Hepatozyten, HepaRG-Zellen oder auch in primären humanen Hepatozyten eine ausgeprägte Reduktion der HBV- oder HDV-Infektion beobachtet werden. Die NTCP-Expression in nichtpermissiven HepG2-Zellen oder HuH7-Hepatomazellen wiederum machte diese Zellen erstmalig permissiv für HBV- und HDV-Infektionen. Schließlich kombinierte die Gruppe phylogenetische Analysen mit Mutagenesestudien, um eine mutmaßliche Rolle einer bestimmten Aminosäuregruppe des NTCPs (aa157-165) für die virale Infektion aufzuzeigen. So konnte der Ersatz dieser neun Aminosäuren von Affen-NTCP durch das humane Homolog dann auch Affen-Hepatozyten permissiv für HBV und HDV machen, die zuvor nicht permissiv waren.
Zelluläre Rezeptorproteine können auf verschiedene Weisen (Attachment, Post-Binding Transport und Fusion) den viralen Eintritt vermitteln. Die NTCP-Expression wird durch bekannte Signalwege wie den Glukokorticoidrezeptor, den retinoic acid receptor und hepatische nukleäre Transkriptionsfaktoren HNF1a, HNF4a, und HNF3b reguliert10.
Offene Fragen
Bislang konnten mit der Isolierung von NTCP noch nicht alle Fragen zur Internalisation von HBV und HDV von den Autoren beantwortet werden. So zeigte sich, dass Silencing von NTCP nicht zu einer kompletten Ablation einer HBV-Infektion führte und die HBV-Replikation in HepG2-NTCP-Zellen nur von relativ niedriger Ausprägung war, so dass vermutet werden darf, dass neben NTCP noch weitere Faktoren eine Rolle spielen könnten (persönliche Mitteilung Dr. Charles Rice, MolBio HBV Meeting Shanghai, Oktober 2013). Allerdings konnte die chinesische Gruppe mit Hilfe weiterer analoger Experimente in Woolly Monkey-Hepatozyten, einem weiteren verwandten Primatenvirus des humanen HBV, kürzlich zeigen2, dass NTCP und seine Orthologa vermutlich für alle bekannten Hepadanviren von Primaten als der entscheidende Rezeptor agiert. Ein noch ausstehendes Experiment müsste allerdings auch noch zeigen, dass durch neutralisierende Antikörper gegen NTCP eine Infektion mit HBV und HDV in vivo, z.B. in Schimpansen, verhindert werden könnte.
Ausblick
Aktuelle Therapieregime gegen die chronische Hepatitis B sind durch den oralen Einsatz hochpotenter Polymerasehemmer wie Tenofovir und Entecavir relativ einfach und sehr sicher geworden, stellen aber zumeist Dauertherapien mit Adhärenznotwendigkeit und bislang noch nicht abschätzbaren Langzeitfolgen dar. Pegyliertes Interferon kann in einer kleinen Anzahl gut definierter Patienten bei etwa einem Drittel der Behandelten zu einem HBsAg-Verlust führen, hat aber durch parenterale Verabreichung und Nebenwirkungen in der Therapie nachrangigen Charakter. Diese Therapien ermöglichen eine Kontrolle der Virusreplikation und auch eine histologische Verbesserung im Langzeitverlauf. Eine Eradikation des Hepatitis B- bzw. Hepatitis D-Virus – ähnlich der Eradikation des Hepatitis C-Virus – ist jedoch nicht erreichbar. Durch die Isolierung von NTCP und seine Charakterisierung als vermutlich entscheidender Rezeptor für HBV und HDV wird es nunmehr möglich werden, NTCP oder seine regulierenden Faktoren als mögliches antivirales Ziel zu untersuchen.
Fazit
Die Arbeiten von Yan und Zhong et al1,2 liefern einen entscheidenden Schritt vorwärts in unserem Verständnis des Eintritts infektiöser HBV-Partikel in Hepatozyten und erlauben die Suche nach antiviralen Substanzen mit neuem Wirkmechanismus, die sich dann vermutlich mit den bisherigen Polymerasehemmern und immunmodulatorischen Agentien kombinieren lassen.
1. Huan Yan,
Guocai Zhong, Guangwei Xu, Wenhui He, Zhiyi Jing, Zhenchao Gao, Yi, Huang, Yonghe
Qi, Bo Peng, Haimin Wang, Liran Fu, Mei Song, Pan Chen, Wenqing Gao, Bijie Ren,
Yinyan Sun, Tao Cai, Xiaofeng Feng, Jianhua Sui, Wenhui Li. Sodium taurocholate cotransporting polypeptide
is a functional receptor for human hepatitis B and D virus.
eLife 2012, 1:e00049. doi: 10.7554/eLife.00049. Epub Nov. 13.
2. Guocai Zhong , Huan Yan, Haiming Wang , Wenhui He, Zhiyi Jing, Yonghe Qi, Liran Fu, Zhenchao Gao, Yi Huang, Guangwei Xu, Xiaofeng Feng, Jianhua Sui , Wenhui Li. Sodium taurocholate cotransporting polypeptide mediates woolly monkey Hepatitis B-Virus infection of Tupaia hepatocytes. J. Virol. doi:10.1128/JVI.03533-12. Epub 17 April 2013.
3. Dandri M, Lütgehetmann M, Petersen J. Semin Immunopathol. 2013 Jan;35(1):7-21. doi: 10.1007/s00281-012-0335-7. Epub 2012 Aug 17.
4. Glebe D, Urban S. Viral and cellular determinants involved in hepadnaviral entry. World J Gastroenterol 2007;13:22–38.
5. Meier A, Mehrle S, Weiss TS, Mier W, Urban S.
The myristoylated preS1-
domain of the Hepatitis B-Virus L-protein
mediates specific binding to differentiated hepatocytes. Hepatology
2012. http://dx.doi.org/10.1002/ hep.26181.
6. Petersen J, Dandri M, Mier W, Lutgehetmann M, Volz T, von Weizsacker F, et al. Prevention of Hepatitis B-Virus infection in vivo by entry inhibitors derived from the large Envelope-Protein. Nat Biotechnol 2008;26:335–341.
7. Leistner CM, Gruen-Bernhard S, Glebe D. Role of glycosaminoglycans for binding and infection of Hepatitis B-Virus . Cell Microbiol 2008;10:122–133.
8. Sureau C, Salisse J. A conformational heparan sulfate-binding site essential to infectivity overlaps with the conserved Hepatitis B-Virus a-determinant. Hepatology 2012. http://dx.doi.org/10.1002/hep.26125.
9. Schulze A, Schieck A, Ni Y, Mier W, Urban S. Fine mapping of pre-S sequence requirements for Hepatitis B-Virus large Envelope-Protein-mediated receptor interaction. J Virol 2010;84:1989–2000.
10. Geyer J, Wilke T, Petzinger E. The solute carrier family SLC10: more than a family of bile acid transporters regarding function and phylogenetic relationships. Naunyn Schmiedebergs Arch Pharmacol 2006;372:413–431.





