Kai-Henrik
Peiffer und Christoph Sarrazin, Frankfurt
Re-Therapie nach
Tripleversagen, was ist zu beachten?
Mit der Einführung der beiden Proteaseinhibitoren Telaprevir (TVR) und Boceprevir (BOC) in Deutschland und vielen anderen Ländern der Welt konnte das anhaltende virologische Ansprechen (SVR) auf eine HCV spezifische Therapie von sowohl therapienaiven als auch vortherapierten HCV Genotyp 1 infizierten Patienten signifikant verbessert werden 1-4. Die Ansprechrate bei therapienaiven Patienten wurde von 38-44 % auf 66-75 % erhöht 2, 3. Während ehemalige Relapse-Patienten auf eine vorangegangene duale Therapie (PegIFN/RBV) mit einer Tripletherapie ebenfalls hohe SVR- Raten erreichen (69-75 % für BOC- und 83-88 % für die TVR-basierte Tripletherapie), ist die Ansprechrate von ehemaligen sogenannten Nonrespondern deutlich geringer 1, 4. Partielle Nonresponder erreichen einen SVR in 40-52 % mit BOC- und in 54-59 % der Fälle mit TVR-basierter Tripletherapie. Bei sogenannten Nullrespondern wird jedoch lediglich in 29-33 % der Fälle mit TVR- und in 38 % der Fälle mit BOC-basierter Tripletherapie das Virus eradiziert 1, 4, 5. Erste größere Studien aus Deutschland zeigen, dass die Ansprechraten unter Therapie außerhalb von Studien den Zulassungsdaten in etwa entsprechen 6. Folglich gibt es weiterhin eine große Gruppe HCV Genotyp 1 infizierter Patienten, für die die Tripletherapie nicht zum Erfolg führt.
Resistente Varianten
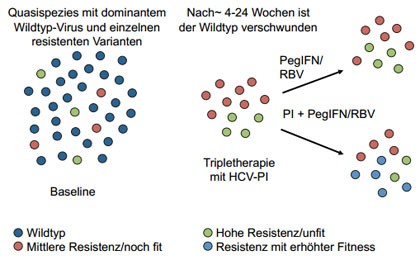 Abbildung 1: Entstehung resistenter Varianten.
Abbildung 1: Entstehung resistenter Varianten.
Im Falle eines Therapieversagens kommt es in den meisten Fällen zu einer Selektion von Resistenz-assoziierten Varianten (RAVs) 7, 8 (Abb. 1). Da sich das Resistenzprofil von TVR und BOC fast vollständig überlappt, ist eine unmittelbare Re-Therapie mit dem jeweils anderen Proteaseinhibitor bei virologischem Therapieversagen nicht möglich (Tab. 1 und 2) 9. Für zukünftige Therapieoptionen müssen daher drei Fragen beantwortet werden:
Kommt es zu einer Persistenz von Varianten, die mit einer Resistenz gegenüber TVR und BOC assoziiert sind?
Ist eine Re-Therapie mit einem Proteaseinhibitor später möglich?
Ist eine Re-Therapie mit
einem direkt antiviralen Agens (DAA) einer anderen Substanzklasse mit einem
unterschiedlichen pharmakologischen Angriffspunkt möglich?
| Typ | Medikament | V36A/M | T54/S/A | V55A | Q80R/K | R155K/ T/Q | A156S | A156T/V | D168A/ E/G/H/ T/Y | V170A/T |
|---|---|---|---|---|---|---|---|---|---|---|
| Linear | Telaprevir | |||||||||
| Linear | Boceprevir | |||||||||
| Makrozyklisch | Simeprevir | |||||||||
| Linear | Faldaprevir |
Tabelle 1: Resistenzprofile von NS3/4A-Protease Inhibitoren erster Generation.
| Resistenzen vor Therapie (in %) | Resistenzen bei Therapieversagen (in %) | Mittlere Zeitdauer bis Wildtyp (in Monaten) | ||||
|---|---|---|---|---|---|---|
| HCV Subtyp 1a | HCV Subtyp 1b | HCV Subtyp 1a | HCV Subtyp 1b | HCV Subtyp 1a | HCV Subtyp 1b | |
| Telaprevir | 8 | 4 | 55 | 47 | 14,0 | 12,5 |
| Boceprevir | 6 | 4 | 86 | 56 | 10,6 | 0,9 |
Tabelle 2: Vorkommen von mit Therapieversagen assoziierten Resistenzen (RAVs) vor und nach Telaprevir/Boceprevir-basierter Tripletherapie
Persistenz von Resistenzen
Das Versagen auf eine Tripletherapie ist mit der Selektion von
Resistenzen (RAVs) assoziiert. Bei Patienten, die in den Phase 2/3 Studien auf
eine TVR- oder BOC-basierte Tripletherapie mit einem virologischen
Nichtansprechen reagiert hatten, konnten zu Therapieende in 77 % beziehungsweise
53 % der
Fälle RAVs nachgewiesen werden 7, 10. Während bei einer TVR-basierten Tripletherapie RAVs deutlicher
häufiger beim HCV Subtyp 1a im Vergleich zu 1b auftreten (86 % vs. 56 %), ist
dieser Unterschied bei einer BOC-basierten Tripletherapie weniger stark
ausgeprägt (55 % vs. 47 %).
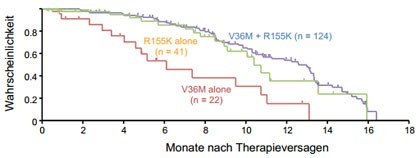 Abbildung 2: .Abnahme von resistenten Viren nach Ende einer Telaprevir-basierten Tripletherapie. Varianten mit mehreren Mutationen verschwinden langsamer.
Abbildung 2: .Abnahme von resistenten Viren nach Ende einer Telaprevir-basierten Tripletherapie. Varianten mit mehreren Mutationen verschwinden langsamer.
Aufgrund einer verminderten viralen Fitness der resistenten
Varianten werden diese nach Therapieende langsam wieder durch Wildtyp-Virus
ersetzt. Nach einer TVR-basierten Tripletherapie dauert es im Mittel 10,6
Monate für HCV Genotyp 1a und 0,9 Monate für HCV Genotyp
1b infizierte Patienten, bis diese Varianten nicht mehr nachweisbar sind 10 (Abb. 2). Nach BOC-basierter Tripletherapie waren nach 6-14
Monaten noch bei 22,8 % der Patienten RAVs
nachweisbar 7. In einer aktuellen
Studie, die dieses Jahr auf der AASLD vorgestellt wurde, wird die genaue
Zeitdauer bis zur Nichtnachweisbarkeit von RAVs nach BOC-basierter
Tripletherapie auf im Durchschnitt 1,11 Jahre berechnet, wobei kein Unterschied
in den beiden HCV Genotyp 1 Subtypen beobachtet wurde 11. In den genannten Studien
wurden die Mutanten durch eine sog. Populations-basierte Sequenzierung
detektiert. Da diese Methode einzelne Varianten nur erfasst, wenn sie einen
Anteil von mindestens 20 % der HCV Quasispezies
stellen, kann ein persistierendes Vorkommen der resistenten Varianten in
geringerer Konzentration nicht ausgeschlossen werden. Nach einer Monotherapie
mit TVR bzw. BOC konnten durch eine sog. klonale Sequenzierung mit einer
Nachweisgrenze von 5-10 % auch 4,2 Jahre nach
Therapieende bei 2 von 14 (TVR) bzw. 4 von 14 (BOC) Patienten noch resistente
Mutanten nachgewiesen werden 12. Auch in einer jüngst präsentierten 3-Jahres
Nachbeobachtungsstudie nach TVR-basierter Tripletherapie konnten durch eine
sog. tiefe Sequenzierung, bei der Varianten mit einer Frequenz von 0,5-1 % erfasst
werden, bei 11 % der Patienten noch RAVs detektiert, die mittels
populations-basierter Sequenzierung nicht erfasst wurden 13.
Ist eine Re-Therapie mit einem Proteaseinhibitor möglich?
Da es nur wenige Studien gibt, bei denen eine Re-Therapie nach Exposition mit einem Proteaseinhibitor durchgeführt wurde, lässt sich die Frage nicht eindeutig beantworten. In der C219-Studie wurden 9 Patienten, die zuvor eine 14-tägige TVR-Monotherapie erhalten hatten, ca. 6 Jahre später mit einer vollständigen TVR-basierten Tripletherapie behandelt 14. Vor Re-Therapie konnten mittels Populations-basierter Sequenzierung die nach der Monotherapie nachweisbaren RAVs nicht mehr nachgewiesen werden. Die SVR-Rate für die Re-Therapie lag in diesem kleinen Kollektiv bei 56 %. Die Patienten, die keine SVR erreichten, waren zu Therapieende erneut positiv für die gleichen RAVs, die auch nach der vorangegangenen Monotherapie nachgewiesen werden konnten. Ob es sich dabei auch um dieselben Virusisolate handelt, wird aktuell in aufwendigen tiefen Sequenzierungsanalysen geklärt. Ähnliche Erfahrungen wurden mit einer Simeprevir-basierten Tripletherapie nach vorangegangener Monotherapie gemacht 15. Drei von 5 Patienten erreichten einen SVR, wobei erneut dieselben RAVs bei den Therapieversagern zum Ende der Tripletherapie nachgewiesen wurden, die nach der Mono-Therapie, jedoch nicht vor Beginn der Re-Therapie nachgewiesen werden konnten. Diese Daten zeigen, dass vermutlich weder eine Populations-basierte noch eine tiefe Sequenzierung ausreichend ist, um alle therapierelevanten RAVs zu identifizieren.
Daten zu einer Re-Therapie mit einem aktuell oder zukünftigem verfügbaren Protease-Inhibitor, nach einer vollen Vorbehandlung mit einer TVR- bzw. BOC-basierten Tripletherapie, existieren nicht. Alle Proteaseinhibitoren haben jedoch eine breit überlappende Kreuzresistenz. Grundsätzlich ist das Vorkommen von RAVs gegenüber den Proteaseinhibitoren vor Therapiebeginn mit Ausnahme der Q80K-Variante, die nur eine Bedeutung für den Proteaseinhibitor Simeprevir hat (s.u.), selten (< 5 %) (Abb. 3). Allerdings zeigen mehrere Studien, dass die Kombination aus vorhandenen RAVs vor Therapiebeginn und fehlender Sensitivität gegenüber Interferon-alfa (Null-Responder oder Abfall der HCV-RNA < 1log10 in einer Lead-In-Phase) praktisch immer mit einem Therapieversagen assoziiert ist 9, 16. Da das Therapieversagen auf eine vorangegangene BOC/TVR-basierte Tripletherapie sowohl mit einem erhöhten Risiko von vorhandenen RAVs als auch mit einer niedrigen Interferonsensitivität assoziiert ist, erscheint eine Re-Therapie mit einem Proteaseinhibitor als nicht aussichtsreich.
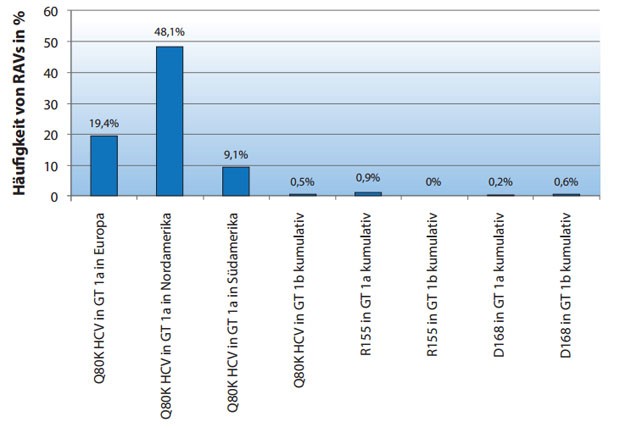 Abbildung 3: Vorkommen von mit Therapieversagen assoziierten Resistenzen (RAVs) vor Simeprevir-basierter Tripletherapie
Abbildung 3: Vorkommen von mit Therapieversagen assoziierten Resistenzen (RAVs) vor Simeprevir-basierter Tripletherapie
Re-Therapie mit anderer Substanzklasse?
Eine Re-Therapie mit einem anderen DAA, mit einem unterschiedlichen pharmakologischen Angriffspunkt kann ein erfolgsversprechendes Therapiekonzept für Tripletherapieversager darstellen.
Im Rahmen einer konventionellen Tripletherapie mit einer direkt antiviralen Substanz in Kombination mit PEG-Interferon und Ribavirin ist jedoch die verminderte Interferonsensitivität von Tripletherapieversagern zu bedenken. Studien liegen hierzu keine vor. Es ist allerdings zu vermuten, dass bei reduzierter bzw. fehlender Effektivität von PEG-Interferon und Ribavirin eine funktionelle Monotherapie mit einer direkt antiviralen Substanz (z.B. Sofosbuvir) zu keinen hohen SVR-Raten führen wird.
Interferon-freie Kombinationstherapien könnten dagegen eine ausreichende antivirale Aktivität besitzen. In einer ersten kleinen Studie wurden 41 Therapieversager auf eine TVR- oder BOC-basierte Tripletherapie mit der Kombination aus dem NS5A-Inhibitor Daclatasvir und dem nukleotidischen NS5B-Polymeraseinhibitor Sofosbuvir mit und ohne RBV für 24 Wochen behandelt 17. Bei sehr guter Verträglichkeit der Therapie erreichten 40 von 41 Patienten die SVR12. Eine weitere Studie, bei der Sofosbuvir in Kombination mit einem anderen NS5A-Inhibitor (Ledipasvir) bei BOC/TVR-Tripletherapie vorbehandelten Patienten gegeben wurde, bestätigt diese Ergebnisse mit 39 von 40 geheilten Patienten. Durch die Wirkungsvermittlung über die HCV-Polymerase und das NS5A-Protein waren die vorhandenen NS3 Proteaseinhibitor-Resistenzen offensichtlich bedeutungslos 18.
Für IFN-freie Kombinationstherapien aus einer direkt antiviralen Substanz außerhalb der NS3-Protease (z.B. mit einem Polymerase- oder NS5A-Inhibitor) in Kombination mit einem NS3-Proteaseinhibitor liegen keine Daten vor. Möglicherweise spielt hier die Existenz von Resistenzen mit einer bestimmten Frequenz innerhalb der HCV-Quasispezies eine Rolle.
Fazit
Auch in Zeiten der TVR-und BOC-basierten Tripletherapie gibt es eine große Gruppe von HCV Genotyp 1 infizierten Patienten für die dieses Regime keinen Heilungserfolg bringt. Das Versagen auf solch eine Therapie ist mit der Selektion Resistenz-assoziierter Varianten verbunden, die sich im Verlauf über Monate langsam zurückbilden und auf unterschiedlichen Niveaus in der HCV Quasispezies persistieren können. Vor der eventuellen erneuten Gabe eines Proteaseinhibitors sollte aufgrund des breiten Kreuzresistenzspektrums daher eine Resistenztestung durchgeführt werden, die im Labor der Medizinischen Klinik 1 am Frankfurter Uniklinikum kostenfrei angeboten wird (Kontaktdaten siehe unten).
Weiterhin ist ein Versagen auf eine BOC/TVR-basierte Tripletherapie typischerweise auch mit einer erniedrigten Interferonsensitivität verbunden. Daten zur erneuten Behandlung mit PEG-Interferon/Ribavirin-basierten Tripletherapien in Kombination mit direkt antiviralen Substanzen, die nicht an der NS3-Protease angreifen (z.B. NS5A-Inhibitoren wie Daclatasvir oder Ledipasivr bzw. NS5B Polymeraseinhibitoren wie Sofosbuvir), liegen nicht vor. Aufgrund der vorhandenen verminderten Interferon-Sensitivität bei Tripletherapieversagern ist jedoch eine verminderte Gesamteffektivität aufgrund einer funktionellen Monotherapie mit der direkt antiviralen Substanz zu vermuten.
Eine effektive Strategie stellt daher die Kombination aus zwei DAA dar, die außerhalb der NS3-Protease wirken. Hier konnten hohe SVR-Raten in ersten Studien mit der Kombination aus dem nukleotidischem Polymeraseinhibitor Sofosbuvir und den NS5A-Inhibitoren Daclatasvir bzw. Ledipasvir erreicht werden. Sofosbuvir wird voraussichtlich Anfang kommenden Jahres zugelassen werden, während mit der Verfügbarkeit der beiden NS5A-Inhibitoren erst Ende 2014 bzw. in 2015 zu rechnen ist. Die Effektivität einer Kombination aus dem Polymeraseinhibitor Sofosbuvir und einem der in 2014 verfügbaren NS3-Proteaseinhibitoren (Boceprevir, Telaprevir, Simeprevir, Faldaprevir) sowie Ribavirin wird vermutlich wesentlich von der Präsenz von Proteaseinhibitor-Resistenzen abhängen und sollte daher nur im Einzelfall und nach einer Resistenztestung erfolgen.
1 Bacon BR, Gordon SC, Lawitz E, Marcellin P, Vierling JM, Zeuzem S, et al. Boceprevir for previously treated chronic HCV genotype 1 infection. The New England journal of medicine 2011;364:1207-1217.
2 Jacobson IM, McHutchison JG, Dusheiko G, Di Bisceglie AM, Reddy KR, Bzowej NH, et al. Telaprevir for previously untreated chronic hepatitis C virus infection. The New England journal of medicine 2011;364:2405-2416.
3 Poordad F, McCone J, Jr., Bacon BR, Bruno S, Manns MP, Sulkowski MS, et al. Boceprevir for untreated chronic HCV genotype 1 infection. The New England journal of medicine 2011;364:1195-1206.
4 Zeuzem S, Andreone P, Pol S, Lawitz E, Diago M, Roberts S, et al. Telaprevir for retreatment of HCV infection. The New England journal of medicine 2011;364:2417-2428.
5 Bronowicki JP, Davis M, Flamm S, Gordon S, Lawitz E, Yoshida E. Sustained virologic response (SVR) in prior Peginterferon/Ribavirin (PR) treatment failures after retreatment with boceprevir (BOC) + PR: The PROVIDE study interim results. J Hepatol 2012;56:S6.
6 Berg T, Buggisch P, Hueppe D, Mauss S, Wedemeyer H, Hinrichsen H. Real-Life Data of Telaprevir-Based Triple-Therapy in Patients with Chronic Hepatitis C GT1 in Germany – A 48 Week Interim Analysis. Hepatology 2013;58:Abstract 1900.
7 Barnard RJ, Howe JA, Ogert RA, Zeuzem S, Poordad F, Gordon SC, et al. Analysis of boceprevir resistance associated amino acid variants (RAVs) in two phase 3 boceprevir clinical studies. Virology 2013;444:329-336.
8 Sarrazin C, Kieffer TL, Bartels D, Hanzelka B, Muh U, Welker M, et al. Dynamic hepatitis C virus genotypic and phenotypic changes in patients treated with the protease inhibitor telaprevir. Gastroenterology 2007;132:1767-1777.
9 Sarrazin C, Zeuzem S. Resistance to direct antiviral agents in patients with hepatitis C virus infection. Gastroenterology 2010;138:447-462.
10 Sullivan JC, De Meyer S, Bartels DJ, Dierynck I, Zhang EZ, Spanks J, et al. Evolution of treatment-emergent resistant variants in telaprevir phase 3 clinical trials. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America 2013;57:221-229.
11 Howe AY, Long J, Thompson R, Barnard RJ, Alves K, Howe JA. Analysis of the Durability of Response and Persistance Associated Variants during Long Term Follow Up after Boceprevir + Pegylated Interferon/Ribavirin Therapy - 3 Year Analysis. Hepatology 2013;58:Abstract 1849.
12 Susser S, Vermehren J, Forestier N, Welker MW, Grigorian N, Fuller C, et al. Analysis of long-term persistence of resistance mutations within the hepatitis C virus NS3 protease after treatment with telaprevir or boceprevir. Journal of clinical virology : the official publication of the Pan American Society for Clinical Virology 2011;52:321-327.
13 Diernyck I, Thys K, Ghys A, Van Rossem E, Aerssens J, De Meyer S. Post-Treatment Viral Evolution Assessment Using Ultra-Deep Pyrosequencing in Samples from Patients with Hepatitis C Virus Infection: The EXTEND Study. Hepatology 2013;58:Abstract 1510.
14 Sarrazin C, Reesink HW, Zeuzem S, Dierynck I, Luo D, Witek J, et al. Treatment with Telaprevir/Peg-IFN/RBV After 14-day Telaprevir Exposure in Phase I Studies: Results from the Phase IIIB C219 Rollover Study. J Hepatol 2013;58:S369-S370.
15 Lenz O, de Bruijne J, Vijgen L, Verbinnen T, Weegink C, Van Marck H, et al. Efficacy of re-treatment with TMC435 as combination therapy in hepatitis C virus-infected patients following TMC435 monotherapy. Gastroenterology 2012;143:1176-1178 e1171-1176.
16 Howe JA, Long J, Black S, Chase R, McMonagle P, Curry S, et al. Pooled Clinical Trial Analyses of the Effects of Detectable Baseline HCV NS3/4a Resistance- Associated Variants on the Efficacy of Boceprevir + Pegylated Interferon/Ribavirin Therapy. Hepatology 2013;58:Abstract 1853.
17 Sulkowski M, Gardiner D, Rodriguez-Torres M, Reddy K. Sustained virologic response with daclatasvir plus sofosbuvir +/- ribavirin (RBV) in chronic HCV genotype (GT) 1-infected patients who previously failed telaprevir (TVR) or boceprevir (BOC). J Hepatol 2013;58:S570.
18 Lawitz E, Poordad F, Pang P, Hyland RH, Ding X, Mo H. Sofosbuvir and Ledipasvir Fixed-Dose Combination with and without Ribavirin in Treatment-Naïve and Previously Treated Patients with Genotype 1 Hepatitis C: The LONESTAR Study. Hepatology 2013;58: Abstract 215.





