Wolfram H. Gerlich, Dieter Glebe und Christian G. Schüttler, Gießen
Infektiosität des Hepatitis-B-Virus
Das Virus wird fast ausschließlich in der Leber produziert und nicht etwa über die Galle und dem Darm mit dem Stuhl ausgeschieden, sondern nur in das Blut sezerniert. Die Frage stellt sich, wie ein Virus, das sich nur in der Leber vermehren kann und nur über den Blutweg die Leber eines neuen Wirtsorganismus erreichen kann, so erfolgreich sein kann. Nach heutiger Kenntnis sind es drei Faktoren, die die Epidemiologie des HBV bestimmen:
- die Dauer der Infektion und der damit verbundenen Infektiosität
- die je nach Verlauf und Stadium der Infektion sehr unterschiedliche Zahl infektiöser Viren im Blut der Infizierten
- die Lebensumstände, die eine Übertragung von Blut, auch in kleinsten Spuren und oft indirekt, von einer Person auf eine andere begünstigen.
Dauer der Infektion
Akute Infektion
Die Symptome der akuten und chronischen Hepatitis B werden vorwiegend durch die Wirkung der zytotoxischen T-Lymphozyten auf die HBV-infizierten Leberzellen hervorgerufen. Die aktivierten T-Lymphozyten beseitigen die infizierten Zellen und unterdrücken, zum Teil auch ohne Zell-Zerstörung, die Virusvermehrung. Die Leber gilt als jedoch immunprivilegiertes Organ. Dies bedeutet, dass die viralen Antigene in der Leber zunächst bei den T-Lymphozyten eher eine Immuntoleranz als eine Abwehrreaktion auslösen. Alle Hepatitisviren von Typ A bis E können sich daher wochenlang, im Fall von HBV monatelang, vermehren, ohne vom Immunsystem erkannt zu werden. Das Tückische ist also, dass die Infektiosität des HBV am höchsten am Ende der bis zu 6 Monate dauernden Inkubationszeit ist, während in der symptomatischen Phase die Infektiosität schon abfällt. Auch ausheilende Infektionen können somit über viele Monate eine erhebliche Infektionsquelle darstellen.
Chronische Infektion
Wesentlich häufiger geht die Infektiosität aber von chronisch Infizierten aus, die aufgrund geringer Symptomatik oft jahrzehntelang unerkannt bleiben. Neugeborene und Kleinkinder entwickeln zu über 90 % eine chronische Infektion, ohne je eine akute Hepatitis-Erkrankung gehabt zu haben. Bei Infektion in höherem Lebensalter wird nur ein kleiner Prozentsatz der Infektionen chronisch, sofern das Immunsystem intakt ist. Aber schon relativ geringe Beeinträchtigungen des Immunsystems wie z. B. Diabetes mellitus, Hämodialyse oder sehr hohes Lebensalter erhöhen die Chronizitätsrate.
Anzeichen für die Chronizität ist die Persistenz des HBsAg, meist in Abwesenheit der entsprechenden Antikörper (Anti-HBs). Bei etablierter Chronizität kann das HBsAg lebenslang persistieren, aber ein nicht unwesentlicher Teil der Patienten verliert das HBsAg im Verlauf von Jahrzehnten spontan oder auch nach gezielter Therapie. Danach ist von keiner wesentlichen Infektiosität mehr auszu-gehen (Ausnahme: Blut- und Organ-spende).
Höhe und Verlauf der Infektiosität
Bestimmung der Virus-Partikelzahl (Viruslast)
Einen Hinweis auf die von einem HBV-Träger ausgehende Übertragungsgefahr gibt die Zahl der HBV-DNA-Moleküle im Blut. Mit den Methoden der Nukleinsäure-Biochemie ist es seit Langem möglich, die Menge an HBV-DNA in Serum oder Gewebe quantitativ zu bestimmen. Am besten ist eine Real-Time-PCR hierzu geeignet, die Mengen von einigen wenigen bis >109 DNA-Moleküle pro Probe messen kann. Da HBV-DNA außerhalb von HBV Partikeln im Serum nicht oder nur in geringer Menge vorkommt, kann man die Zahl der DNA-Moleküle (oft „copies“ genannt) in Serum oder Plasma mit der Virus-Partikelzahl gleichsetzen. Sie gibt die theoretisch mögliche Obergrenze der Zahl von infektiösen Viren an. Oft wird die Konzentration der HBV-DNA/ml als Viruslast bezeichnet (virus load) und in „International Units“ (IU) angegeben. Eine IU entspricht in erster Näherung 5 Molekülen bzw. copies bzw. Virusgenomen. (Zur Herkunft der IU für HBV-DNA siehe 1 )
Höhe der Virämie im Verlauf
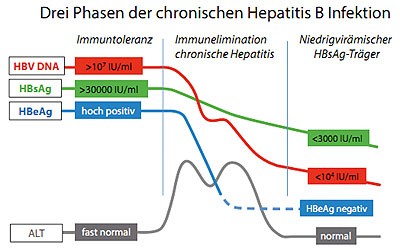
Abbildung 1: Schematischer Verlauf einer chronischen Hepatitis B ohne Therapie. Die chronische Hepatitis B verläuft typischerweise über Jahre oder Jahrzehnte, wobei die einzelnen Phasen unterschiedlich lange dauern können. Viele chronisch Infizierte erreichen die niedrigvirämische Phase nie oder erst nach Ausbildung einer Leber-Zirrhose. Die im Text vorwiegend verwendete Mengenangabe für HBV DNA in Molekülen/ml ist ungefähr um den Faktor 5 höher als die international empfohlene International Units (IU), die willkürlich festgelegt sind.
Eine weitverbreitete Auffassung in der klinischen Virologie und Hepatologie ist, dass ein positiver HBsAg-Test bei einer Person nicht nur eine HBV-Infektion, sondern automatisch auch Infektiosität für HBV anzeigt. Man sollte sich aber vor dieser stigmatisierenden Pauschalaussage hüten. Ob eine Übertragung nicht nur theoretisch möglich ist, sondern auch mit realistischer Wahrscheinlichkeit eintreten kann, hängt von der Zahl der infektiösen Viren und der Art und Häufigkeit des Kontakts ab. Jahrzehntelange Erfahrung lehrt, dass es vier Stufen der chronischen HBV-Infektion mit sehr unterschiedlichen Viruskonzentrationen im Blut gibt, von denen drei in Abb.1 gezeigt sind.
Immuntoleranzphase. Der meist symptomarme, hochvirämische HBV-Träger mit geringer entzündlicher Aktivität hat sehr hohe Mengen HBsAg im Blut, typischerweise 30.000 bis 200.000 IU/ml 2, und 108 -1010 Moleküle HBV-DNA/ml. Praktisch immer ist auch HBeAg positiv, welches als Immunmodulator die Immuntoleranz gegen das sehr ähnliche HBV-Core-Antigen (HBcAg) fördert. Hier ist ohne Ausnahmen eine hohe Übertragungsgefahr gegeben. Dieser Zustand kann bei Chronizität Jahre bis Jahrzehnte bestehen, vor Ausbruch einer ausheilenden Hepatitis B maximal einige Wochen.
Chronische Hepatitis B. Mit Einsetzen der zellulären Immunabwehr, vorwiegend gegen das HBcAg, nimmt die entzündliche Aktivität zu und die Viruskonzentration ab. Die Viruskonzentration ist wechselnd, meist schon <108 /ml, aber noch >104 /ml. Das HBeAg kann noch vorliegen oder schon verschwunden sein. Zu beachten ist, dass es zu Fluktuationen der Virusvermehrung und im Gefolge auch der entzündlichen Aktivität kommen kann, sodass Verlaufsbeobachtungen nicht nur für die Prognose des Patienten, sondern auch für die Frage der Infektiosität unerlässlich sind. Bei günstigem Verlauf wird der Zustand des gesunden HBsAg-Trägers erreicht, ohne dass es schon zur ausgedehnten Leberfibrose oder gar Leber-Zirrhose gekommen ist.
Niedrig-virämischer HBsAg-Träger. Der annähernd
gesunde niedrig virämische HBsAg-Träger hat < 30.000 IU HBsAg/ml (meist
<3000) und <104 Moleküle HBV-DNA/ml im Serum. Bei rund 5 % dieser HBsAg-Träger ist selbst mit
den besten PCR-Verfahren keine HBV-DNA (<10 Moleküle/ml) nachzuweisen. Das
HBeAg ist verschwunden und meistens der entsprechende Antikörper (Anti-HBe)
vorhanden. Dieser Zustand wird oft spontan nach Jahren oder Jahrzehnten hoher
Virämie, mitunter auch nach antiviraler Therapie, erreicht. Die
Übertragungsgefahr ist hier sehr gering (Ausnahme: Blut- und
Organspende). Jedoch muss durch Verlaufsbeobachtungen überprüft werden, ob der
Zustand stabil ist. Außerdem muss man damit rechnen, dass jede nennenswerte
Immunsuppression (z. B. durch eine zytostatische Therapie) zur Reaktivierung
führen kann. Das Fehlen des HBeAg ist in den meisten Fällen günstig, jedoch
können HBeAg negative Varianten, wenn sie denn übertragen werden, gehäuft eine
fulminante Hepatitis B auslösen.
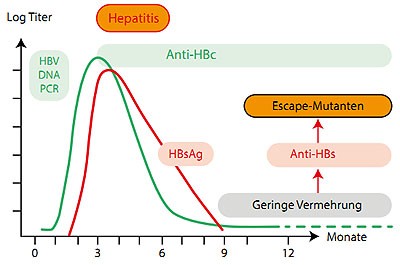
Abbildung 2: Entstehung einer okkulten HBV-Infektion mit Escape-Mutanten nach einer ausgeheilten akuten Hepatitis B.
Ausheilung und okkulte Phase. Bei Infektion nach den ersten Lebensjahren durchläuft der Infizierte (sofern immunkompetent) die oben genannten drei Stufen quasi im Zeitraffer innerhalb einiger Monate. Bei hoher Infektionsdosis (>1000 ID50) kommt es zunächst logarithmisch ansteigend zu hoher Virämie, dann im Rahmen der Immun-Elimination zu einer akuten Hepatitis B und während der Rekonvaleszenz zu einer Phase, in der noch HBsAg für einige Wochen nachweisbar ist, aber die Viren schon fast aus dem Blut verschwunden sind. Schließlich verschwindet auch das HBsAg und nach einer gewissen Pause von Wochen oder Monaten erscheint bei rund 75 % der Rekonvaleszenten der HBV-neutralisierende Antikörper gegen HBsAg (Anti-HBs). Damit ist das Virus aber nicht immer völlig aus dem Organismus verschwunden, sondern es kann (bei einem nicht näher bekannten Anteil der Patienten) in der Leber okkult weiter bestehen und sich auf ganz niedrigem Niveau sogar replizieren und zur Bildung von Escape-Mutanten führen (Abb. 2). Diese okkulte HBV-Infektion (OBI) kann sich auch nach einer völlig inapparenten akuten Infektion ausbilden, wie sie oft bei niedriger Infektionsdosis vorkommt. Die HBV-DNA ist bei einer OBI nur sehr selten im Blut nachweisbar und meist nur in ganz geringer Menge. Definitionsgemäß spricht man bei negativem HBsAg nur dann von einer OBI, wenn die HBV-DNA Menge <1000 Moleküle/ml liegt (Raimondo et al. 2008). Eine Übertragungsgefahr ist bei Blutspendern mit einem positiven HBV-DNA-Befund (>10 Moleküle/ml) gegeben. Durch zwischenmenschliche Kontakte, welcher Art auch immer, gibt es hier keine Übertragungen. Jedoch kann es bei schwerer Immunsuppression mit Beseitigung der B-Lymphozyten (z. B. durch Rituximab bei der Therapie von Lymphomen) zur Reaktivierung und hoher Infektiosität kommen. Mitunter wird die Reaktivierung erst bemerkt, wenn Kontaktpersonen eine akute Hepatitis B erleiden.
Experimentelle Bestimmung der Infektiosität
Die Zahl der HBV-DNA-Moleküle ist nur ein Ersatzparameter für die wahre Infektiosität. Die klassischen Maßzahlen für die Infektiosität sind die Virusdosis, die in 50 % der Versuche eine Infektion hervorruft (ID50) oder die plaque forming units, die direkt die Zahl der infektionstüchtigen Viren in einer empfänglichen Zellkultur angeben. Für HBV sind aber Zellkulturen zur Ermittlung des Infektiositätstiters problematisch. HBV vermehrt sich effizient nur in voll differenzierten Leberzellen von Primaten, d. h. in vivo im intakten Organ. Lange Zeit gab es als Ersatz nur primäre Hepatozyten-Kulturen, die frisch aus chirurgisch entnommener menschlicher Leber erstellt werden mussten. In den letzten 10 Jahren wurden auch redifferenzierte Hepatomzellen und primäre Hepatozyten von Tupaias (südostasiatische Spitzhörnchen) eingesetzt (Glebe und Urban 2007). Selbst diese schwierig zu erhaltenden Zell-Systeme sind aber weitaus weniger für die Infektion empfänglich als der intakte Wirtsorganismus des Menschen oder Schimpansen.
Eine realistische Abschätzung erlaubt also nur der Tierversuch im Schimpansen und neuerdings auch in chimären Mäusen, denen (bei defektem Immunsystem) Leberzellen von Mensch oder Tupaia eingepflanzt wurden. Schon in den 1970er Jahren wurde im Schimpansenversuch gezeigt, dass ein Pool von HBeAg-positiven Plasmen noch in einer Verdünnung von 1:108 mit einem Milliliter intravenös verabreicht, eine Infektion übertragen konnte. In diesen Versuchen zeigte es sich demnach, dass in der immuntoleranten Phase der HBV-Infektion schon rund 10 Viruspartikel eine Infektion bei intravenöser Verabreichung auf Schimpansen übertragen können. Bei den chimären Mäusen betrug die ID50 in der frühen Phase sogar nur 3 Viruspartikel (Tabuchi et al. 2008). Diese Experimente stehen in Einklang mit Beobachtungen aus dem Blutspendewesen, wo (extrem selten) Übertragungen durch Blutprodukte von Spendern beobachtet wurden, die auch mit den empfindlichsten HBV-DNA-Tests negativ waren (Nachweisgrenze <10 Moleküle/ml), aber schon infiziert waren und einige Wochen später eine voll entwickelte HBV-Infektion hatten (siehe Gerlich et al. 2007 3).
In der späten Phase der Infektion mit abfallender Virämie ist die Infektiosität der Viruspartikel viel geringer: Eine ID50 für die chimäre Maus erfordert dann 200-350 Viruspartikel (Tabuchi et al. 2008). Bei den Schimpansenversuchen in den 1970er Jahren war ein Pool von Anti-HBe-positiven Plasmen nur noch in einer Verdünnung von 1:10 infektiös, was mutmaßlich rund 10.000 Viruspartikeln entsprach. Bei der retrospektiven Nachverfolgung von Blutempfängern, die ungewollt durch Spender mit einer nicht rechtzeitig erkannten OBI infiziert wurden, zeigte sich, dass eine ID50 etwa 1000 Molekülen HBV-DNA/ml entsprach (Allain et al. in Vorbereitung). Die große Mehrzahl der Viruspartikel ist in der Eliminationsphase also nicht infektiös oder so aggregiert, dass sie nur einem Partikel entsprechen. Die Ursache für die rund 100 Mal geringere Infektiosität ist nicht genau bekannt. Denkbar ist, dass Antikörper gegen die PräS-Domänen der HBV-Oberfläche die Anheftungsstellen der Viren verdecken. Diese Antikörper werden noch vor dem „normalen“ Anti-HBs gebildet und kommen auch bei gesunden HBsAg-Trägern vor. Zu der ohnehin niedrigeren Zahl der Viruspartikel kommt bei den Phasen ohne Immuntoleranz also noch die viel geringere Infektiosität der Partikel hinzu. Im Einzelfall kann aber nicht ausgeschlossen werden, dass die Infektiosität doch höher als 1:100 bzw. 1:1000 ist.
Hauptreservoir des Erregers ist das Blutserum. Eine aktive Ausscheidung des Erregers mit anderen Sekreten oder Exkreten ist nicht erwiesen, trotz gelegentlichen anderslautenden Berichten. Nachgewiesen ist das Vorliegen von HBsAg und HBV-DNA in Speichel, Sperma und Vaginalsekret, allerdings in etwa 100 bis 1000 mal niedrigeren Konzentrationen als im Serum, sodass von einem passiven Übertritt aus dem Blut in diese Kompartimente ausgegangen werden kann. Die Übertragbarkeit von HBV durch Speichel und Sperma ist experimentell durch Infektionsversuche in Primaten erwiesen.
Übertragungswege des HBV und ihre Vermeidung
Abbildung 3: Alle Blutkonserven werden in Deutschland auf HBsAg und Anti-HBc, meist auch auf HBV DNA, untersucht.
Ob infektiöses HBV von einem Wirtsorganismus zum nächsten
gelangen kann, hängt nicht nur von der Menge und Vermehrungsfähigkeit des Virus
in der infizierenden Person sondern in extremen Maß vom Übertragungsweg ab. Die
Frage dabei ist, wie häufig ein Übertragungsweg vorkommt und wie effizient er
ist. Im Folgenden werden die Übertragungswege in der Reihenfolge ihrer
Effizienz diskutiert.
Lebertransplantation. Der effizienteste, wenn auch sehr seltene Weg, HBV von einer Person auf die nächste zu übertragen ist die Leberspende. Selbst einige wenige in der Spenderleber verbliebene HBV-Genome, die aufgrund angeborener und adaptiver Immunreaktionen weitgehend inaktiviert waren, können im nicht immunen und immunsupprimierten Transplantatempfänger reaktivieren und sich in der transplantierten Leber wieder ausbreiten (siehe z. B. Blaich et al. 2012). Lebern von Spendern mit OBI können dennoch verwendet werden, wenn der Empfänger durch eine präemptive HBV-Therapie mit z. B. Lamivudin oder einem der neueren Wirkstoffe geschützt wird (Skagen et al. 2011). Zusätzlich kann die Gabe von Hepatitis-B-Immunglobulin nützlich sein. Das Restrisiko besteht in erster Linie darin, dass die notwendigen Maßnahmen aus Unkenntnis oder falsch verstandener Sparsamkeit nicht ergriffen werden.
Blutspende. Fast alle HBV-enthaltenden Blutspenden
können durch heutige HBsAg-Tests erkannt werden. In der Frühphase der
HBV-Infektion oder bei der OBI reicht jedoch deren Sensitivität nicht aus. Ein
sensitives Screening auf HBV-DNA kann das Problem verringern, aber selbst die
empfindlichsten HBV-DNA-Tests können nur etwa 70 %
der sehr seltenen infektiösen HBsAg-
negativen Spender in der Frühphase erkennen. Dagegen werden fast alle infektiösen
Spender mit persistierender OBI durch einen sehr empfindlichen Test
auf HBV-DNA (Nachweisgrenze <10 Moleküle/ml) erkannt. Alternativ kann hierzu
auch auf Anti-HBc getestet werden. In Deutschland dürfte das Restrisiko einer
HBV-enthaltenden Spende wegen der vorgeschriebenen HBsAg- und Anti-HBc-Testung
und der freiwillig fast überall durchgeführten HBV-DNA Testung extrem niedrig
sein, mutmaßlich unter 1: 500.000. Wegen der sehr niedrigen Viruszahlen in
solchen Spenden spielt das Volumen des Plasmas im Blutprodukt eine wesentliche
Rolle. Frisch gefrorene, nicht Virus-inaktivierte Plasmaspenden in Einheiten
von 200 ml übertragen signifikant häufiger HBV als Erythrozyten-Konzentrate mit
nur 20 ml Plasma von der gleichen Spende (Gerlich et al. 2010).
Organtransplantationen. Die Übertragungsgefahr durch Organe außer Leber ist bei sehr niedriger Virämie eher geringer als bei der Bluttransfusion einzuschätzen. Allerdings sind die Spender nicht so gut untersucht und bei den post mortem entnommenen Blutproben der Spender kann es sowohl zu falsch positiven wie zu falsch negativen Befunden kommen. Eine Testung auf HBV-DNA gehört nicht zum Standard-Testprogramm, was schon dazu geführt hat, dass ein frisch infizierter Spender noch ohne HBsAg nicht erfasst wurde und vier Übertragungen verursachte (Nielsen 2010). Zudem wird angesichts der Organknappheit ein positiver Anti-HBc-Befund, anders als bei Blutprodukten, nicht als Hindernis für eine Verwendung betrachtet. Selbst HBsAg-positive Spender werden gelegentlich verwendet. Der virologischen Überwachung der Empfänger kommt also eine besondere Bedeutung zu, um gegebenenfalls frühzeitig eine antivirale Therapie einzuleiten.
Mutter-Kind-Übertragung. Dieser Übertragungsweg hat die Epidemiologie des HBV entscheidend geprägt, da dieser Weg weltweit die meisten chronischen HBV-Träger verursacht und dadurch das Erreger-Reservoir für Jahrzehnte aufrechterhalten wurde 4. Angesichts des überaus engen Kontakts vor, während und nach der Geburt überrascht es, dass eine Übertragung nur bei HBeAg-positiven Müttern mit >106 HBV-DNA Molekülen/ml mit >95 % sehr häufig ist. Bei HBeAg-negativen Müttern liegt die Übertragungsrate dagegen <5 % und ist dann mit einer relativ hohen Virämie von >105/ml der Mutter verbunden. Das Angehen der Infektion kann bei den meisten Neugeborenen durch eine passiv/aktive Simultanimpfung innerhalb 24 h nach Geburt unterbunden werden. Impfdurchbrüche werden bei Müttern mit >108/ml beobachtet. Eine 4-6 Wochen vor Geburt eingeleitete antivirale Therapie mit Lamivudin (Han L et al. 2011; Yu M et al. 2012) oder Telbivudin (Han GR et al. 2011) verhindert diese Durchbrüche, sofern die Virämie zum Geburtstermin auf Werte <106/ml abgesunken ist. Bei Resistenz gegen diese Mittel kann auf Tenofovir zurückgegriffen werden (Pol et al. 2011).
Muttermilch von HBsAg positiven Müttern enthält häufig HBsAg und HBV-DNA (de Oliveira et al. 2009). Stillen könnte also theoretisch HBV auf das Kind übertragen, wobei das Risiko im Vergleich zur Geburt wohl niedriger anzunehmen ist und durch die Impfung nur noch sehr gering sein sollte. In mehreren Studien wurde tatsächlich keine erhöhte Übertragungsrate bei gestillten (und geimpften) Kindern von HBeAg-positiven Müttern beobachtet (Zheng et al. 2011). Jedoch sollte die Muttermilch nur dem eigenen leiblichen Kind gegeben werden und nicht in Milchbänken verwendet werden.
Hygiene-Mängel bei Injektionen. Dieser Übertragungsweg mag hierzulande nicht mehr der häufigste sein, aber in seiner Effizienz dürfte er die weiter unten genannten deutlich übertreffen. In der ersten Hälfte des letzten Jahrhunderts gab es viele Berichte über „Ikterus-Ausbrüche“ nach Therapien, die Injektionen erforderten. Weltweit dürften bis in jüngere Zeit Injektionen mit unzureichend desinfizierten, mehrfach gebrauchten Spritzen enorm zur Verbreitung von HBV beigetragen haben. Erst mit der schrittweisen Einführung von Einmalspritzen und -nadeln wurde dieser Übertragungsweg weitgehend, aber nicht völlig zurückgedrängt. Durch unkundiges Personal kann es auch heute noch zum sogenannten Spritzenfehler kommen. Dabei wird nur eine neue Nadel, nicht aber eine neue Spritze für den nächsten Patienten genommen und nicht bedacht, dass spätestens beim Abziehen der Nadel ein Rückfluss von Blut in die Spritze (oder einen Infusionsschlauch) kaum vermeidbar ist.
Potenziert wird dieser Fehler noch, wenn mit einer solchermaßen kontaminierten Spritze Injektionsflüssigkeit aus einem Vorratsgefäß immer wieder Portionen für verschiedene Patienten entnommen werden. Aus diesem Grund sind heute Mehrdosisbehältnisse für Injektionslösungen verboten, was aber medizinisches Personal selbst in jüngster Zeit nicht davon abhielt, mehrere Dosen aus einem Gefäß zu entnehmen. So wurden z. B. in einer Klinik in den USA auf diese Weise im Verlauf von 5 Jahren 29 Patienten mit HBV infiziert (Greely et al. 2011). 5
Schlauchsysteme für Infusionen dürfen ebenfalls nur einmal verwendet werden, jedoch halten sich auch hier nicht alle Anwender daran, wie der Fall eines Anästhesisten zeigte, der bei zwei Gelegenheiten jeweils zwei Patienten, die zeitlich unmittelbar nach einem hochvirämischen HBV-Träger operiert wurden, durch die Mehrfachverwendung eines Schlauchsystems mit HBV infizierte. Nach Publikation des Falles im Dtsch. Ärzteblatt (Furtwängler et al. 2006) erhielt einer der Verfasser (W.G.) mehrere persönliche Zuschriften, die die weite Verbreitung dieses speziellen Hygienefehlers in Deutschland bestätigten.
Blutentnahmen mit Kapillaren. Ein seit Jahren immer wiederkehrendes Ärgernis ist die Übertragung von HBV durch unhygienisch vorgenommene Blutzuckermessungen bei Diabetikern mittels Kapillarblutentnahme. Geräte, die nur für die Nutzung bei ausschließlich einem Patienten vorgesehen sind, wurden für Serienmessung an vielen Patienten ohne jeweilige Desinfektion aller benutzten Gegenstände zwischen den Entnahmen durchgeführt. Erst kürzlich wurde aus Großbritannien über 5 dadurch verursachte Ausbrüche berichtet (Duffell et al. 2011), in den USA wurden sogar 16 solcher Ausbrüche mit 6 Hepatitis-B-bedingten Todesfällen erfasst (Moore et al 2011). Auch in Deutschland wurden solche Vorfälle bekannt (z. B Dreesman et al. 2006). Bei einem kürzlich aufgetretenen Ausbruch gab es auch in Deutschland zwei Todesfälle durch akutes Leberversagen bei deren Aufklärung die Verfasser beteiligt waren. Beteiligt waren hier hoch pathogene HBeAg-negative HBV-Varianten, die zwar meist keine so hohen Virämien erreichen, aber durch Hygienemängel in der Medizin dennoch relativ oft übertragen werden (Arankalle et al. 2011).

Abbildung 4: Injektionen mit mehrfach gebrauchten Spritzen sind heute selbst in Ländern mit wenig Resourcen eine Seltenheit.
Andere nosokomiale Übertragungs-wege. Auch ohne
Injektionen oder Blutentnahmen kann HBV in der Medizin übertragen werden.
Wertvolle medizinische Geräte für invasive Eingriffe (z. B. Endoskope,
Herzkatheter, zahnärztliche Instrumente) müssen mehrfach verwendet und nach
jedem Gebrauch desinfiziert werden. Dabei können natürlich Fehler passieren,
was vielfach berichtet wurde. Bei einem ungewöhnlichen Übertragungsfall von
einem operierten Patienten auf den nächsten wurde vom
Gesundheitsamt als einziges Gerät, welches zwischen den Operationen nicht
gewechselt oder desinfiziert wurde, die blutkontaminierte Stirnlampe des
Operateurs identifiziert (R. Potthoff, persönliche Mitteilung).
Eine besondere Problemzone sind hämatologisch-onkologische Kinderstationen, wo zusätzlich der direkte Kontakt zwischen den Kindern zu Übertragungen führen kann, wie ein großer Ausbruch in den 1980er Jahren in Gießen zeigte. Bei der Hämodialyse ist die Kontamination mit Blut so schwer zu beherrschen, dass für HBV- oder HCV-infizierte Patienten ein eigener „gelber“ Behandlungsraum vorgeschrieben ist. Erst dadurch konnte die Übertragung von HBV und HCV in der Hämodialyse eingedämmt werden.
Generell scheint die Medizin in Form unhygienischer Injektionen und Operationen selbst heute noch statistisch signifikant zur gegenwärtigen HBV-Inzidenz in den USA (Perz et al. 2012) und Deutschland (RKI 2010) beizutragen. Angesichts der Seltenheit hochvirämischer HBV-Träger und der mutmaßlich großen Dunkelziffer an nicht erkannten Übertragungen dürften unhygienische Praktiken auch im deutschen Gesundheitswesen sehr verbreitet sein.
Behandlungen mit einem gewissen verletzungsbedingten Übertragungsrisiko erfolgen auch außerhalb der Medizin. So wurden ausgehend von einem HBV-Träger unter den Kunden einer Fußpflegepraxis an einer psychiatrischen Anstalt in den USA 5 Übertragungen innerhalb eines Tages auf weitere Kunden festgestellt (Wise et al. 2012). Aus Indien wurde eine Assoziation der anti-HBc-Prävalenz mit „patronage of local barbers“ festgestellt (Jagannanthan et al 2010).
Intravenöser Drogengebrauch. Injektionen zum Gebrauch von Rauschdrogen oder zur illegalen Leistungssteigerung erfolgen meist unter hygienisch bedenklichen oder inakzeptablen Verhältnissen. Der intravenöse Drogengebrauch ist für HBV allerdings kein so häufiger Übertragungsweg wie für HCV, da HBV-Infektionen bei Jugendlichen und Erwachsenen viel seltener chronisch werden und somit die infektiöse Phase vergleichsweise kurz ist. Weltweit sollen aber dennoch 1,2 Millionen (5 bis 10 %) der i.v. Drogennutzer HBsAg-Träger und 6,4 Millionen Anti-HBc-positiv sein (Nelson et al. 2011). Eine OBI wird bei i. v. Drogennutzern also oft gefunden, die noch messbare, aber vorwiegend sehr niedrige Virämie einer OBI reicht jedoch zu einer Übertragung meist nicht aus.
Sexuelle Kontakte. Hepatitis B ist eine sexuell übertragbare Krankheit, jedoch ist die Übertragung von HBV bei Weitem nicht so eng mit Intimkontakten verknüpft wie etwa die von HIV oder Syphilis. Sperma, Vaginalsekret oder Speichel enthalten etwa ein Tausendstel der Virusmenge, die im Serum gefunden wird. Reiner Schleimhautkontakt ist als Eintrittspforte etwa 100 bis 1000 Mal ineffizienter als echte Hautverletzungen oder gar intravenöse Injektionen. Daher erfolgt eine Übertragung bei ungeschütztem Geschlechtsverkehr, wenn überhaupt, nur bei hoher Virämie, wie sie bei immuntoleranten HBV-Trägern oder in der späten Inkubationsphase der akuten Hepatitis B vorliegt. Intimpartner von Patienten, die später eine akute Hepatitis B entwickelten, werden während der einige Wochen dauernden Phase hoher Virämie nur zu etwa 30 % infiziert. Intimpartner von immuntoleranten HBV-Trägern werden mitunter erst nach Jahren infiziert. Dennoch ist heute der sexuelle Kontakt ein wichtiger, in den meisten epidemiologischen Studien signifikanter Übertragungsweg, z. B. in Uganda auch mit HIV und Syphilis assoziiert (Stabinski et al. 2011). Die Verwendung von Kondomen schützt auch vor HBV wie eine Studie in Peru zeigte (Bernabe-Ortiz et al. 2011). Anzumerken ist aber, dass auch intensives Küssen zur Übertragung führen kann (s. u.).
Bei heterosexuellen Übertragungen besteht sehr häufig die
Situation, dass ein unerkannt infizierter Partner mit hoher Virämie aus
hochendemischen Gebieten stammt oder eine entsprechende Abstammung hat.
Umgekehrt ist eine Übertragung durch niedrig virämische HBV-Träger äußerst
selten. Es gibt viele Paare mit gemeinsamen leiblichen Kindern, wobei ein
Partner ein niedrig-virämischer Träger ist und der andere Partner auch nach
Jahren des Zusammenlebens Anti-HBc negativ bleibt. Diese Einschätzung der
Übertragbarkeit bedeutet nicht, dass Prävention unwichtig wäre. Die Impfung der
Intimpartner von HBsAg-Trägern unabhängig von der Virämie ist generell
empfohlen und auch durchzuführen.

Abbildung 5: Kondome schützen auch vor Hepatitis B.
Familiäre und Haushaltskontakte. Die Übertragungsgefahr während des engen Zusammenlebens mit hochvirämischen Trägern ist durch praktisch alle epidemiologischen Studien belegt. Neben Kindern, Eltern und Geschwistern sind auch weitere Mitglieder des Haushalts, Verwandte mit häufigen Kontakten und enge Freunde gefährdet. Die Übertragungsgefahr ist sehr konkret, jedoch bleiben andererseits viele dieser Kontaktpersonen auch nach Jahren des Zusammenlebens seronegativ.
Berufstätigkeit in der Medizin. Noch in den 1970er Jahren betrug die Prävalenz des Anti-HBc in Deutschland bei medizinischem Personal >50 % und Hepatitis B war eine der wichtigsten Berufskrankheiten des medizinischen Personals. Neben den vielen z. T. unvermeidlichen kleinen Hautverletzungen mit blutkontaminierten scharfen oder spitzen Gerätschaften war es auch Schleimhautkontakt durch Blutspritzer in das Auge oder Verschlucken von infektiösem Serum beim Pipettieren mit dem Mund, der zur Infektion führte. Eine häufige Verletzung war ein Stich beim Abnehmen einer Nadel von einer Spritze nach Injektionen oder Blutentnahmen. Mit der Verbesserung der Arbeitstechniken und des Arbeitsschutzes ist dieser Übertragungsweg viel seltener geworden. So gibt es z. B. sichere Abwurfvorrichtungen für Injektionsnadeln. Bei schwierigen Operationen wird sich das Verletzungsrisiko aber nicht ganz beseitigen lassen. Für den Fall einer Stich- und Schnittverletzung mit blutkontaminiertem Gerät gibt es ausführliche Anleitungen der STIKO am Robert-Koch-Institut (Epidem Bull 2010/30) zum Umfang der diagnostischen und prophylaktischen Maßnahmen bei „Spender“ (Indexperson) und „Empfänger“ (Exponierter).
Die beste Maßnahme vorweg ist die Impfung des medizinischen
Personals bereits vor Beginn der Ausbildung und eine Kontrolle des Impferfolgs
durch Messung des Anti-HBs-Titers. Auch Personal, das bei Labor-, Rettungs- oder
Reinigungsdiensten eingesetzt wird oder in psychiatrischen
Fürsorgeeinrichtungen tätig ist, muss gemäß STIKO geimpft und nachuntersucht
werden. Insgesamt ist heute bei jüngerem medizinischem Personal keine erhöhte
HBV-Prävalenz mehr festzustellen. Die Zahl gemeldeter Verdachtsfälle beruflich
bedingter HBV-Infektion hat in den letzten 10 Jahren von 500 auf etwa 100 pro
Jahr abgenommen (Berufsgenossenschaft für Gesundheitsdienst und Wohlfahrt 2011)
und die wenigsten davon dürften anerkannt werden. Eine Studie in den
Niederlanden wertete in den Jahren 2003 bis 2010 1601 Stichverletzungen bei
medizinischem Personal aus. Bei 8 %
der Patienten war eine HBV, HCV oder HIV Infektion bekannt. Beobachtet wurde
aber nur eine HCV-Übertragung. Anzumerken ist, dass 86 % des Personals gegen
Hepatitis B geimpft war (Frijstein et al. 2011).
Abbildung 6: Medizinisches Personal sollte sollte nicht nur gegen Hepatitis B geimpft sein, sondern der Anti- HBs-Titer sollte ca. 4 Wochen nach der letzten Impfdosis überprüft werden.
Ein Sonderfall ist die Übertragung von infiziertem Personal auf Patienten bei invasiven Eingriffen. Bis vor 12 Jahren war dies in Deutschland ein ungelöstes Problem, welches in den 1970er bis 90er Jahren mutmaßlich zu Hunderten von Übertragungen führte. Es gab einige wenige operativ tätige Ärzten mit hoher Virämie, die jahrelang übertragungsträchtige Eingriffe an Tausenden von Patienten durchführten. Besonders risikoreich waren Herz-, Kiefer- und gynäkologische Operationen. Eine wirksame Kontrolle der Ärzte auf ihren Infektionsstatus wurde an vielen Kliniken versäumt, bzw. die Tätigkeit trotz hoher Virämie wurde geduldet. Der in der Öffentlichkeit viel beachtete Fall eines Herzchirurgen führte im Jahr 2000 zu einem grundlegenden Wandel (Gerlich 2004). Heute wird praktisch das gesamte medizinische Personal bei Einstellung und danach in regelmäßigen Abständen auf HBsAg bzw. Immunität untersucht. Bei einem positiven HBsAg-Befund wird gemäß den Richtlinien der DVV und GfV (http://www.dvv-ev.de/therapieempfehlungen/de/hbvhcv.pdf) die Höhe der Virämie und das Übertragungsrisiko der betreffenden Tätigkeit beurteilt und nötigenfalls eine Tätigkeitseinschränkung angeordnet. Auch die Impfung des medizinischen Personals wird heute konsequent durchgeführt, an der Nachkontrolle mangelt es aber des Öfteren.
Andere Berufstätigkeit. Auch andere Berufsgruppen können einem erhöhten HBV-Infektionsrisiko ausgesetzt sein. Der Katalog der zu impfenden Personengruppen wird von der STIKO von Zeit zu Zeit aktualisiert und umfasst explizit genannt Müllentsorger, ehrenamtliche Ersthelfer, Polizisten, Sozialarbeiter oder Gefängnispersonal mit Kontakt zu i.v. Drogennutzern.
Es können auch ganz unerwartete berufliche Expositionen auftreten. So gab es in den 1970er Jahren einen Hepatitis-B-Ausbruch in einer Fleischerei. Ein Mitarbeiter war nach unfallbedingten langwierigen Operationen asymptomatisch zu einem hochvirämischen HBV-Träger geworden und infizierte nach Tätigkeitsbeginn innerhalb weniger Wochen alle seine vier Kollegen, die mit ihm in der Fleischverarbeitung tätig waren. Diese Tätigkeit war (zumindest damals in diesem Betrieb) mit häufigen Verletzungen der Hände verbunden und Kontaminationen der Fleischstücke und des Handwerkszeugs mit menschlichem Blut waren unvermeidlich und kaum zu erkennen. Generell ist eine solche Situation extrem selten, aber im Einzelfall müssen auch untypische Übertragungswege in Betracht gezogen werden.
Etwas problematisch ist die STIKO-Empfehlung für „Durch Kontakt mit HBsAg-Trägern in einer Gemeinschaft (Kindergärten, Kinderheime, Schulklassen, Spielgemeinschaften) gefährdete Personen“. Eine Untersuchung aller Kinder in diesen Gemeinschaften auf HBsAg ist nicht vorgesehen oder sinnvoll. Auch ein genereller Impfschutz kann nicht vorausgesetzt werden, da es keine Vor- oder Nachuntersuchung bei der Impfung gibt und sich unter den Kindern unerkannt HBsAg-Träger mit hoher Virämie befinden können. Besser wäre eine Impfung dieser gesamten Berufsgruppe.
Kindergärten. In Kindergärten ist es schon öfters zu Übertragungen zwischen den Kindern oder auf das Personal gekommen, mehr noch in Einrichtungen für geistig behinderte Kinder. Im Kindesalter ist der Anteil der hochvirämischen HBV-Träger höher und Speichel oder Blut aus Bagatellverletzungen verbreiteter als im späteren Lebensalter. Ein Biss von einem hochvirämischen HBV-Träger ist erwiesenermaßen ein sehr wirksamer Übertragungsweg. Aber auch in Kindergärten dürfte die Infektionsgefahr inzwischen sehr gering sein, da die Durchimpfungsrate bei Vorschulkindern mittlerweile bei 90 % liegt (Epidem Bull 2011/16).
Schulen. Eine Studie aus den 1990er Jahren belegt die geringe Übertragungsgefahr in der Schule. Das Umfeld von 29 hochvirämischen Schülern, die alle vom gleichen Virusstamm des oben erwähnten Gießener Ausbruchs infiziert worden waren, wurden 5 Jahre beobachtet. Aus den Familien der Kinder wurden in dieser Zeit 11 akute Hepatitis-B-Erkrankungen gemeldet, da meist nur die Eltern oder Geschwister, nicht aber andere Verwandte und enge Freunde geimpft wurden. Unter den rund 600 Klassenkameraden wurde in 5 Jahren nur eine Übertragung bekannt, die mutmaßlich durch intensives Küssen während einer Klassenfahrt zustande kam. Restriktionen in Normalschulen sind also unnötig.
Pflegeheime. Unterschätzt wurde möglicherweise die Übertragungsgefahr in Pflegeheimen. Ältere oder chronisch kranke Personen benötigen häufiger Blutuntersuchungen z. B. bei Diabetikern und Körperpflegemaßnahmen wie Fußpflege, die bei fehlerhafter Hygiene zur Übertragung von Patient zu Patient führt (s. o.). Aufnahmeuntersuchungen der Heimbewohner und eine bessere Schulung sowie Impfschutz des Personals könnten als mögliche Maßnahmen erwogen werden.
Freizeitbeschäftigungen und Lebensstil. Ein oft diskutiertes Thema ist, wie infektiös eingetrocknetes Blut eines Virusträgers ist, z. B. wenn Kinder in Parks oder gar auf Spielplätzen sich an benutzten Spritzennadeln stechen. Schimpansenversuche mit 106 ID50 in 0,1 ml 1:10 verdünntem eingetrocknetem Plasma zeigten, dass Eintrocknen und eine Woche lagern bei Raumtemperatur die Infektiosität von HBV nicht wesentlich verringert. Allerdings wurde die eingetrocknete Probe 20 min mit 1ml physiologischer Salzlösung 10 min wieder aufgelöst und diese Probe den Schimpansen intravenös verabreicht (Bond et al. 1983). In der Praxis dürfte die Inokulation durch z. B. durch einen Stich mit einer trockenen, blutkontaminierten Nadel deutlich weniger effizient sein. Aber mit einer Übertragung muss zumindest dann gerechnet werden, wenn das Blut von einem hochvirämischen Träger stammte. Insgesamt ist die Gefahr wohl eher gering. Ein Bericht aus Georgien (Butsashvili et al.2011) fand bei 33 Personen, die sich mit im Freien herumliegenden Spritzen verletzten, keine HIV- oder HCV-Infektion und nur eine HBV-Infektion, die aber mutmaßlich von einem infizierten Familienmitglied stammte.
HBV-Übertragungen durch sportliche Aktivitäten werden für sehr selten gehalten und finden eher „off-the-field“ statt (Mast et al. 1995; Schöffl et al. 2011). Iranische Ringer waren nicht signifikant häufiger Anti-HBc positiv als Sportler, bei denen weniger Körperkontakt besteht (Kordi et al. 2011). Ein in den 1970er Jahren berichteter Vorfall, der aber auch heute noch passieren könnte, war die Infektion mehrerer Mitglieder einer Pfadfindergruppe, die alle den gleichen dornenreichen Wanderpfad nach einem HBV-Träger begangen hatten.
Tätowierung und Piercing können zur Übertragung führen. Ein nicht mehr sehr verbreiteter Brauch ist die „Blutsbrüderschaft“, der aber sehr effizient zu einer Übertragung führt.
Unfälle und Straftaten. Die Gefährdung von Polizisten, Ersthelfern und Gefängnispersonal ist anerkannt. Die Möglichkeit einer HBV-Übertragung bei Explosionen und Massenunfällen hat Eingang in entsprechende Empfehlungen gefunden (Chapman et al. 2008). In der Tat wurde kürzlich eine Übertragung zwischen Opfern einer Explosion auf einem Schiff mit Asylsuchenden beschrieben (Italiano et al. 2011). In Israel werden überlebende Opfer von Selbstmordattentaten regelhaft gegen Hepatitis B geimpft, da in den Überresten eines Täters HBsAg gefunden wurde (Eshkol und Katz 2005) sowie in einem dokumentierten Fall durch penetrierende Knochensplitter bei einem HBV-infizierten Attentäter Opfer infiziert wurden (Braverman et al. 2002).
Stabilität von HBV und Desinfektion
HBV verträgt Eintrocknen und ist auch relativ hitzestabil. Pasteurisieren, d. h. Erhitzen auf 60°C für 10 h reduziert die Infektiosität nur um den Faktor 104. Erhitzen auf 100° inaktiviert aber innerhalb einer Minute HBV vollständig. Die exakte Validierung von Desinfektionsmitteln ist heute schwierig, da die Infektiosität nur in kaum verfügbaren Tiermodellen gemessen werden kann (s. o.). In den 1980er Jahren wurde im Schimpansenversuch die Wirksamkeit der wichtigsten Desinfektionsmittel auch auf eingetrocknetes Blutplasma nachgewiesen (Bond et al. 1983). Ein Ersatzparameter für die Infektiosität ist die Integrität der HBV-DNA, die mittels PCR sehr empfindlich gemessen werden kann (Jursch et al. 2002), Diese Verfahren täuscht jedoch vielleicht eine zu hohe Tenazität vor und somit werden unnötig scharfe Desinfektionsbedingungen ermittelt.
Ein mehrfach eingesetztes Modellvirus ist das verwandte Enten-HBV (DHBV, D für Duck), das sowohl in Entenbruteiern als auch in Entenleberzellkulturen empfindlich nachgewiesen werden kann (Sauerbrei et al. 2005). Noch nicht publizierte Vergleiche der Autoren zwischen DHBV und humanem HBV zeigen, dass beide Viren eine ähnliche Tenazität haben und auch gegen Mittel mit beschränkter Viruzidie empfindlich sind. Da der Lipidgehalt der HBV-Hülle für die Infektiosität essenziell ist (Bremer et al. 2009) sind detergenzienhaltige Mittel zur Desinfektion geeignet. Entscheidend ist, dass das Desinfektionsmittel auch das Innere von gröberen Verunreinigungen (geronnenes Blut, Gewebestückchen) erreicht und nicht von den großen Proteinmengen des Bluts oder des Gewebes abgebunden wird. Daher sollte immer vor oder zumindest gleichzeitig mit der Desinfektion eine Reinigung der zu desinfizierenden Gegenstände erfolgen.
Bedeutung der Therapie
Die antivirale Therapie ist eine Möglichkeit, die Infektiosität eines HBV-Trägers wesentlich zu verringern. Das erste verfügbare Mittel Lamivudin war eher mäßig wirksam und von rascher Resistenzentwicklung begleitet, wenn die anfängliche Viruskonzentration sehr hoch war. Das nächste Mittel Adefovir war insgesamt relativ unwirksam. Übertragungen von resistenten HBV-Mutanten sind vereinzelt beschrieben worden, jedoch scheint die Infektiosität der Varianten geringer als die des entsprechenden Wildtyps zu sein (Billioud et al. 2012). Die neueren Mittel Entecavir und Tenofovir bewirken bei den meisten Patienten schon nach wenigen Wochen oder Monaten ein Absinken der Viruslast unter die Nachweisgrenze der Real-Time-PCR. Bei einigen Patienten bleibt die Viruslast bei Werten um 104 Genomen/ml, was aber nur noch einer geringen Übertragungsgefahr entspricht. Resistenzen sind bei Tenofovir bislang kein Problem, bei Entecavir nur, wenn vorher eine Lamivudin-Resistenz bestand. Ein generelles Problem ist, dass die Therapie meist auf Dauer genommen werden muss und nur bei Verschwinden auch des HBsAg ein Absetzen erwogen werden kann. Eine echte Ausheilung der chronischen Hepatitis B kann jedoch nur mit der Beseitigung der HBV-infizierten Leberzellen durch ein aktives Immunsystem erfolgen. Dieses Ziel kann bei geeigneten Patienten mit einer 6-12 monatigen Interferon-Therapie (heute bevorzugt mit pegyliertem Interferon) angestrebt werden. Die Erfolgsaussichten auf dauerhafte Heilung liegen 6 Monate nach Therapie-Ende bei ca. 30 %.
Schutzwirkung der Impfung
Die Prävalenz und Inzidenz der Hepatitis B hat weltweit und insbesondere auch in Deutschland stark abgenommen. Dies ist nicht nur, aber zu einem wesentlichen Teil der Hepatitis-B-Impfung zu verdanken. Die Schutzwirkung ist allerdings nur gegeben, wenn der Geimpfte in den Wochen nach der letzten Dosis eine sicher nachweisbare Menge an Anti-HBs, per Definition >10 IU/L, gebildet hat. Eine schwache Anti-HBs Antwort wird bei folgenden Faktoren gefunden: männliches Geschlecht, Übergewicht, fortgeschrittenes Alter, Rauchen, Diabetes, HIV-Infektion. Hier sind Kontrollen und weitere Impfungen doppelt wichtig. Jedoch wird die Nachkontrolle oft versäumt. Um auf der sicheren Seite zu sein, empfiehlt man für Personen mit erhöhtem Risiko eine baldige Wiederimpfung bei Werten <100 IU/L (Epidem Bull 2010/30).
Ein späterer Abfall des Anti-HBs wäre an sich unbedenklich, da bei Exposition die dann resultierende okkulte HBV-Infektion zu einer Boosterung des Anti-HBs ohne klinische Erkrankung führt (Stramer et al. 2011). Es gibt jedoch Hinweise, dass auch diese OBI persistieren und reaktivieren kann bis hin zur maximalen Virämie. Ein vollständiger Schutz auch gegen OBI wäre wünschenswert und erreichbar. Gegen den homologen Genotyp des Impfstoffs A2 schützen schon 10 IU/L Anti-HBs vollständig, für die weltweit hundertmal häufigeren anderen Genotypen sind mutmaßlich >100 IU/L erforderlich (Stramer et al. 2011). Wiederimpfungen bei abgesunkenen Anti-HBs-Werten sind also für Personen mit erhöhtem Risiko sinnvoll, wenn auch international nicht empfohlen. Eine Nachbesserung des Impfstoffs wäre eine Option (Gerlich und Glebe 2010). Mit optimierten Hepatitis-B-Impfungen wäre mutmaßlich eine Eradikation der Hepatitis B erreichbar. Bis dahin müssen Prävention und Therapie die Infektiosität weiter eindämmen.
1 Leider hat sich international die direkte Molekül-Zahl als Mengenangabe nicht durchgesetzt, da in einem früheren Ringversuch viele Teilnehmer Schwierigkeiten hatten, die Anzahl der HBV-DNA Moleküle richtig zu bestimmen. Stattdessen wurde eine willkürliche International Unit (IU) definiert (Saldanha et al., 2001) und ein WHO-Standardpräparat bereitgestellt (Bayliss et al, 2008). Je nach Testverfahren entspricht eine IU 3 bis 7 HBV-DNA Molekülen. Wir empfehlen bei Fehlen klarer Angaben den Wert 5. Inzwischen gibt es käufliche, gut reproduzierbare Testkits und sogar internationale Standardproben für die verschieden Genotypen des HBV. In einem internationalen Ringversuch war die Standardabweichung zwischen den Testergebnissen der Teilnehmer für die Genotypen A1 bis G kleiner als 0,3 log10 (Chudy et al. in Vorbereitung)
2 Eine Internationale Einheit (Unit) HBsAg entspricht etwa 1,2 ng HBsAg-Protein bzw. Einheiten des Paul-Ehrlich-Instituts, wenn es in nativer Form vorliegt. Da von verschiedener Seite die Nanogramm-Einheiten auf alteriertes HBsAg mit unterschiedlicher Restaktivität bezogen wurden, gab es keine Einheitlichkeit und die Notwendigkeit IU/ml zu definieren (Schüttler et al. 2010).
3 Anzumerken ist, dass in dieser Phase der Infektion der HBsAg-Test trotz der an sich sehr niedrigen Nachweisgrenze von <0,02 IU/ml erst 4-6 Wochen (manchmal erst Monate) später positiv wird, da eine optimale PCR rund 100.000 Mal empfindlicher HBV-Partikel entdeckt.
4 Die Häufigkeit der Mutter-Kind-Übertragung ist regional sehr unterschiedlich. Die HBV-Genotypen B und C Ostasiens bleiben bis in das gebärfähige Alter HBeAg-positiv und hochvirämisch, die Genotypen D und E in Afrika und dem Mittelmeerbereich werden dagegen meist schon im Kindes- oder Jugendalter HBeAg-negativ. Dementsprechend ist die Übertragung in Ostasien vorwiegend vertikal, in Afrika und dem Mittelmeerraum vorwiegend horizontal im Kindesalter (Hadziyannis 2011).
5 Für Kontrastmittel gibt es eine Ausnahme, jedoch müssen diese Mittel mit
einem validierten Rückfluss-
sicheren Injektionssystem verabreicht werden.





