Alexander Zipprich
und Matthias Dollinger, Halle
Hepatitis
C – die vernachlässigten Genotypen
Weltweit leiden etwa 3% der Bevölkerung oder etwa 220 Millionen Menschen unter einer Hepatitis C.1 Sechs Genotypen sowie zahlreiche Subtypen des Hepatitis C-Virus wurden bisher identifiziert2, von klinischer Bedeutung für die westlichen Industrieländer sind jedoch vorrangig die ubiquitär vorkommenden Genotypen 1, 2 und 3. Entsprechend befasst sich der Großteil der verfügbaren Publikationen und damit auch der veröffentlichten Leitlinien mit der Diagnose und Therapie dieser 3 Genotypen.3 Die verbleibenden Genotypen 4, 5 und 6 betreffen weltweit jedoch mehr als 20% aller Patienten, vorrangig in Afrika (HCV-4/HCV-5) und Asien (HCV-6). Auf Grund der zunehmenden Migration von infizierten Patienten aus den betroffenen Ländern in die Industrienationen und der Übertragung auch seltener Genotypen über intravenösen Drogenkonsum4 ist es daher nur eine Frage der Zeit, wann auch in deutschen Praxen der behandelnde Arzt mit einem dieser „seltenen“ Genotypen konfrontiert wird.
Epidemiologie
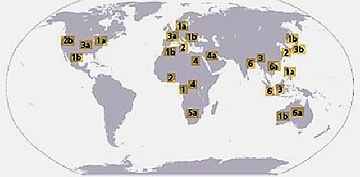
Abb. 1: Verteilung der HCV-Genotypen
In Ägypten findet sich mit ca. 15% die höchste HCV-4-Prävalenz weltweit, 90% aller Infektionen sind auf diesen Genotyp zurückzuführen. Ursache für die hohe Kontaminationsrate mit dem Virus war ursprünglich die bis in die 80er Jahre des vorigen Jahrhunderts weit verbreitete intravenöse Therapie der Bilharziose mittels Antimonsalzen.5 Mittlerweile ist die häufigste Ursache der Übertragung ein paramedizinischer Eingriff mit Hilfe nicht sterilisierter Instrumente in der armen Bevölkerung.6 Eine Übertragung durch Blutprodukte spielt seit dem Beginn der serologischen Überwachung medizinischer Blutprodukte in Ägypten nur noch eine geringe Rolle, ganz im Gegensatz zu Ländern der Sub-Sahara wie Sudan, Kenia oder dem Kongo. Zwischen 36 und 100% aller Infektionen werden hier durch HCV-4 verursacht, häufig übertragen auch bei rituellen Praktiken wie Zirkumzision und Skarifizierung. In Nordafrika (außer Ägypten) sind 5-11% aller Hepatitis C-Fälle auf das HCV-4 zurückzuführen und zunehmend breitet sich das Virus auch auf die europäischen Anrainerstaaten des Mittelmeeres und darüber hinaus aus. In Italien, Frankreich, Griechenland, Spanien und sogar Belgien sind bereits 10-24% der Patienten mit diesem Genotyp infiziert. Hauptübertragungsweg bei Europäern ist dabei der intravenöse Drogenkonsum.7 Vergleichbar mit Nord- und Südamerika, Australien und Südostasien gehört Deutschland mit ca. 3% der Infektionen noch zu den Ländern mit niedriger Prävalenz.8
Die Variabilität des HCV ist auch im Vergleich zu anderen einzelsträngigen RNA-Viren verhältnismäßig hoch. So finden sich auf Genomebene beim Vergleich verschiedener Isolate bis zu 40% Abweichungen. Daher wird das HCV in sechs Genotypen (1-6) unterteilt, wobei ein einheitlicher Genotyp vereinbarungsgemäß mindestens 72% Übereinstimmung auf Aminosäureebene besitzen muss. Diese Genotypen werden weiter in 30 Subtypen (1a, 1b, 3a usw.) untergliedert, wobei die Homologie auf Aminosäureebene 73 bis 86% innerhalb der Subtypen beträgt.
Aufgrund der Leseungenauigkeit der viralen RNA-Polymerase mit einer Mutationsrate von 10-5 bis 10-4 pro Nukleotid und Replikation, entwickeln sich in einem infizierten Wirt weitere Abweichungen von der ursprünglichen Sequenz, die man als Quasispezies bezeichnet. Die schnelle Entstehung dieser Quasispezies wird mit der Fähigkeit des HCV in Verbindung gebracht, eine chronische Infektion zu verursachen. Dabei weichen die ständig auftauchenden Varianten (ähnlich der HIV-Infektion) dem Zugriff des Immunsystems aus; dieser Mechanismus wird auch Immunevasion genannt.
Das HCV-5 wurde bis vor kurzem ausschließlich in Südafrika vermutet, dort verursacht es 40% der Hepatitis C-Erkrankungen und wird vorrangig bei Bluttransfusionen übertragen.9 Überraschenderweise wurden aber in Belgien (Westflandern), Frankreich (Clermont-Ferrand) und Syrien (Aleppo) drei Virusstämme entdeckt, die sich laut phylogenetischer Studien seit mindestens 120 Jahren unabhängig von Südafrika entwickelten und auf einen möglichen gemeinsamen Ursprung in den ehemaligen belgischen und französischen Kolonien Zentralafrikas hindeuten. In den nicht-afrikanischen Ländern ist die Verbreitung des HCV-5 auf einige wenige Städte und Landstriche beschränkt, zumindest in Frankreich konnte die Übertragung auf die medizinische Praxis eines bis 1972 praktizierenden Hausarztes zurückgeführt werden. Das HCV-6 schließlich ist in Südostasien einschließlich Hong Kong sowie bei asiatischen Einwanderern in Nordamerika und Australien verbreitet.10 Die Übertragung erfolgt je nach geographischer Lage am ehesten über Blutprodukte, iatrogen bei medizinischen Eingriffen oder bei intravenösem Drogenkonsum.11 Beide Genotypen – HCV-5 und HCV-6 – sind in Deutschland nur bei 0,1% der Hepatitis C Patienten zu finden.8
Natürlicher Verlauf
Die spontane Ausheilungsrate der Genotyp 4
HCV-Infektion reicht von 20% bis 50%. Die natürliche Progression der Erkrankung
mit einer Zunahme der Fibrose ist vergleichbar der Genotypen 1 bis 3.12
Patienten mit Schistosomiasis oder anderen Ko-Infektionen zeigen höhere
Fibroserate. Weiterhin ungünstige Faktoren für den schnelleren Progress der
Fibrose waren die Zugehörigkeit zur ägyptischen Bevölkerung, ein ausgiebiger
Alkoholgenuss und eine vorhandene Insulinresistenz.13 Die Infektion
mit dem Genotyp 5 betrifft überwiegend Frauen. Zudem wird die Erstdiagnose
häufig erst spät gestellt und die Patienten weisen eine hohe Viruslast auf.
Dementsprechend besteht bei vielen Patienten bereits eine Leberzirrhose zum
Zeitpunkt der Diagnose.3 Für den natürlichen Verlauf des Genotyps 6
existiert lediglich eine vergleichende Studie mit dem Genotyp 1.11
In dieser Studie konnten keine
Unterschiede zwischen den
Genotypen 1 und 6 bezüglich der Erhöhung der Leberenzyme, der Höhe der
HCV-RNA-Titer, des Risikos zur Entwicklung von Komplikationen der Zirrhose und
des Risikos zur Entwicklung eines HCC gefunden werden.
Therapie

Abb. 2: In Ägypten ist der HCV-Genotyp 4 weit verbreitet durch unsterile Spritzen und Beschneidung.
Während Daten für die Progression der akuten
HCV-Genotyp 5- und HCV-Genotyp 6-Infektion zur chronischen Verlaufsform fehlen,
nimmt eine akute Hepatitis C bei HCV-Genotyp 4-Infektion in 50-80% der Fälle
eine chronische Verlaufsform an, bei Ko-Infektion mit HIV oder Pärchenegeln
(Schistosoma mansoni) noch häufiger.14 Analog zu anderen Genotypen
sollte daher bei persistierend virämischen Patienten (HCV-4/-5/-6) innerhalb
der
ersten 3-4 Monate nach
Krankheitsbeginn eine antivirale Therapie mittels pegyliertem Interferon für 24
Wochen durchgeführt werden.15
Die Datenlage zur Behandlung der chronischen Verlaufsform ist vergleichsweise umfangreicher, allerdings ist auch hier weitaus mehr Literatur zur Behandlung der chronischen HCV-Genotyp 4-Infektion vorhanden. Die publizierten Daten zur Behandlung der Genotypen 5 und 6 genügen dagegen nur den Mindestanforderungen für generelle Empfehlungen. Grundsätzlich sollte die chronischen Infektion mit einer der drei Genotypen analog zu den Empfehlungen bei den ubiquitär vorkommenden Genotypen 1 bis 3 mittels pegyliertem Interferon und einer Standarddosis von Ribaverin behandelt werden.16
Der Genotyp 4 zählt, im Gegensatz zu den anderen beiden hier ausgeführten Genotypen, zu den schwerer therapierbaren Formen. Daher wird im Allgemeinen eine Therapiedauer von 48 Wochen im Falle einer HCV-4-Genotyp-Infektion empfohlen. Damit lässt sich eine frühe Viruselimination (early virological response; EVR) in etwa 65% der Therapien erreichen. Die EVR, definiert als Abfall um ≥2Log-10 bzw. einer kompletten Viruselimination innerhalb von 12 Wochen nach Therapiestart, hat dabei einen sehr guten positiven (72%) und negativen prädiktiven (96%) Wert für ein dauerhaftes Therapieansprechen.13 Weiterhin scheint, ähnlich wie im Genotyp 1, eine Therapieverkürzung auf 24 Wochen bei Patienten mit einem sehr raschen Ansprechen (definiert als Virus-elimination innerhalb der ersten 4 Wochen nach Therapiebeginn; RVR) möglich.17 Die dauerhafte Viruselimination (sustained virological response; SVR) wird in maximal 50 bis 60% erreicht.18 Allerdings sind dauerhafte Erfolgsraten abhängig von mehreren Risikofaktoren wie Fibrose, Insulinresistenz oder ägyptische Herkunft.13 Auch Ko-Infektionen mit HI-Virus verringern die Ansprechraten auf etwa 30%.19, 20

Abb. 3: Heute werden alle Blutkonserven auf Hepatitis C untersucht .
Fünf retrospektive nicht-randomisierte Studien beschäftigten sich bisher mit der Therapie des HCV-Genotyps 5. Aufgrund dieser limitierten Datenlage und der unterschiedlichen Therapieregime in den Studien sind fundierte Empfehlungen nicht möglich. Die Erfolgsraten von Interferon und pegyliertem Interferon (plus Ribaverin) unterscheiden sich bisher bei diesem Genotyp nicht signifikant von einander.21 Eine frühe Viruselimination (EVR) wird mit einer Therapie von pegyliertem Interferon in fast 100% der Fälle erreicht und auch die dauerhafte Viruselimination (SVR) ist in mehr als 2/3 der Fälle sehr hoch.16, 18, 22 Obwohl eine Studie vergleichbare SVR nach Therapieverkürzung von 48 Wochen auf 24 Wochen gezeigt hat, muss dies jedoch nach neueren Daten nochmals verifiziert werden.23
Die Datenlage zur Therapie des HCV Genotyp 6 ist ähnlich limitiert, allgemeine Empfehlungen lassen sich nur eingeschränkt erstellen. Die Therapie wurde in den meisten Studien mit pegyliertem Interferon und Ribaverin in Standarddosis durchgeführt. Die in den Studien angegebenen SVR-Raten schwanken zwischen 60 bis 90%.3 Diese guten Ansprechraten wurden im Wesentlichen mit einer Therapiedauer von 48 Wochen erzielt, so dass eine Verkürzung der Therapie anhand dieser Daten nicht empfohlen werden kann.24
Fazit für die Praxis
In Deutschland sind die meisten Hepatitis C-Infektionen durch die ubiquitär vorkommenden Genotypen 1 bis 3 verursacht. Die restlichen Genotypen 4 bis 6 spielen mit einer Infektionsrate von 3% nur eine untergeordnete Rolle. Weltweit sind die letzteren Genotypen aber für 20% der Hepatitis C-Infektionen verantwortlich und die Ausbreitung der ursprünglich vorwiegend in Afrika und Asien vorkommenden Genotypen nach Europa ist bereits erfolgt. Die Therapie der durch die Genotypen 4 bis 6 verursachten Hepatitis sollte sowohl bei der akuten als auch bei der chronischen Verlaufsform entsprechend den bekannten Kriterien der bei uns häufiger vorkommenden Genotypen durchgeführt werden (siehe AWMF-Leitlinie „Prophylaxe, Diagnose und Therapie der Hepatitis-C-Virus-Infektion.“). Bei der akuten Hepatitis sollte bei persistierend virämischen Patienten innerhalb der ersten 3-4 Monate nach Krankheitsbeginn eine antivirale Therapie mittels pegyliertem Interferon für 24 Wochen durchgeführt werden. Die Therapie der chronischen Hepatitis sollte bei allen drei Genotypen mittels pegyliertem Interferon und Ribaverin durchgeführt werden. Die Therapiedauer der seltenen Genotypen unterscheidet sich dabei nicht wesentlich von der Therapie des Genotypen 1 und sollte normalerweise 48 Wochen betragen. Damit lassen sich dauerhafte Erfolgsraten von etwa 50% (Genotyp 4) bis annähernd 90% (Genotyp 6) erzielen.
literatur
1 Mihm, S., Hepatitis C virus, diabetes and steatosis: clinical evidence in favor of a linkage and role of genotypes. Dig Dis, 2010. 28(1): p. 280-4.
2 Simmonds, P., et al., Consensus proposals for a unified system of nomenclature of hepatitis C virus genotypes. Hepatology, 2005. 42(4): p. 962-73.
3 Antaki, N., et al., The neglected hepatitis C virus genotypes 4, 5 and 6: an international consensus report. Liver Int, 2010. 30(3): p. 342-55.
4 Esteban, J.I., S. Sauleda, and J. Quer, The changing epidemiology of hepatitis C virus infection in Europe. J Hepatol, 2008. 48(1): p. 148-62.
5 Frank, C., et al., The role of parenteral antischistosomal therapy in the spread of hepatitis C virus in Egypt. Lancet, 2000. 355(9207): p. 887-91.
6 Lavanchy, D., The global burden of hepatitis C. Liver Int, 2009. 29 Suppl 1: p. 74-81.
7 Roulot, D., et al., Epidemiological characteristics and response to peginterferon plus ribavirin treatment of hepatitis C virus genotype 4 infection. J Viral Hepat, 2007. 14(7): p. 460-7.
8 Huppe, D., et al., [Epidemiology of chronic hepatitis C in Germany--an analysis of 10,326 patients in hepatitis centres and outpatient units]. Z Gastroenterol, 2008. 46(1): p. 34-44.
9 Verbeeck, J., et al., Investigating the origin and spread of hepatitis C virus genotype 5a. J Virol, 2006. 80(9): p. 4220-6.
10 Nguyen, M.H. and E.B. Keeffe, Prevalence and treatment of hepatitis C virus genotypes 4, 5, and 6. Clin Gastroenterol Hepatol, 2005. 3(10 Suppl 2): p. S97-S101.
11 Seto, W.K., et al., Natural history of chronic hepatitis C: genotype 1 versus genotype 6. J Hepatol, 2010. 53(3): p. 444-8.
12 Kamal, S.M., et al., Progression of fibrosis in hepatitis C with and without schistosomiasis: correlation with serum markers of fibrosis. Hepatology, 2006. 43(4): p. 771-9.
13 Moucari, R., et al., Insulin resistance and geographical origin: major predictors of liver fibrosis and response to peginterferon and ribavirin in HCV-4. Gut, 2009. 58(12): p. 1662-9.
14 Kamal, S.M., et al., Acute hepatitis C without and with schistosomiasis: correlation with hepatitis C-specific CD4(+) T-cell and cytokine response. Gastroenterology, 2001. 121(3): p. 646-56.
15 Sarrazin, C., et al., [Prophylaxis, diagnosis and therapy of hepatitis C virus (HCV) infection: the German guidelines on the management of HCV infection]. Z Gastroenterol, 2010. 48(2): p. 289-351.
16 Yu, M.L. and W.L. Chuang, Treatment of chronic hepatitis C in Asia: when East meets West. J Gastroenterol Hepatol, 2009. 24(3): p. 336-45.
17 Ferenci, P., et al., Peginterferon alfa-2a and ribavirin for 24 weeks in hepatitis C type 1 and 4 patients with rapid virological response. Gastroenterology, 2008. 135(2): p. 451-8.
18 Legrand-Abravanel, F., et al., Influence of the HCV subtype on the virological response to pegylated interferon and ribavirin therapy. J Med Virol, 2009. 81(12): p. 2029-35.
19 Soriano, V., et al., Response to interferon-based therapies in HIV-infected patients with chronic hepatitis C due to genotype 4. Antivir Ther, 2005. 10(1): p. 167-70.
20 Martin-Carbonero, L., et al., Response to pegylated interferon plus ribavirin in HIV-infected patients with chronic hepatitis C due to genotype 4. J Viral Hepat, 2008. 15(10): p. 710-5.
21 Bonny, C., et al., Effectiveness of interferon plus ribavirin combination in the treatment of naive patients with hepatitis C virus type 5. A French multicentre retrospective study. Aliment Pharmacol Ther, 2006. 24(4): p. 593-600.
22 Legrand-Abravanel, F., et al., Hepatitis C virus genotype 5: epidemiological characteristics and sensitivity to combination therapy with interferon-alpha plus ribavirin. J Infect Dis, 2004. 189(8): p. 1397-400.
23 Nieuwoudt, M., et al., Viral kinetics of HCV genotyp 5 in South Africa patients treated with pegylated-interferon-alpha and ribaverin. Hepatology, 2007. 46: p. 367A.
24 Antaki, N. and P. Marcellin, What is the safe duration of therapy for patients infected with HCV genotype 6? Nat Clin Pract Gastroenterol Hepatol, 2009. 6(2): p. 78-9.





