Florian van Bömmel
und Thomas Berg, Leipzig
HBV-Genotypen
– ein zusätzlicher Parameter für die Indikationsstellung zur Therapie?
HBV-Genotypen zeigen eine typische regionale Verteilung. Während in Nordeuropa der Genotyp A und im Mittelmeerraum der Genotyp D vorherrschen, finden sich in Ostasien die Genotypen B und C und in Zentralafrika der Genotyp E. Genotyp F kommt in Südamerika vor. Für die Genotypen G und H bestehen bislang nur wenige Beschreibungen, ihr geographisches Verteilungsmuster ist unklar (Tab. 1). Die kürzlich beschriebenen Genotypen I und J wurden bislang nur in wenigen Patienten in Asien gefunden und wurden zunächst nur provisorisch anerkannt, da es sich hierbei möglicherweise um Rekombinanten von Hepatitis-B-Viren verschiedener Primaten handelt.
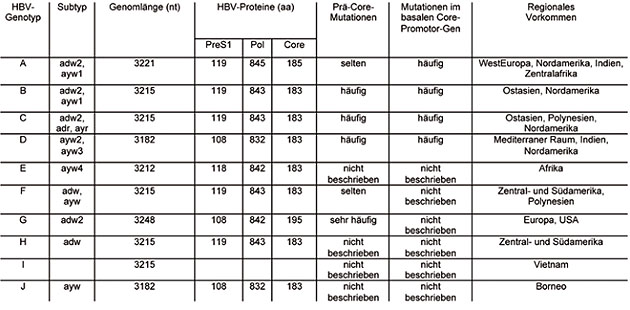
Tab. 1: Weltweites Vorkommen und molekulare Charakteristika der Genotypen von HBV (nach Locarnini 2008). 1 nt = nucleotide; aa = amino acid
Molekularbiologische Unterschiede
Die Genotypen von HBV sind durch einen Gesamtunterschied ihres Genoms von >8% definiert. Einige Genotypen besitzen innerhalb ihres Genoms spezifische Insertionen und Deletionen. So besitzt beispielsweise der Genotyp A eine Insertion von 6 Basenpaaren (nt) in der terminalen Proteinregion, während der Genotyp D eine characteristische Deletion von 33 Basenpaaren in der „Spacer“-Region des Polymerasegens und Genotyp E eine 36 Basenpaare große Deletion im Bereich des Core-Gens besitzt. Die genomischen Unterschiede spiegeln sich auch in einer unterschiedlichen Replikation des Hepatitis B-Virus wieder: so kommen bei den Genotypen A, B, C und D häufig Mutationen im basalen Core-Promotor vor (nt A1726T und nt 1764), welche die Produktion von HBeAg senken und die Replikationsrate des Virus erhöhen.1
Einfluss des HBV Genotyps auf den natürlichen Krankheitsverlauf
Ein möglicher Zusammenhang zwischen den HBV-Genotypen und dem klinischen Verlauf von HBV-Infektionen wurde seit ihrer Entdeckung erforscht. Hierbei ist ein direkter Vergleich aller Genotypen aufgrund ihres regional begrenzten Vorkommens sowie aufgrund unterschiedlicher Lebensumstände und Begleiterkrankungen der Betroffenen in den verschiedenen Regionen schwierig. Vergleichsstudien mit regional parallel vorkommenden HBV-Genotypen deuten darauf hin, dass HBV-Infektionen mit dem Genotyp A im Vergleich zu Genotyp D eine höhere spontane Ausheilungsrate besitzen und seltener mit einer Entwicklung zur Leberzirrhose assoziiert sind (33). Ein in Afrika vorkommender Sub-Genotyp, der Genotyp A1 scheint jedoch im Vergleich zu anderen in der Region vorkommenden Genotypen mit einer deutlich erhöhten Wahrscheinlichkeit der Entwicklung eines hepatozellulären Karzinoms assoziiert zu sein.2 Ein Vergleich der Genotypen B und C hat in vielen Studien eine insgesamt ungünstigere Verlaufsform mit häufigerem Auftreten von Leberzirrhose und hepatozellulärem Karzinom beim HBV Genotyp C gezeigt, was möglicherweise mit der späteren HBeAg-Serokonversion und somit einer längeren replikativen Phase des Genotyp C erklärbar ist.3
Bedeutung des HBV-Genotypen für das Therapieansprechen
Nukleosid-/Nukleotidanaloga
In den meisten Studien wurde kein Zusammenhang mit dem Ansprechen auf Nukleosid-/Nukleotid-Analoga und dem HBV-Genotyp bezüglich der Suppression der HBV-DNA und der Häufigkeit von HBeAg-Verlusten bzw. -Serokonversionen gefunden. Das seltene Ereignis eines HBs-Ag-Verlustes oder einer HBsAg-Serokonversion scheint unter Behandlung mit Nukleosid-/Nukleotid-Analoga jedoch am häufigsten bei Genotyp A, deutlich seltener bei Genotyp D vorzukommen.4 Die Entwicklung von HBV-Resistenz gegen Lamivudin scheint ebenfalls durch den HBV-Genotyp beeinflusst zu sein. So konnte eine Metaanalyse von 79 Veröffentlichungen eine deutlich höhere Prävalenz der Mutation rtM204V bei Genotyp A gegenüber den Genotypen B, C und D zeigen, bei welchen häufiger die Mutation rtM204I mit Resistenzentwicklung assoziiert war.5 Die Selektion dieser Mutanten kann eine Konsequenz in der Langzeitbehandlung der Patienten haben, da sie eine Kreuzresistenz zu den moderneren Substanzen Entecavir bzw. Telbivudin vermitteln können. Womöglich besteht auch ein Einfluss des HBV-Genotyps auf die Resistenzentwicklung gegen weitere Therapeutika, was bislang jedoch nicht abschließend untersucht ist.
Standard-Interferon-alpha
In der Behandlung mit Interferon-a wurde in einer Metaanalyse von Wiegand und Mitarbeitern eine höhere Ansprechrate bei Patienten mit Genotyp A im Vergleich zu Genotyp D und für Genotyp C im Vergleich zu Genotyp B gefunden.6 Das offenbar bessere Ansprechen von Genotyp A zeigt sich deutlich in einer europäischen Studie wieder, in der Patienten mit Genotyp A im Vergleich zu Patienten mit Genotyp D zu Monat 6 nach Therapieende zu 46% bzw. 24% bei HBeAg-Positiven und zu 59% bzw. 29% bei HBeAg-Negativen ansprachen, was als eine Suppression der HBV-DNA <28 pg/ml, normale ALT-Werte sowie – bei HBeAg-positiven Patienten – ein HBeAg-Verlust definiert war.7
Pegyliertes(PEG)-Interferon-alpha
Bislang sind fünf große Studien publiziert worden, in denen der Einfluss des HBV-Genotyps auf das Ansprechen auf eine Behandlung mit PEG-Interferon untersucht wurde (Tab. 2).8-13 In der größten Studie mit HBeAg-positiven Patienten, in der Patienten der Genotypen A, B, C und D eingeschlossen wurden, fanden Lau und Mitarbeiter die höchste Rate an HBeAg-Serokonversionen bei Genotyp A mit 54%, gefolgt von Genotyp B, C und D mit 31%, 30% und 22%.9 In einer weiteren Studie mit Patienten mit verschiedenen Genotypen konnten Janssen und Mitarbeiter eine HBeAg-Verlustrate von 47% für Genotyp A und von 44%, 28% und 25% für die Genotypen B, C und D zeigen.10 Insgesamt fand sich eine höhere Rate der HBeAg-Serokonversion bei Genotyp A und die niedrigste bei Genotyp D. Die Genotypen B und C scheinen keine unterschiedlichen HBeAg-Verlustraten zu zeigen. Diese Beobachtung wird unterstützt durch eine kürzlich publizierte Studie mit 544 Patienten, bei denen eine 24- bzw. eine 48-wöchige Behandlung mit PEG-Interferon-a2a mit 90 oder 180 µg/Woche zu Woche 48 einen HBeAg-Verlust bei 36% bzw. 31% der Patienten mit Genotyp B bzw. Genotyp C zeigte.13 Auch bei HBeAg-negativen Patienten war in der Studie von Marcellin und Mitarbeitern die Rate des Ansprechens auf eine PEG-Interferonbehandlung, welches hierbei als dauerhafte Suppression der HBV-DNA <20.000 Kopien/ml und normale ALT definiert wurde, abhängig vom Genotyp.12
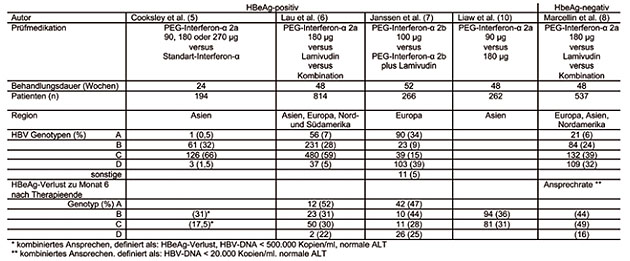
Tab. 2: Zusammenhang des HBV-Genotypen
und des Ansprechens auf Therapie mit PEG-Interferon-a bei HBeAg-positiven und –negativen
Patienten in randomisierten Studien
In einer kürzlich publizierten Metaanalyse von Erhard und Mitarbeitern wurde der Einfluss der HBV-Genotypen auf eine Standard-Interferon- bzw. PEG-Interferon-gestützte Behandlung untersucht, mit oder ohne Lamivudin, wofür sowohl Daten aus randomisierten Studien als auch Daten aus kleineren Studien verwendet wurden.14 Hierbei war der HBV-Genotyp in der multivariaten Analyse als Prädiktor für ein Therapieansprechen stärker als der HBeAg-Status, die Höhe der HBV-DNA, die Ethnizität der Patienten oder eine Leberzirrhose. Die höchste Rate mit dauerhaftem virologischen Ansprechen wurde wiederum für Genotyp A gefunden, gefolgt von Genotyp B, C und D. Sie betrug bei HBeAg-positiven Patienten 36%, 21%, 19% und 15% und bei HBeAg-negativen Patienten 34%, 32%, 50% und 21%.14
HBsAg-Verluste sind abhängig vom Genotyp
Wie in der Behandlung mit Nukleosid-/Nukleotidanaloga sind bei PEG-Interferon HBsAg-Verluste oder -Serokonversionen selten, scheinen jedoch auch hier bei Genotyp A häufiger vorzukommen. So konnte in einer Studie von Flink und Mitarbeitern eine HBsAg-Verlustrate von 14% bei Genotyp A gegenüber 9%, 3% und 2% bei Genotyp B, C und D nach 52 Wochen Therapie mit PEG-Interferon-a2a gefunden werden.15 Interessanterweise scheinen HBs Ag-Verluste nach Beendigung einer Therapie mit PEG-Interferon gehäuft aufzutreten und mit dem HBV-Genotyp assoziiert zu sein. So zeigte eine Studie, in der das Ansprechen 5 Jahre nach Beendigung einer Behandlung mit PEG-Interferon- a 2a ausgewertet wurde, eine HBsAg-Verlust-Rate bei Genotyp A von 20% gegenüber Genotyp B, C und D von 6%, 16% und 11%.16
Empfehlungen der Behandlungsrichtlinien
In den Leitlinien der drei großen Gesellschaften zur Behandlung von Leberkrankheiten, der AASLD, der APASL und der EASL wird keine Bestimmung des HBV-Genotyps zur Therapieentscheidung empfohlen, obwohl der Einfluss der Genotypen auf das Ansprechen auf eine antivirale Therapie diskutiert wird.17 Der Grund hierfür liegt in der Komplexität der HBV-Therapie, die für den Behandler möglichst umsetzbar sein soll, sowie in der eingeschränkten Verfügbarkeit der HBV-Genotypisierung. In einigen Europäischen Fachgesellschaften wie der Schwedischen, der Niederländischen und der Deutschen wird jedoch die HBV-Genotypisierung vor der Entscheidung zur Durchführung einer Interferon-basierten Therapie empfohlen, um den Behandlungserfolg besser vorhersagen zu können.18
Schlussfolgerung
Patienten mit HBV-Genotyp A haben eine erhöhte Wahrscheinlichkeit eines HBsAg-Verlustes während einer Therapie mit Nuk-leosid-/Nukleotid-Analoga und eines HBeAg- oder HBsAg-Verlustes während oder auch nach einer Therapie mit PEG-Interferon. Neue Studien haben jedoch gezeigt, dass der Abfall des HBsAg-Spiegels unter Behandlung mit PEG-Interferon bei HBeAg-positiven und -negativen Patienten möglicherweise ein stärkerer Prädiktor für ein Langzeitansprechen ist. Der HBV-Genotyp kann somit eine Entscheidungshilfe vor Einleitung einer Behandlung mit PEG-Interferon sein, Patienten mit anderen Genotypen sollten jedoch für diese Therapieform ebenfalls in Betracht gezogen werden. Ob der HBV-Genotyp durch die Erprobung neuer Therapieformen oder in der Langzeitbeobachtung nach Beendigung von Therapien eine größere Bedeutung zur Vorhersage von Therapieansprechen erlangen kann, muss in zukünftigen Studien geklärt werden.
literatur
1 Locarnini S. Molecular virology of hepatitis B virus. Semin Liver Dis. 2004;24 Suppl 1:3-10.
2 Kew MC, Kramvis A, Yu MC, Arakawa K, Hodkinson J. Increased hepatocarcinogenic potential of hepatitis B virus genotype A in Bantu-speaking sub-saharan Africans. J Med Virol 2005 Apr;75(4):513-521.
3 Livingston SE, Simonetti J, Bulkow L et al. Clearance of hepatitis B e antigen in patients with chronic hepatitis B and genotypes A, B, C, D and F. Gastroenterology 2007; 133:1452–1457.
4 Heathcote EJ, et al. AASLD 2010; Poster #477.
5 Damerow H, Yuen L, Wiegand J, Walker C, Bock CT, Locarnini S, Tillmann HL. Mutation pattern of lamivudine resistance in relation to hepatitis B genotypes: hepatitis B genotypes differ in their lamivudine resistance associated mutation pattern. J Med Virol. 2010;82:1850-8.
6 Wiegand J, Hasenclever D, Tillmann HL. Should treatment of hepatitis B depend on hepatitis B virus genotypes? A hypothesis generated from an explorative analysis of published evidence. Antivir Ther 2008; 13: 211–220.
7 Erhardt A, Blondin D, Hauck K. Response to interferon alpha is hepatitis B virus genotype dependent: genotype A is more sensitive to interferon than genotype D. Gut 2005; 54:1009–1013.
8 Cooksley WGE, Lai M-Y, Piratvisuth T et al. Peginterferon a- 2a (40 kDa): an advance in the treatment of hepatitis B e antigen-positive chronic hepatitis B. J Viral Hepat 2003; 10: 298–305.
9 Lau GKK, Piratvisuth T, Luo KX et al. Peginterferon alfa 2-a as monotherapy and in combination with lamivudine versus lamivudine monotherapy in patients with HBeAg positive chronic hepatitis B. N Engl J Med 2005; 352: 2682– 2695.
10 Janssen HLA, van Sonneveld M, Senturk H et al. Pegylated interferon alfa 2b alone or in combination with lamivudine for HBe antigen positive chronic hepatitis B: a randomised trial. Lancet 2005; 365: 123–129.
11 Chan HL, Leung NW, Hui AY et al. A randomised control-led trial of combination therapy for chronic hepatitis B : comparing Pegylated interferon alfa 2b and lamivudine with lamivudine alone. Ann Intern Med 2005; 142: 242–250.
12 Marcellin P, Lau GKK, Bonino F. Peginterferon alfa 2a alone, lamivudine alone, and the two in combination in patients with HBe antigen negative chronic hepatitis B. New Engl J Med 2004; 351: 1206–1217.
13 Liaw Y, Xie Q, Han K, Gane EJ, Piratvisuth T, McCloud PI, Wat C, Jia J. Shorter Duration and Lower Dose of Peginterferon Alfa-2a Therapy Results in Inferior Hbeag Seroconversion Rates Compared with the Duration and Dose of 48 Weeks and 180 µg: NEPTUNE Study. Hepatology 2010:52;429A.
14 Erhardt A, Ludwig AD, Brunetto M et al. HBV genotypes are the strongest predictors of response to interferon alpha treatment: multivariate evaluation in 1229 hepatitis B patients. Hepatology 2008;48: 700A-701A.
15 Flink HJ, van Zonneveld M, Hansen BE, de Man RA, Schalm SW, Janssen HL. Treatment with Peg- interferon alfa 2b for HBe antigen positive chronic hepatitis B: HBsAg loss is associated with HBV genotype. Am J Gastroenterol 2006;101:297-303.
16 Marcellin P, Piratvisuth T, Brunetto M et al. HBsAg clearance continues to increase after end of treatment with Pegasys +/- lamivudine: 5 year follow up study. Hepatol Int 2009:3;108.
17 European Association For The Study Of The Liver. EASL Clinical Practice Guidelines: Management of chronic hepatitis B. J Hepatol 2009;50:227-42.
18 M. Cornberg, U. Protzer, M. M. Dollinger, J. Petersen, H. Wedemeyer, T. Berg, W. Jilg, A. Erhardt, S. Wirth, P. Schirmacher, W. E. Fleig, and M. P. Manns. Prophylaxis, diagnosis and therapy of hepatitis b virus (hbv) infection: the german guidelines for the management of hbv infection. Zeitschrift für Gastroenterologie 2007;45:1281-1328.





