Chronische
Hepatitis B
Leitlinien
aktualisiert
Auf der Tagung des Kompetenznetz Hepatitis Anfang Juni wurde die Aktualisierung der Leitlinie zur chronischen Hepatitis B vorgestellt, diskutiert und abgestimmt. Die Veröffentlichung der Leitlinie ist Anfang 2011 geplant.
Testung
Die Empfehlungen zur Testung auf Hepatitis B wurden nicht geändert. Nach wie vor soll breit getestet werden, insbesondere auch Personen mit Migrationshintergrund aus Ländern mit erhöhter HBsAg-Prävalenz sowie Patienten vor bzw. während einer immunsuppressiven Therapie. So sollte bei allen Patienten vor einer Chemotherapie auf HBsAg und anti-HBc bestimmt werden.
Indikation
Die Indikation zur
antiviralen Therapie der Hepatitis B wurde den europäischen Empfehlungen
angepasst. Eine Therapie wird nun nicht nur bei einer mehr als zweifachen
Erhöhung der Transaminasen empfohlen,
sondern schon bei jeder erhöhten GPT. Patienten ohne erhöhte Transaminasen aber
mit extrahepatischen Manifestationen oder HCC-Risiko sollten ebenfalls
behandelt werden (Abb. 1).
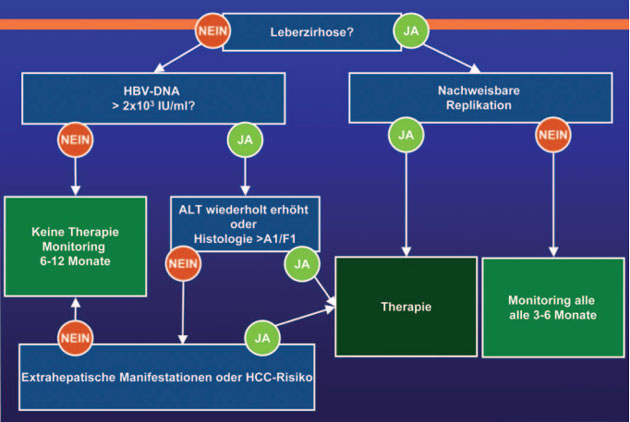
Abb. 1: Therapieindikation 2010/2011
Therapieziel
Das Ziel der Behandlung der chronischen Hepatitis B ist – wie bei fast allen Erkrankungen – die Morbidität und Mortalität zu senken. Dazu sollen die Surrogatmarker während und nach der Behandlung untersucht werden. Zielwerte wurden in den bisherigen Leitlinien nicht genannt. In neueren Studien hat sich nun gezeigt, dass die Senkung der HBV-DNA unter die Nachweisgrenze klinische Endpunkte, z.B. hepatozelluläre Karzinome, verhindern kann. Als Therapieziel wird daher neuerdings die Senkung der HBV-DNA unter die Nachweisgrenze genannt. Eine zweite Neuerung ist das „langfristige Ziel“ der immunologischen Kontrolle, d.h. der Serokonversion von HBs-Antigen zu Anti-HBs-Antikörpern.
Behandlung
Eine Interferon-Therapie über sechs bis 12 Monate kommt wie bisher bei günstigen Prädiktoren (mindestens 2fach erhöhte Transaminasen/ideal mindestens 5fach erhöhte Transaminasen, HB-Viruslast <108 IU/ml und Genotyp A) in Frage. Andere Genotypen sollen – und das ist neu – bei „zusätzlichen günstigen Faktoren eine Therapie nicht ausschließen“.
Bei den Nukleos(t)idanaloga wird bei Patienten ohne Leberzirrhose nach wie vor die Auswahl je nach Viruslast, Komorbidität und Vortherapie empfohlen. Bei der Leberzirrhose stehen Medikamente mit hoher Resistenzbarriere an erster Stelle, die Option einer Kombination ist weggefallen.
Im Hinblick auf das Therapieansprechen bzw. -versagen wurden die Empfehlungen deutlich konkretisiert. Zum einen wird bis zum virologischen Ansprechen nicht mehr sechs bis 12 Monate gewartet. Nach sechs Monaten sollte die HBV-DNA <200 IU/ml liegen und nach einem Jahr negativ sein, wobei die Viruslast unter Medikamenten mit hoher Resistenzbarriere kontinuierlich ohne Plateau abfallen sollte. Bei fehlendem Ansprechen sollte die Adhärenz überprüft und bei einem Anstieg der HBV-DNA unter Therapie von mehr als 1 log über dem Nadir die Behandlung „angepasst“ werden (Abb. 2).
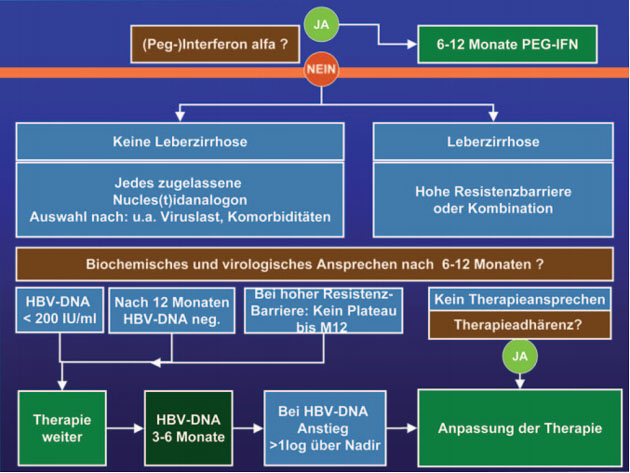
Abb. 2: Therapie 2010/2011
Schwangerschaft
Hier hat sich die antivirale Therapie in der Schwangerschaft durchgesetzt. Frauen mit hoher Viruslast sollten behandelt werden. Eine bestehende Therapie mit Lamivudin oder Tenofovir kann fortgesetzt werden. Entecavir oder Adefovir sollten dagegen auf Lamivudin bzw. Tenofovir umgestellt werden. Zu Tenofovir liegen gute Erfahrungen aus dem HIV-Schwangerschaftsregister vor. Zu Telbivudin, das eine Empfehlung der Klasse B in der Schwangerschaft hat, fehlen noch klinische Erfahrungen. Interferon alfa sollte in jedem Fall umgehend abgesetzt werden.
Reaktivierung
Schon immer galt die Empfehlung bei hochdosierter immunsuppressiver Therapie HBsAg-positive bzw. HBV-DNA-positive Patienten (okkulte Hepatitis B) mit Nukleos(t)idanaloga zu behandeln. HBs-Ag-negative, Anti-HBc-positive Patienten sollen engmaschig überwacht werden. Eine antivirale Therapie ist bei diesen Patienten lediglich im Fall einer Knochenmark- bzw. Stammzelltransplantation sowie bei Anstieg der HBV-DNA bzw. des Nachweises von HBsAg indiziert. Neu ist die Spezifizierung für die Therapie mit TNF-alpha-Blocker. Hier wurden schwer verlaufende Reaktivierungen beobachtet. Zu einer Empfehlung der Prophylaxe für alle Patienten hat die Evidenz aber nicht gereicht. Deshalb heißt es, dass HBsAg-negative, Anti-HBc-positive Patienten vor Therapie mit anti-CD20 Antikörpern (z.B. Rituximab) mit Nukleos(t)idanaloga behandelt werden können (Envidenzgrad C). Zudem wurde die Therapiedauer von bisher sechs Monaten auf „sechs besser 12 Monate“ verlängert.
Therapieende
Die chronische Hepatitis B
verläuft in zwei Phasen. Von der hochvirämischen HBeAg-positiven Hepatitis geht
die Erkrankung durch bessere immunologische Kontrolle in eine HBeAg-negative
Hepatitis. Diese wird schließlich vom Abwehrsystem komplett supprimiert, es
kommt zum HBsAg-Verlust mit Bildung von HBs-Antikörpern (Abb. 3).
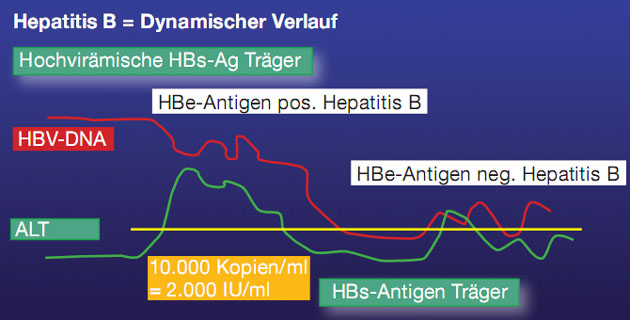
Abb. 3: Natürlicher Verlauf der chronischen Hepatitis B
In den Leitlinien wird nur
noch beim Beenden der Therapie, nicht mehr bei der Therapieindikation zwischen
HBeAg-positiver und –negativer Hepatitis B unterschieden. Bei HBeAg-positiver
Hepatitis kann die Behandlung nach Serokonversion von HBeAg zu anti-HBe beendet
werden, neuerdings aber erst „frühestens 12 Monate nach der Serokonversion und
bei negativer HBV-DNA“. Bei einer Anti-HBs-Serokonversion
wird die Therapie unabhängig vom anti-HBs-Titer beendet (Abb. 4).
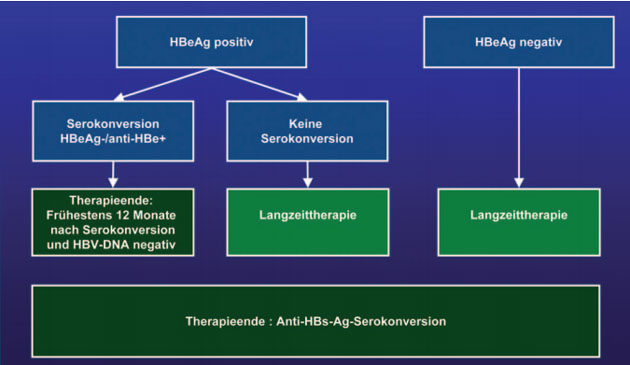
Abb. 4: Therapieende 2010/2011





