 44th
EASL, 22.-26.04.2009 in Kopenhagen, Dänemark
44th
EASL, 22.-26.04.2009 in Kopenhagen, Dänemark
Wegweisende Studien auf dem Internationalen Leberkongress
Die Tagung der EASL ist zum wichtigsten Hepatologie-Kongress geworden und zwar nicht nur weil es zahlenmäßig der größte Leberkongress ist, sondern auch im Hinblick auf die Bedeutung der Studien, die hier vorgestellt werden. Besonders viele neue Daten gab es zum Thema Hepatitis.
Seit Jahren verzeichnet die EASL-Tagung steigende Teilnehmerzahlen. In diesem Jahr waren es über 7.000 Teilnehmer trotz der wirtschaftlichen Flaute und der immer geringer werdenden Bereitschaft der Industrie, Kongressteilnahmen zu unterstützen. Die Teilnehmer kamen aus 30 Ländern und interessanterweise stellten die Amerikaner die größte Gruppe. Mit der zunehmenden Bedeutung des Kongresses ist auch das Selbstbewusstsein der Europäer gestiegen. Es gibt ein neues Kongresslogo und einen neuen Namen "The International Liver Kongress", der auch gleich patentiert wurde. Die Führung der EASL ist und bleibt allerdings europäisch. Heiner Wedemeyer aus Hannover wurde für die nächsten zwei Jahre zum Generalsekretär gewählt.
Der Hauptgrund für das große Interesse am Internationalen Leberkongress der EASL ist die Qualität der wissenschaftlichen Studien. 2.179 Arbeiten wurden eingesandt und 1.630 (49%) davon präsentiert, 144 als Orals und 919 als Poster. Von den 51 eingesandten Late Breaker wurden 20 akzeptiert.
Hepatitis C
Bei der chronischen Hepatitis C gab es eine Fülle von Arbeiten zu neuen Substanzen. Nahezu jedes größere Pharmaunternehmen hat eine Substanz gegen HCV in der Entwicklung. Am weitesten fortgeschritten sind hier Albinterferon, ein rekombinantes Polypeptid aus humanem Albumin und Interferon alfa-2b, und der Proteasehemmer Telaprevir (TVR), der 2011 zugelassen werden soll. Auf Interferon und Ribavirin wird man in naher Zukunft nicht verzichten können. In den bisherigen Untersuchungen hatten alle Regime ohne diese Substanzen schlechter abgeschnitten. Doch in der fernen Zukunft sieht es möglicherweise anders aus. In der Studie INFORM-1, in der erstmals zwei orale, direkt antivirale Substanzen eingesetzt wurden, hatten der Proteasehemmer R7227 und das Cytidinanalogon R7128 einen synergistischen Effekt. Innerhalb von 14 Tagen kam es zu einem Abfall der HCV-RNA im Median um bis zu -5.2 log. Bei 63% der Patienten fiel die Viruslast in dieser kurzen Zeit sogar <40 IU/ml, bei 25% gar <15 IU/ml (Gane E et al. #LB1046).
Albinterferon
Zu Albinterferon wurden die beiden Phase-3-Studien ACHIEVE 1 und 2/3 präsentiert, in denen Albinterferon 900 mg einmal alle zwei Wochen mit pegyliertem Interferon alfa-2a jeweils in Kombination mit Ribavirin verglichen wurde. Gleich viele Patienten erreichten eine SVR (GT1 48,2% vs. 51,0%; GT 2/3 84,8% vs.79,8%) (Abb. 1). Albinterferon ist interessant, weil das Medikament nur einmal alle zwei Wochen gespritzt werden muss. Die Verträglichkeit ist gut, die Abbruchraten wegen Nebenwirkungen in beiden Armen waren vergleichbar (Zeuzem S et al. #1041; Nelson D et al. #1042).
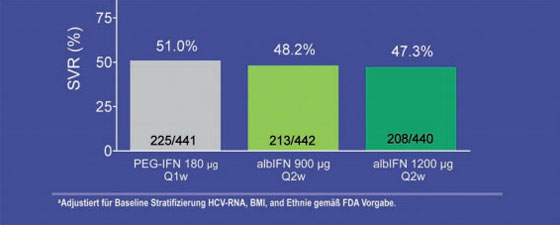
Abb. 1: SVR-Raten Albinterferon vs. Pegyliertes Interferon
Telaprevir bei Therapieversagern
Besonders ermutigend sind die Daten der Phase-2b-Studie Studie PROVE 3, an der 453 Therapieversager auf pegIFN/RBV teilnahmen. Rund zwei Drittel der Patienten waren Relapser, ein Drittel Nonresponder und bei rund 7% war es früher zum viralen Durchbruch gekommen. Die HCV-RNA bei Studienbeginn betrug bei über 90% der Patienten >800,000 IU/ml, etwa 40% hatten eine fortgeschrittene Fibrose bzw. Zirrhose und 9% waren Afrikaner.
Die Patienten wurden in vier Arme randomisiert:
· T12/PR24: TVR/pegIFN/RBV 12 Wochen plus pegIFN/RBV 12 Wochen
· T24/P24: TVR/peg/IFN 24 Wochen
· T24/PR48: TVR/pegIFN/RBV 24 Wochen plus pegIFN/RBV 24 Wochen
· PR: pegIFN/RBV 48 Wochen
In den Telaprevir-Armen T12/PR24 und T24/PR48 erreichten 51% und 52% der Patienten eine SVR, im Telaprevir-Arm ohne Ribavirin T24/P24 23% und unter Standardtherapie lediglich 14% (ITT-Analyse). Die SVR-Raten unter der Triple-Therapie waren bei den Relapsern mit 69% bzw. 76% höher als bei den Non-Respondern mit 39% bzw. 38% und den Patienten mit früherem viralem Durchbruch 57% bzw. 50% (Abb. 2). Wegen unzureichender Wirksamkeit beendeten 15%, 23%, 37% und 59% der Patienten die Therapie vorzeitig. Von den Patienten, die die Therapie zu Ende führten, kam es bei 28%, 4%, 53% und 52% zum Relaps. Eine Verkürzung der Therapiedauer scheint daher nicht empfehlenswert. Problematisch bei der langen Triple-Therapie ist die hohe Abbruchrate. Wegen unerwünschter Wirkungen brachen 10%, 25%, 9% und 4% die Behandlung ab. Die häufigsten Nebenwirkungen, die zum Abbruch führten, waren Müdigkeit, gastrointestinale Störungen, Hautausschlag, Juckreiz, Anämie und psychiatrische Symptome. 6% der Patienten im T12/PR24-Arm, 4% im T24/PR48-Arm und 5% im T24/P24-Arm entwickelten ein schweres Exanthem (Grad 3) (Manns M et al. #1044). In der laufenden Phase-3-Studie REALIZE wird derzeit das Regime T12/PR48 geprüft.
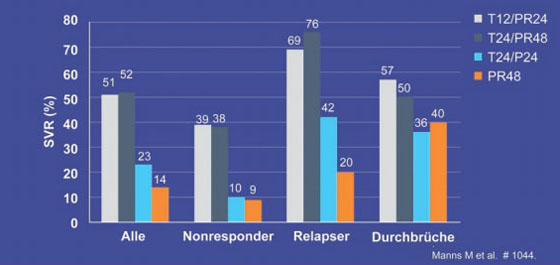
Abb. 2: PROVE 3: SVR-Raten
Telaprevir bei Genotyp 2/3 und 4
In den ersten Pilot-Studien bei Genotyp 2, 3 und 4 zeigte Telaprevir eine gute Wirksamkeit gegen GT 2. Bei GT 3 und 4 war der Effekt deutlich geringer ausgeprägt. Beim HCV Genotyp 2 kam es unter Telaprevir allein innerhalb von 15 Tagen zu einem maximalen Abfall der HCV-RNA um -4 log, bei Genotyp 3 um -0,8 und bei Genotyp 4 um -1,4 log. In Kombination mit pegIFN/RBV erreichten in diesem Zeitraum 40%, 22% bzw. 13% der Patienten eine HCV-RNA <10 IU/ml (Foster GR et al. #50; Benhamou Y et al. #10).
Boceprevir
Boceprevir war nach dem schlechten Abschneiden bei vorbehandelten Patienten schon fast in Vergessenheit geraten. Nun hat der Proteasehemmer bei therapienaiven Patienten sehr gute Daten vorgelegt. In der fünfarmigen Studie SPRINT-1 war die SVR-Rate unter Boceprevir nahezu doppelt so hoch wie unter Standardtherapie (75% vs. 38%). Am besten hatte der Arm mit einer Lead-in Phase (4 Wochen peg/IFN allein) plus 44 Wochen Triple-Therapie mit Boceprevir abgeschnitten. Die Relapse-Raten waren mit 7% (ohne Lead-in) und 3% (Lead-in) ausgesprochen niedrig. Die Verträglichkeit war im Allgemeinen gut, Hautprobleme wurden nicht beobachtet (Kwo P et al. #4).
Hämoglobin-Abfall als positiver Prädiktor?
Zu den Prädiktoren für das Ansprechen einer HCV-Therapie könnte in Zukunft auch der frühe Hämoglobin-Abfall gehören. In einer Subanalyse der IDEAL-Studie, in der pegIFN alfa-2b mit pegIFN alfa-2a direkt verglichen wurde, hatten 28% der Patienten eine Anämie entwickelt (Hb <10 g/dl, maximaler Hb-Abfall 4 g/dl). Patienten mit einem Hämoglobin-Abfall von >3g/dl erzielten eine signifikant bessere ETR- (61,6% vs. 41,8%) und SVR-Rate (43,7% vs. 29,9%) (Abb. 3). Die Gabe von Erythropoietin (EPO) in den ersten acht Wochen war mit einer signifikant höheren SVR-Rate und geringeren Abbruchrate assoziiert, nicht jedoch der spätere Einsatz (Sulkowski M et al. #126).
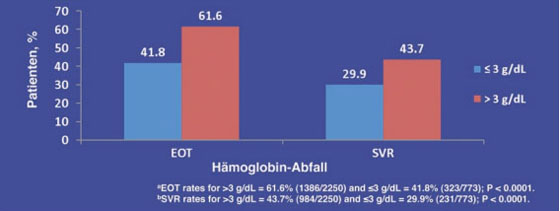
Abb. 3: EOTa und SVRb Raten in Abhängigkeit vom Hämoglobin-Abfall
Slow-Responder: Therapie verlängern?
In der SUCCESS-Studie erhöhte die Verlängerung der Therapiedauer von 48 auf 72 Wochen bei Slow Respondern die SVR-Rate nicht signifikant (43,0 vs. 47,9%, ITT). Selbst bei den Patienten mit guter Compliance (80/80/80) war die Differenz nicht statistisch signifikant (44,3 vs. 57,1%). Gravierende Nebenwirkungen hatte die Verlängerung nicht (7,0 vs. 8,2%) dennoch brachen deutlich mehr Patienten vorzeitig ab (9,3 vs. 23,3%), was sich möglicherweise auf die SVR-Raten in der ITT-Analyse ausgewirkt hat (Buti M et al. #141).
Therapieverkürzung
Zur Therapieverkürzung wurden mehrere Studien präsentiert. In der großen Studie REDD 2/3 wurde die Option der Therapieverkürzung bei Genotyp 2 und 3 untersucht. An der Forscher-initiierten Untersuchung nahmen rund 350 deutsche Patienten und 350 Asiaten teil. Die deutschen Patienten gehören zur sogenannten "HepNet-Kohorte", d.h. die Behandlung wurde unter Alltagsbedingungen durchgeführt. Die Patienten erhielten pegyliertes Interferon-alfa-2b in der Dosierung 1,5 µg/kg über 24 Wochen oder 1,5 µg/kg über 16 Wochen oder 1,0 µg/kg über 24 Wochen jeweils in Kombination mit Ribavirin. 80% der Patienten hatten GT 3 und 53% hatten eine HCV-RNA >=600.000 IU/ml. In der Gesamtkohorte schnitten die Patienten mit pegIFN alfa-2b 1,5 µg/kg über 24 Wochen am besten ab (SVR 75 vs. 69% vs. 66%). In der deutschen Kohorte waren die SVR-Raten unter beiden Interferon-Dosierungen vergleichbar, die Therapieverkürzung auf 16 Wochen jedoch auch hier deutlich schlechter (59 vs. 60% vs. 47%) (Abb. 4). Eine Therapieverkürzung bei GT 2/3 ist somit nur bei einzelnen Patienten möglich (Manns M et al. #144). In der deutschen INDIV-2 Studie wird die Therapieverkürzung bei 398 therapienaiven Patienten mit Genotyp 1 und einer HCV-RNA >=800.000 IU/ml untersucht. In einer Zwischenauswertung hatten 44 Patienten eine RVR (hochsensitiver Test) zu Woche 6 erreicht. 38 davon wurden 24 Wochen lang, sechs 30 Wochen lang behandelt. Die SVR-Raten lagen in der ITT-Analyse bei 92% vs. 83% (Sarrazin C et al. #642).
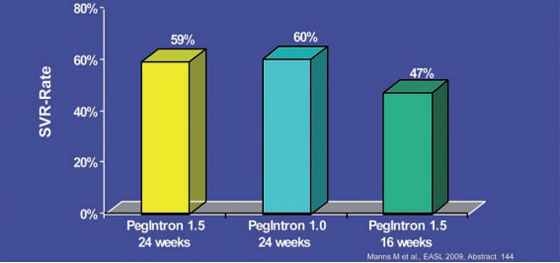
Abb. 4: REDD 2/3: SVR-Raten der deutschen Patienten (n=347)
Hepatitis B Therapienaive Patienten
Tenofovir: Bei den Langzeitdaten zu den Nukleos(t)iden bei therapienaiven Patienten gab es keine Überraschungen. Tenofovir (TDF) war auch nach 96 Wochen in den Studien GS-102 und GS-103 gut wirksam, auch bei Patienten mit Leberzirrhose. Resistenzen wurden nicht beobachtet (Marcellin P et al. #925; Buti M et al. #21). Nach einem Jahr hatten 3,2% der HBeAg-positiven Patienten versus 0% unter Adefovir (ADF) HBsAg verloren. Im Lauf des zweiten Jahres hatten 6% das Antigen verloren. All diese Patienten waren Kaukasier und hatten Genotyp A oder D. Der Abfall des HBsAg-Spiegels zu Woche 24 war prädiktiv (Heathcote EJ et al. #909). Die Verträglichkeit von Tenofovir ist im Allgemeinen gut. In einer deutschen Untersuchung mit 160 vorbehandelten Patienten wurde keine statistisch signifikante Veränderung der Kreatininclearance beobachtet, allerdings kam es bei 21 Patienten zu einem Abfall um >10% (van Bömmel F et al. #929).
Entecavir: Unter Entecavir (ETV) wurde in den Zulassungsstudien bei therapienaiven Patienten auch nach sechs Jahren Behandlung keine Zunahme der Resistenzrate beobachtet. Diese liegt seit dem dritten Jahr konstant bei 1,2%. Bei den vorbehandelten Patienten mit Lamivudin-Resistenz steigt die Rate dagegen kontinuierlich an. Sie liegt im sechsten Jahr bei 57% (Tenney DJ et al. #20). In einer italienischen Beobachtung wurden 272 therapienaive Patienten (84% HBeAg-negativ, 49% Zirrhose) 72 Wochen lang mit 0,5 mg ETV behandelt. Insgesamt erreichten 95% eine HBV-DNA unter der Nachweisgrenze (Abb. 5). Resistenzen bzw. virologische Durchbrüche wurden nicht beobachtet. Zwei Patienten verloren HBsAg, doch die HBsAg-Spiegel blieben insgesamt konstant. Bei 73 Patienten wurde die Leberfibrose mittels Fibroscan verfolgt und es kam bei allen Patienten selbst bei Leberzirrhose zu einem Rückgang (Lampertico C et al. #916).
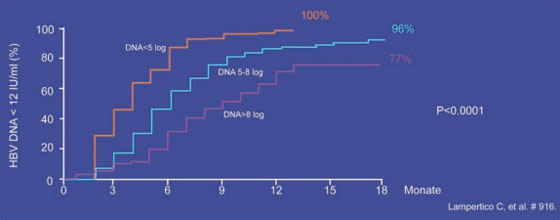
Abb. 5: Entecavir bei therapienaiven Patienten im klinischen Alltag
Telbivudin: Zu Telbivudin wurden Daten aus der GLOBE-Studie präsentiert. In der Per-Protokoll-Analyse hatten 75% der HBeAg-positiven und 85% der HBeAg-negativen Patienten auch im dritten Jahr eine HBV-DNA <300 Kopien/ml (Hsu CW et al. #l911). Bei 68%/54% der HBeAg-positiven Patienten kam es zum HBeAg-Verlust/-Serokonversion (Abb. 6). Zudem kam es parallel zur Virussuppression zum Abfall der HBsAg-Spiegel. Insgesamt 6% der Patienten verloren HBsAg. Prädiktor für den Verlust von HBsAg war ein Abfall der HBsAg-Konzentration um >1 log IU/ml im ersten Jahr. Die Wahrscheinlichkeit HBsAg zu verlieren, betrug in diesem Fall 26% (Wursthorn K et al. #17).
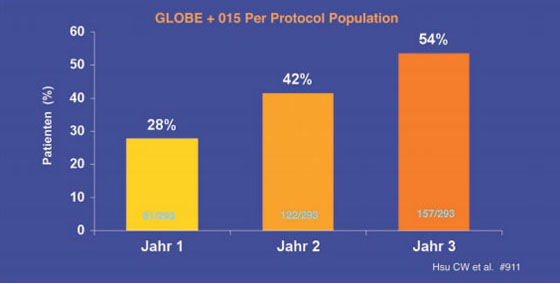
Abb. 6: HBeAg-Serokonversion unter Telbivudin
Schwangerschaft
Zum Risiko einer Missbildung unter Nukleos(t)iden während einer Hepatitis B-Therapie wurden die Daten des amerikanischen ARP (Antiretroviral Pregnancy Registry) ausgewertet. In diesem Register wurden prospektiv Daten von 11.950 Schwangerschaften von HIV-infizierten Frauen unter antiretroviraler Therapie und 9.948 Lebendgeburten gesammelt. Die Daten reichen aus, um ein 1,5fach erhöhtes Risiko unter Lamivudin und ein 2faches unter Tenofovir zu erfassen. Zu Adefovir, Entecavir und Telbivudin liegen nicht genügend Daten vor. Bislang wurde weder im ersten noch im zweiten und dritten Trimester eine Teratogenität festgestellt. Die Missbildungsrate liegt im normalen Bereich von 2,72 pro 100 Lebendgeburten (Brown RS et al. #3).
HBsAg-Konzentration
Ein wichtiges Thema bei der chronischen Hepatitis B war der HBsAg-Spiegel als Prädiktor für den Verlust von HBsAg. Der HBsAg-Spiegel scheint im Verlauf der Erkrankung zu schwanken und ist bei immuntoleranten HBsAg-positiven Patienten am höchsten, bei niedriger Replikation am geringsten (Jaroszewicz J et al. #364). In einer Studie, in der pegyliertes Interferon eingesetzt wurde, war der HBsAg-Abfall bereits nach 12 Wochen prädiktiv, in anderen Untersuchungen nach 24 und 48 Wochen (Abb. 7).
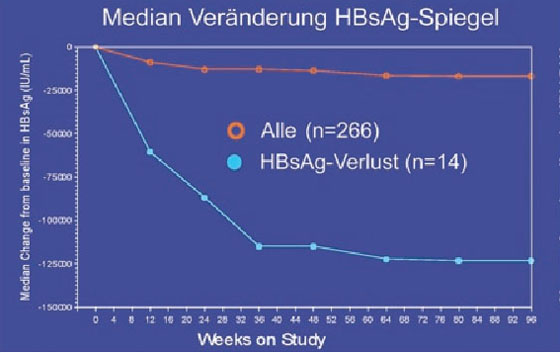
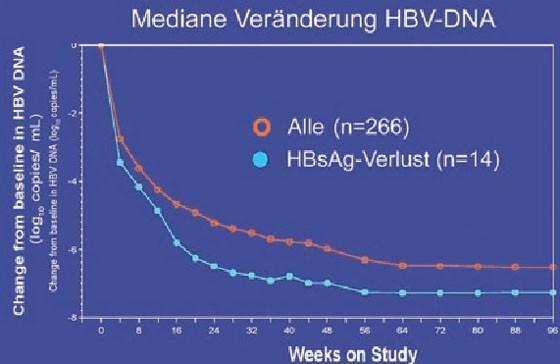
Abb. 7a+b: GS-103: HBsAg-Verlust korreliert signifikant mit Abfall der HBsAg-Konzentration in den ersten
24 Wochen
Als Grenzwert wurde in den Studien ein HBsAg-Abfall <1.500 und <1.000 IU/ml herangezogen bzw. ein Abfall um >1 log im ersten Jahr (Lau GK et al. #917; Marcellin P et al. #924; Heathcote EJ et al. #909; Iavarone M et al. #912; Wursthorn K et al. #17). Die cccDNA in den Hepatozyten scheint ebenfalls mit dem HBsAg-Spiegel zu korrelieren, nicht jedoch mit der Viruslast im Serum und in der Leber (Cheng PN et al. #351). Ob der HBsAg-Spiegel bei Therapiebeginn prädiktiv ist, ist umstritten (Takkenberg B et al. #15; Heathcote EJ et al. #909).
Vorbehandelte Patienten
Ob man bei einer Resistenz gegen ein Nukleos(t)id die Substanz wechseln oder ein weiteres Medikament dazugeben soll, ist derzeit umstritten. In zwei Untersuchungen an Patienten mit Adefovir-Versagen war die Kombination von TDF und Emtricitabin (FTC) nicht besser als TDF allein (Berg T et al. #903, Zoulim F et al. #934). In der deutschen Studie der Arbeitsgruppe um Thomas Berg, Berlin, wurden 105 Patienten, deren HBV-DNA unter ADF nach durchschnittlich 60 Wochen nicht <172 IU/ml lag, entweder mit TDF oder TDF plus FTC 200 mg weiterbehandelt. Nach 96 Wochen lag die HBV-DNA in beiden Armen bei gleich vielen Patienten unter der Nachweisgrenze von 400 Kopien/ml (69 IU/ml) (ITT; 89% vs. 83%, ns) (Abb. 8). Eine bestehende dokumentierte Adefovir- bzw. Lamivudin-Resistenz hatte keinen Einfluss auf das virologische Ansprechen. Auch Entecavir ist bei Adefovir-Vorbehandlung/Resistenz genauso gut wirksam wie ohne Vorbehandlung. Das ergab die Analyse der Daten von 160 Nukleos(t)id-naiven vs. Nukleos(t)id-vortherapierten Patienten (Reijnders J et al. #19). Bei kritisch kranken Patienten, z.B. fortgeschrittene Leberzirrhose, ist die Kombination Entecavir plus Tenofovir effektiv und sicher (Amarapurkar D et al. #901; Lütgehetmann M et al. #922).
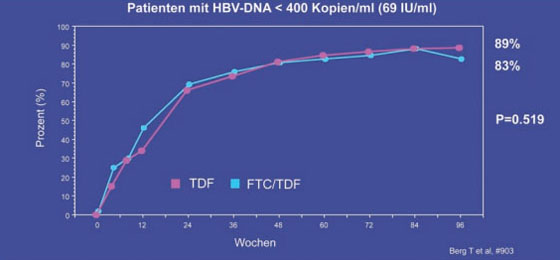
Abb. 8: TDF/FTC vs. TDF bei mit ADF vorbehandelten Patienten

HIV/Hepatitis-Koinfektion
Erneut bestätigten Kohortendaten, dass HIV/Hepatitis-Koinfizierte ein deutlich erhöhtes Risiko
haben, an Leberkomplikationen zu sterben (Arends J et al. #388). Hintergrund ist die raschere Progression
der Leberfibrose bei der Koinfektion. Dies könnte eine Folge der HIV-Infektion der hepatischen
Sternzellen sein, die die Produktion von Kollagen stimuliert (Iser DM et al. #564; Galastri S et al. #30).
Ultima ratio bei fortgeschrittener Zirrhose ist die Lebertransplantation. Die Überlebensraten bei
HIV-Infizierten sind hier im Allgemeinen mit denen von HIV-Negativen vergleichbar. Lediglich bei
HCV-Koinfektion schneiden die HIV-Infizierten signifikant schlechter ab (Mortalität 1 Jahr 87% vs.
73%, 5 Jahre 69% vs. 53%) (Joshi D et al. #52; Moreno A et al. #484).
Der Verdacht, dass Telbivudin HIV-wirksam ist, ist widerlegt. In vitro-Analysen bei Wildtyp sowie resistenten Stämmen ergaben im gleichen Testsystem keine Aktivität von Telbivudin gegen HIV, während Entecavir sowohl bei Wildtyp als auch bei multiresistenten Stämmen HIV-wirksam war (Avila C et al. #551).
Impfstoffe
Der neue Hepatitis-B-Impfstoff des Unternehmens Dynavax enthält neben HBsAg ein neuartiges
Adjuvans, nämlich ISS 1018 (Immuno-stimulatorische Sequenz 1018), einen Toll-like Rezeptor
9-Agonisten. Die Vakzine muss nur zweimal (0 und 4. Woche) gespritzt werden und erzielte in einer
Phase-3-Studie einen rascheren und besseren Impfschutz als der herkömmliche Impfstoff (Pecoraro ML et
al. #1040). Bei der Hepatitis C konnte erstmals das Prinzip der therapeutischen Impfung bestätigt
werden mit einem DNA-Impfstoff in Kombination mit in vivo-Elektropermeabilisierung (Frelin L et al. #116).
Kombination mit in vivo-Elektropermeabilisierung (Frelin L et al. #116).
EASL 2010
Der nächste "International Liver Kongress" der EASL wird vom 11. bis 18. April 2010 in Nizza stattfinden. Ob dort noch Zeit für den Liegestuhl bleibt, ist ungewiss.





