Katrin Hoffmann, Markus W. Büchler, Peter Schemmer, Heidelberg
Chirurgische Behandlungsstrategien des hepatozellulären Karzinoms (HCC)
| Rezidivrate und Überleben nach chirurgischer Therapie beim HCC | ||||
|---|---|---|---|---|
| Autor | n | Rezidivrate (%) | 5 Jahres Überleben (%) | |
| Resektion | Chok 200951 | 863 | - | 52 |
| Yang 200952 | 260 | 65 | 38 | |
| Sotiropoulos 200843 | 61 | - | 40 | |
| Benzoni 200753 | 134 | 77.6 | 29 | |
| Cillo 200754 | 131 | 37 | 31 | |
| Transplantation | Mazzaferro 19964 | 48 | 8 | 75 |
| Yao 200135 | 70 | 11.4 | 75 | |
| Vivarelli 200255 | 82 | 12 | 64 | |
| Cillo 200456 | 33 | 8 | 75 | |
| Salvage- Transplantation | Belghiti 200349 | 18 | 5.6 | 61 |
| Schwartz 200757 | 18 | 44 | - | |
| Kim 200858 | 15 | - | 66 | |
| Del Gaudio 200859 | 16 | 48 | 62 | |
Tab. 1: Milan-Kriterien: Milan-Kriterien erfüllt sind: singulärer HCC-Herd mit einer Größe von <5 cm oder 2-3 Tumorherde von <3 cm Größe ohne makroskopische vaskuläre Infiltration und ohne extrahepatische Metastasierung
Nach Implementierung von sonografischen Screening-Programmen für Patienten mit Leberzirrhose werden hepatozelluläre Karzinome (HCC) in 30-60% der Fälle in einem frühen Stadium d.h. mit einer Größe von <3 cm diagnostiziert.1
Der Erfolg dieser Programme und die Verfügbarkeit hocheffektiver Therapien für HCCs im Frühstadium haben das klinische Szenario nachhaltig verändert. Chirurgische Therapieoptionen wie die Leberresektion und Lebertransplantation können mittlerweile bei 30-40% der Patienten angewandt werden.2 Sie sind auch weiterhin die einzige kurative Behandlungsoption (Tab. 1).
LEBERRESEKTION
HCC ohne Zirrhose oder
mit Child A-Leberzirrhose
Die Leber-Resektion und die -Transplantation sind miteinander konkurrierende Verfahren bei der First-Line-Therapie von im Frühstadium befindlichen HCC-Patienten. Bei der Mehrzahl der HCC-Patienten ist die Eignung zur Leberresektion nicht nur von der anatomischen Tumorlokalisation, sondern auch vom Ausmaß der zugrunde liegenden Lebererkrankung abhängig. Teh et al. zeigten bei HCC-Patienten mit einem MELD-Score von ≥9 eine 29%ige Mortalität nach Leberresektion während bei Patienten mit einem MELD-Score von <9 keine Mortalität nach Leberresektion zu beobachten war.7 Andere Quellen geben perioperative Mortalitätsraten von 0,5%-21,5% an und spiegeln hiermit die Inzidenz des Leberversagens aufgrund der zugrunde liegenden Lebererkrankung wieder.8 Nur 15-30% aller HCC-Patienten sind daher potentielle Kandidaten für eine Leberresektion.
Indikation
Die Indikation zur Resektion besteht bei Patienten mit einem HCC im Frühstadium (singulärer Knoten ≤5 cm oder bis zu 3 Tumore ≤3 cm), Okuda Stadium 1 oder 2, keine oder Child-Pugh A-Zirrhose ohne Anzeichen einer portalen Hypertension und normalen Bilirubinwerten. Aufgrund der hohen Inzidenz von vaskulärer Infiltration und der daraus resultierenden schlechten Prognose ist gemäß der Empfehlungen der American Association for Study of Liver Diseases (AASLD) und European Association for Study of Liver (EASL) eine Leberresektion bei einem HCC von >5 cm kontraindiziert.9;10 Jedoch wurden in mehreren Zentren auch für Patienten mit größerem HCC akzeptable Langzeitüberlebensraten erzielt. Fünf-Jahres-Überlebensraten von 20-27% für Patienten mit Tumoren von einer Größe von >10 cm wurden berichtet.11;12 Multifokale HCC stellen wegen des schlechten Langzeit-überlebens ebenfalls eine relative Kontraindikation zur Leberresektion dar. Ng et al. zeigten in ihrer Studie gleiche Morbiditäts- und Mortalitätsraten bei Patienten mit großen multifokalen HCC bzw. bei Patienten mit singulärem HCC (<5 cm). Das 3-Jahres-Überleben war jedoch mit 50% vs. 76% signifikant verkürzt.11
Segmentale Resektion
Die anatomische (segmentale) Resektion führt zu einer sicheren en-bloc-Entfernung des Primärtumors sowie von potentiell nach vaskulärer Infiltration entstandener Satellitenherde. Eine Assoziation von anatomischer Resektion und niedriger Rezidivrate mit verbessertem Überleben konnte gezeigt werden.13-15 Das rezidivfreie Überleben nach Leberresektion von HCC-Tumoren im Frühstadium bei Patienten mit Child A-Zirrhose beträgt 40-48%.5;16-18 Zirka 80% dieser Rezidive entstehen aufgrund der multizentrischen Hepatokarzinogenese in der verbliebenen zirrhotischen Restleber.19 Die hohe intrahepatische Rezidivrate von 70% innerhalb von 5 Jahren gehört zu den wesentlichen Nachteilen einer Resektion im Vergleich zur Lebertransplantation.20;21 Behandlungsstrategien mit adjuvanter Chemotherapie zur Prävention einer rezidivierenden Tumorerkrankung nach Resektion wurden in einer Vielzahl von Studien untersucht, sie zeigten jedoch keinen Überlebensvorteil.22;23 Bei Patienten mit einem HCC <3 cm und signifikanten Co-Morbiditäten muss angesichts der exzellenten Ergebnisse nach lokal ablativer Therapie die Anwendung eines interventionellen Therapiekonzeptes im Vergleich mit der Leberresektion auch zum Bridging vor Transplantation diskutiert werden.24
Die Indikation zur primären Lebertransplantation bei Patienten mit Child A-Zirrhose wird insbesondere vor dem Hintergrund des persistierenden Organmangels kontrovers beurteilt.5;6
LEBERTRANSPLANTATION
HCC-Patienten mit Child B-/C-Leberzirrhose
Für Patienten, die auf dem Boden einer Child B-/C-Zirrhose ein HCC entwickelt haben, stellt die Lebertransplantation die einzige kurative Behandlungsoption dar. Aufgrund des besseren rezidivfreien Überlebens favorisieren einige Autoren die primäre Lebertransplantation auch bei Patienten mit kleinem (<3 cm) singulären HCC, selbst wenn die Leberfunktion aufgrund der Grunderkrankung nicht eingeschränkt ist (Child A). Dennoch ist aufgrund von transplantationsassoziierten Komplikationen wie Abstoßung, Rezidivhepatitis und Nebeneffekte der Immunsuppression das Langzeitüberleben nach Leberresektion und Transplantation für kleine HCC nahezu identisch.18;25-27
Das Hauptrisiko für HCC-Patienten ist der Tumorprogress auf der Warteliste vor Lebertransplantation. In einer Intention-to-treat-Analyse konnten Llovet et al. zeigen, dass durch eine Verlängerung der Wartezeit von 62 auf 162 Tage das 2-Jahres-Überleben von 82% auf 54% sinkt.28 Während einer Wartezeit von 6-12 Monaten sinkt das 5-Jahres-Überleben um ca. 10%-20% von zwischen 81%-58% auf 62%-47%.3 Die Drop-out Rate vor Transplantation aufgrund von Tumorwachstum, das die Milan-Kriterien überschreitet, liegt bei 10%-30%.
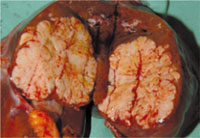
Abb. 1: Aufgeschnittenes Leberresektat mit HCC
Bridging
Um den Tumorprogress während der Wartezeit zu kontrollieren, werden in den meisten Zentren neo-adjuvante Therapien zum Bridging bis zur Transplantation durchgeführt. Bislang konnte gezeigt werden, dass sich die Radio-Frequenz-Ablation (RFA) als lokalablatives Verfahren durch höhere komplette Nekroseraten (12-55%) im Vergleich zur transarteriellen Chemoembolisation (TACE) (22-29%) auszeichnet.29;30 Durch TACE zum Bridging vor Lebertransplantation konnte ein 5-Jahres-Überleben von 55-93% erzielt werden.30-34 Die Studien von Manjo et al., Decaens et al. und Porrett et al. zeigten jedoch keinen signifikanten Überlebensvorteil nach Transplantation durch eine neo-adjuvante Therapie während der Wartezeit.31;33;34 Während robuste Daten bezüglich des Einflusses dieser Therapien auf Dropout, Rezidivraten und Gesamtüberleben aus randomisierten, kontrollierten Studien dringend benötigt werden, ist gesichert, dass die Lebertransplantation die beste Chance auf ein Langzeitüberleben bei HCC-Patienten mit Tumoren von einer Größe von <5 cm ist.
Milan-Kriterien
Die von Mazzaferro beschriebenen Milan-Kriterien sind in den meisten Zentren der Goldstandard bezüglich tumorgrößenabhängiger Indikation für die Lebertransplantation. Ein 5-Jahres-Überleben von ca. 75% sowie Rezidivraten von weniger als 15% konnten durch dieses Einschlusskriterium erzielt werden.4 Einigen Zentren sind diese Kriterien zu restriktiv, so dass Methoden zum Down-Staging und damit zur Expansion der Milan-Kriterien untersucht wurden. Mit den von Yao et al. publizierten UCSF-Kriterien (singulärer Tumor mit einer Größe von ≤6.5 cm, ≤3 Herde von denen keiner >4,5 cm bzw. deren Gesamtdurchmesser ≤8 cm beträgt) konnte ein 5-Jahres-Überleben von 75% erzielt werden.35 Andere Gruppen berichten ein 5-Jahres-Überleben von 46-64% für Patienten, die die UCSF-Kriterien erfüllen.36;37 Eine Überschreitung der UCSF-Kriterien resultiert in 5-Jahres-Überlebenraten von <50%.38;39 In multivariaten Analysen konnten AFP-Spiegel ≥300 ng/l, Tumoranzahl und -Differenzierung, vaskuläre Infiltration und eine Tumorgröße außerhalb der Milan-Kriterien als unabhängige Prog-nosefaktoren für ein rezidivfreies Überleben identifiziert werden.40 Um eine Expansion der Milan-Kriterien weiter zu prüfen, werden dringend Daten aus randomisierten Studien benötigt. Eine Multicenterstudie zur Kombination von neo-adjuvanter Behandlung mit Sorafenib und TACE vor Lebertransplantation wurde initiiert.41
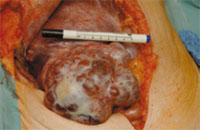
Abb. 2: Aus dem rechten Leberlappen wachsendes HCC
Leberlebendspende
Die Indikationsstellung zur Leberlebendtransplantation (LDLT) bei HCC Patienten wird kontrovers diskutiert. Die meisten Zentren orientieren sich auch bei der Leberlebendspende an den gültigen Listungskriterien und den Milan-Kriterien.42 Ein Empfängeralter >60 Jahren, ein MELD-Score von >22 sowie AFP-Spiegel von <400 ng/ml sind als unabhängige prognostische Faktoren mit reduziertem Gesamtüberleben und Frühmortalität nach LDLT assoziiert.43 Mit Rücksicht auf die potentielle Morbidität und Mortalität des Leberspenders spielt die Lebendlebertransplantation bei der Behandlung des HCC jedoch eine untergeordnete Rolle.
SALVAGE-LEBERTRANSPLANTATION
HCC-Rezidiv
nach Leberresektion
Einige Studien empfehlen angesichts der Wartezeiten auf ein Spenderorgan bei Patienten mit kleinem HCC die Strategie der primären Leberresektion zum Bridging zur Transplantation. Dies reduziert nicht nur das Risiko eines Tumorprogresses während der Wartezeit, sondern erlaubt auch die Identifikation von Patienten mit aggressiver Tumorbiologie. Für Patienten mit einem Lokalrezidiv nach Leberresektion stellt die Salvage-Lebertransplantation eine mögliche Behandlungsoption dar. Voraussetzung ist jedoch, dass der Rezidivtumor die Milan-Kriterien nicht überschreitet.44 Die Strategie der primären Resektion und Salvage-Lebertransplantation im Falle eines Tumorrezidivs basiert auf der Prämisse, dass die meisten Rezidivtumore innerhalb der Transplantationskriterien liegen und dass die Salvage-Lebertransplantation Langzeitüberlebensraten vergleichbar zur primären Lebertransplantation erzielen kann. Multivariate Analysen identifizierten die Größe und Differenzierung des Primärtumors als Risikofaktoren für ein Lokalrezidiv, das außerhalb der Milankriterien liegt.45 Mehrere Studien konnten jedoch zeigen, dass ca. 80% der mittels regelmäßiger Tumornachsorge entdeckten Lokalrezidive innerhalb der Milan-Kriterien liegen.17;21;46
Mortalität und Morbidität
Die Datenlage bezüglich der operativen Mortalitätsraten und des Langzeitüberlebens nach Salvage-Lebertransplantation ist heterogen. Während Adam et al. eine operative Mortalität von 28,6% nach Salvage-Lebertransplantation im Vergleich zu 2,1% nach primärer Lebertransplantation berichteten, zeigten andere Studien eine identische Morbidität und Mortalität sowie ein Langzeitüberleben nach Salvage-Lebertransplantation vergleichbar zur primären Lebertransplantation.6;18;47;48 Beim Nachweis von negativen prognostischen Faktoren wie vaskulärer Infiltration oder Mikrosatellitenherde im histologischen Präparat nach Resektion empfehlen einige Zentren die sofortige Listung zur Transplantation noch bevor ein Lokalrezidiv aufgetreten ist.49;50 Da Patienten mit diesen Prognosefaktoren jedoch auch ein erhöhtes Rezidivrisiko nach Lebertransplantation aufweisen, erscheint diese Strategie fragwürdig. Sinnvoller erscheint hingegen durch regelmäßige Nachsorgeuntersuchungen zu kontrollieren, ob ein lokales Tumorrezidiv auftritt oder ob sich sogar extrahepatische Metastasen bilden, welche per se eine Kontraindikation zur Transplantation darstellen.
MULTIMODALES THERAPIEKONZEPT IN HEIDELBERG
Die oben genannten Erwägungen werden im Heidelberger Therapiekonzept im Wesentlichen umgesetzt. In der Zeit von Dezember 2001 bis Dezember 2008 wurden insgesamt 180 HCC-Patienten einer chirurgischen Therapie unterzogen. Während bei 82 Patienten eine Leberresektion durchgeführt wurde, erfolgte bei 98 Patienten eine Lebertransplantation. Seit 1999 wird bei Patienten auf der Warteliste vor einer Lebertransplantation ein lokal ablatives Verfahren (TACE oder RFA) zur lokalen Tumorkontrolle durchgeführt. In der Weiterentwicklung unseres Therapiekonzeptes untersuchen wir aktuell in einer offenen, randomisierten, placebo-kontrollierten, doppelblinden, multizentrischen Studie die Kombination von TACE plus Sorafenib als neuen neo-adjuvanten Therapieansatz bei Patienten mit HCC vor Lebertransplantation.41
Ausblick
Solange robuste Daten aus randomisiert kontrollierten Studien nicht zur Verfügung stehen, beruht die Behandlungsstrategie für HCC-Patienten auf der Interpretation retrospektiver Studien, Erfahrungen innerhalb der behandelnden Zentren und der Verfügbarkeit von therapeutischen Optionen. Basierend auf den bislang publizierten Daten weisen die Leberresektion und Transplantation identische Mortalitäts- und Überlebensraten für Patienten mit kleinem HCC und erhaltener Leberfunktion (Child A) auf. Im Vergleich zur Leberresektion bietet die Lebertransplantation die Chance, nicht nur den Tumor, sondern auch die zugrunde liegende Lebererkrankung zu beseitigen. Hiermit kann zudem das Rezidivrisiko reduziert werden.
Die Leberresektion ist die Methode der Wahl für Patienten mit einem HCC im Frühstadium ohne Einschränkung der Leberfunktion (Child A). Vor dem Hintergrund des persistierenden Organmangels besteht die Indikation zur Lebertransplantation derzeit nur für Patienten mit Tumoren deren Größe sich innerhalb der Milan-Kriterien befindet. Eine Expansion dieser Kriterien wird derzeit in Studien evaluiert. Mit der Entwicklung neuer operativer Techniken, Verbesserung der lokal ablativen Verfahren und der zunehmenden Kenntnis molekularer Pathomechanismen während der Hepatokarzinogenese hat sich das Spektrum in der Therapie des HCCs deutlich erweitert. Mit dem oralen Multikinase-Inhibitor Sorafenib steht erstmals eine Substanz zur Verfügung, welche das Überleben von HCC Patienten signifikant verlängert und zukünftig auch als adjuvante Therapie eines Tumorrezidivs nach Leberresektion oder Transplantation im Rahmen von prospektiven Studien untersucht werden muss.
1. Llovet JM, Bruix J. Hepatocellular carcinoma. The Lancet 2003;362:1907-17.
2. Llovet JM, Bruix J. Novel advancements in the management of hepatocellular carcinoma in 2008. J Hepatol 2008;48 Suppl 1:S20-S37.
3. Llovet JM, Schwartz M, Mazzaferro V. Resection and liver transplantation for hepatocellular carcinoma. Semin Liver Dis 2005;25(2):181-200.
4. Mazzaferro V, Regalia E, Dogia R, Andreola S PABF. Liver transplantation for the treatment of small hepatocellular carcinomas in patients with cirrhosis. N Engl J Med 1996;334:693-9.
5. Bigourdan JM, Jaeck D, Meyer N, Meyer C, Oussoultzoglou E, Bachellier P, et al. Small hepatocellular carcinoma in Child A cirrhotic patients: hepatic resection versus transplantation. Liver Transpl 2003 May;9(5):513-20.
6. Adam R, Azoulay D, Castaing D, Eshkenazy R, Pascal G, Hashizume K, et al. Liver resection as a bridge to transplantation for hepatocellular carcinoma on cirrhosis: a reasonable strategy? Ann Surg 2003 Oct;238(4):508-18.
7. Teh SH, Christein J, Donohue J, Que F, Kendrick M, Farnell M, et al. Hepatic resection of hepatocellular carcinoma in patients with cirrhosis: Model of End-Stage Liver Disease (MELD) score predicts perioperative mortality. J Gastrointest Surg 2005 Dec;9(9):1207-15.
8. Bartlett AS, McCall JL, Koea JB, Holden A, Yeong ML, Gurusinghe N, et al. Liver resection for hepatocellular carcinoma in a hepatitis B endemic area. World J Surg 2007 Sep;31(9):1775-81.
9. Bruix J, Sherman M. Management of hepatocellular carcinoma. Hepatology 2005 Nov;42(5):1208-36.
10. Bruix J, Sherman M, Llovet JM, Beaugrand M, Lencioni R, Burroughs AK, et al. Clinical management of hepatocellular carcinoma. Conclusions of the Barcelona-2000 EASL conference. European Association for the Study of the Liver. J Hepatol 2001 Sep;35(3):421-30.
11. Ng KK, Vauthey JN, Pawlik TM, Lauwers GY, Regimbeau JM, Belghiti J, et al. Is hepatic resection for large or multinodular hepatocellular carcinoma justified? Results from a multi-institutional database. Ann Surg Oncol 2005 May;12(5):364-73.
12. Poon RT, Fan ST, Wong J. Selection criteria for hepatic resection in patients with large hepatocellular carcinoma larger than 10 cm in diameter. J Am Coll Surg 2002 May;194(5):592-602.
13. Imamura H, Matsuyama Y, Tanaka E, Ohkubo T, Hasegawa K, Miyagawa S, et al. Risk factors contributing to early and late phase intrahepatic recurrence of hepatocellular carcinoma after hepatectomy. J Hepatol 2003 Feb;38(2):200-7.
14. Yamashita Y, Taketomi A, Itoh S, Kitagawa D, Kayashima H, Harimoto N, et al. Longterm favorable results of limited hepatic resections for patients with hepatocellular carcinoma: 20 years of experience. J Am Coll Surg 2007 Jul;205(1):19-26.
15. Wakai T, Shirai Y, Sakata J, Kaneko K, Cruz PV, Akazawa K, et al. Anatomic resection independently improves long-term survival in patients with T1-T2 hepatocellular carcinoma. Ann Surg Oncol 2007 Apr;14(4):1356-65.
16. Poon RT, Fan ST, Lo CM, Liu CL, Ng IO, Wong J. Long-term prognosis after resection of hepatocellular carcinoma associated with hepatitis B-related cirrhosis. J Clin Oncol 2000 Mar;18(5):1094-101.
17. Cha CH, Ruo L, Fong Y, Jarnagin WR, Shia J, Blumgart LH, et al. Resection of hepatocellular carcinoma in patients otherwise eligible for transplantation. Ann Surg 2003 Sep;238(3):315-21.
18. Margarit C, Escartin A, Castells L, Vargas V, Allende E, Bilbao I. Resection for hepatocellular carcinoma is a good option in Child-Turcotte-Pugh class A patients with cirrhosis who are eligible for liver transplantation. Liver Transpl 2005 Oct;11(10):1242-51.
19. Poon RT, Fan ST, Ng IO, Wong J. Significance of resection margin in hepatectomy for hepatocellular carcinoma: A critical reappraisal. Ann Surg 2000 Apr;231(4):544-51.
20. Zhou XD, Tang ZY, Yang BH, Lin ZY, Ma ZC, Ye SL, et al. Experience of 1000 patients who underwent hepatectomy for small hepatocellular carcinoma. Cancer 2001 Apr 15;91(8):1479-86.
21. Poon RT, Fan ST, Lo CM, Liu CL, Wong J. Long-term survival and pattern of recurrence after resection of small hepatocellular carcinoma in patients with preserved liver function: implications for a strategy of salvage transplantation. Ann Surg 2002 Mar;235(3):373-82.
22. Yamamoto M, Arii S, Sugahara K, Tobe T. Adjuvant oral chemotherapy to prevent recurrence after curative resection for hepatocellular carcinoma. Br J Surg 1996 Mar;83(3):336-40.
23. Mazzaferro V, Romito R, Schiavo M, Mariani L, Camerini T, Bhoori S, et al. Prevention of hepatocellular carcinoma recurrence with alpha-interferon after liver resection in HCV cirrhosis. Hepatology 2006 Dec;44(6):1543-54.
24. Sala M, Llovet JM, Vilana R, Bianchi L, Sole M, Ayuso C, et al. Initial response to percutaneous ablation predicts survival in patients with hepatocellular carcinoma. Hepatology 2004 Dec;40(6):1352-60.
25. Shabahang M, Franceschi D, Yamashiki N, Reddy R, Pappas PA, Aviles K, et al. Comparison of hepatic resection and hepatic transplantation in the treatment of hepatocellular carcinoma among cirrhotic patients. Ann Surg Oncol 2002 Nov;9(9):881-6.
26. Otto G, Heuschen U, Hofmann WJ, Krumm G, Hinz U, Herfarth C. Survival and recurrence after liver transplantation versus liver resection for hepatocellular carcinoma: a retrospective analysis. Ann Surg 1998 Mar;227(3):424-32.
27. Figueras J, Jaurrieta E, Valls C, Ramos E, Serrano T, Rafecas A, et al. Resection or transplantation for hepatocellular carcinoma in cirrhotic patients: outcomes based on indicated treatment strategy. J Am Coll Surg 2000 May;190(5):580-7.
28. Llovet JM, Fuster J, Bruix J. Intention-to-treat analysis of surgical treatment for early hepatocellular carcinoma: resection versus transplantation. Hepatology 1999 Dec;30(6):1434-40.
29. Mazzaferro V, Battiston C, Perrone S, Pulvirenti A, Regalia E, Romito R, et al. Radiofrequency ablation of small hepatocellular carcinoma in cirrhotic patients awaiting liver transplantation: a prospective study. Ann Surg 2004 Nov;240(5):900-9.
30. Graziadei IW, Sandmueller H, Waldenberger P, Koenigsrainer A, Nachbaur K, Jaschke W. Chemoembolization followed by liver transplantation for hepatocellular carcinoma impedes tumor progression while on the waiting list and leads to excellent outcome. Liver Transplantation 2003;9:557-63.
31. Majno PE, Adam R, Bismuth H, Castaing D, Ariche A, Krissat J. Influence of preoperative transarterial lipiodol chemoembolization on resection and transplantation for hepatocellular carcinoma in patients with cirrhosis. Annals of Surgery 1997;226:688-701.
32. Maddala YK, Stadheim L, Andrews JC, Burgart LJ, Rosen CB, Kremers WK, et al. Drop-out rates of patients with hepatocellular cancer listed for liver transplantation: outcome with chemoembolization. Liver Transpl 2004 Mar;10(3):449-55.
33. Decaens T, Roudot-Thoraval F, Bresson-Hadni S, Meyer C, Gugenheim J, Durand F, et al. Impact of pretransplantation transarterial chemoembolization on survival and recurrence after liver transplantation for hepatocellular carcinoma. Liver Transpl 2005 Jul;11(7):767-75.
34. Porrett PM, Peterman H, Rosen M, Sonnad S, Soulen M, Markmann JF, et al. Lack of benefit of pre-transplant locoregional hepatic therapy for hepatocellular cancer in the current MELD era. Liver Transpl 2006 Apr;12(4):665-73.
35. Yao FY, Ferrell L, Bass NM, Watson JJ, Bacchetti P, Venook A, et al. Liver transplantation for hepatocellular carcinoma: expansion of the tumor size limits does not adversely impact survival. Hepatology 2001 Jun;33(6):1394-403.
36. Duffy JP, Vardanian A, Benjamin E, Watson M, Farmer DG, Ghobrial GM, et al. Liver transplantation criteria for hepatocellular carcinoma should be expanded: a 22-year experience with 467 patients at UCLA. Ann Surg 2007;246(3):502-9.
37. Decaens T, Roudot-Thoraval F, Hadni-Bresson S, Meyer C, Gugenheim J, Durand F, et al. Impact of UCSF criteria according to pre- and post-OLT tumor features: analysis of 479 patients listed for HCC with a short waiting time. Liver Transpl 2006 Dec;12(12):1761-9.
38. Yao FY. Expanded criteria for liver transplantation in patients with hepatocellular carcinoma. Hepatol Res 2007 Sep;37 Suppl 2:S267-S274.
39. Yao FY, Kerlan AK, Hirose R, Davern TJ, Bass NM, Feng S, et al. Excellent outcome following down-staging of hepatocellular carcinoma prior to liver transplantation: an intention-to-treat analysis. Hepatology 2008;14(12):1810-1.
40. Figueras J, Ibanez L, Ramos E, Jaurrieta E, Ortiz-de-Urbina J, Pardo F, et al. Selection criteria for liver transplantation in early-stage hepatocellular carcinoma with cirrhosis: results of a multicenter study. Liver Transpl 2001 Oct;7(10):877-83.
41. Hoffmann K, Glimm H, Radeleff B, Richter G, Schenkel I, Zahlten-Hinguranage A, et al. Prospective, randomized, double-blind, multi-center, Phase III clinical study on transarterial chemoembolization (TACE) combined with Sorafenib® versus TACE plus placebo in patients with hepatocellular cancer before liver transplantation – HeiLivCa [ISRCTN24081794]. BMC Cancer 2008;8:349.
42. Lo CM, Fan ST, Liu CL. Adult-to-adult living donor liver transplantation using extended right lobe grafts. Ann Surg 1997;226:261.
43. Sotiropoulos GC, Bockhorn M, Sgourakis G, Brokalaki EI, Molmenti EP, Neuhauser M, et al. R0 liver resections for primary malignant liver tumors in the noncirrhotic liver: a diagnosis-related analysis. Dig Dis Sci 2009 Apr;54(4):887-94.
44. Poon RT, Fan ST. Resection prior to liver transplantation for hepatocellular carcinoma: a strategy of optimizing the role of resection and transplantation in cirrhotic patients with preserved liver function. Liver Transpl 2004 Jun;10(6):813-5.
45. Tanaka H, Kubo S, Tsukamoto T, Shuto T, Takemura S, Yamamoto T, et al. Recurrence rate and transplantability after liver resection in patients with hepatocellular carcinoma who initially met transplantation criteria. Transplant Proc 2005 Mar;37(2):1254-6.
46. Hu RH, Ho MC, Wu YM, Yu SC, Lee PH. Feasibility of salvage liver transplantation for patients with recurrent hepatocellular carcinoma. Clin Transpl 2005;19:175-80.
47. Belghiti J, Cortes A, Abdalla EK, Regimbeau JM, Prakash K, Durand F, et al. Resection prior to liver transplantation for hepatocellular carcinoma. Ann Surg 2003 Dec;238(6):885-92.
48. Poon RT, Fan ST. Is primary resection and salvage transplantation for hepatocellular carcinoma a reasonable strategy? Ann Surg 2004 Nov;240(5):925-8.
49. Belghiti J, Cortes A, Abdalla EK, Regimbeau JM, Prakash K, Durand F, et al. Resection prior to liver transplantation for hepatocellular carcinoma. Ann Surg 2003 Dec;238(6):885-92.
50. Sala M, Fuster J, Llovet JM, Navasa M, Sole M, Varela M, et al. High pathological risk of recurrence after surgical resection for hepatocellular carcinoma: an indication for salvage liver transplantation. Liver Transpl 2004 Oct;10(10):1294-300.
51. Chok KS, Ng KK, Poon RT, Lo CM, Fan ST. Impact of postoperative complications on long-term outcome of curative resection for hepatocellular carcinoma. Br J Surg 2009;96:81-7.
52. Yang LY, Fang F, Ou DP, Wu W, Zeng ZJ, Wu F. Solitary large hepatocellular carcinoma: a specific subtype of hepatocellular carcinoma with good outcome after hepatic resection. Ann Surg 2009 Jan;249(1):118-23.
53. Benzoni E, Molaro R, Cedolini C, Favero A, Cojutti A, Lorenzin D, et al. Liver resection for HCC: analysis of causes and risk factors linked to postoperative complications. Hepatogastroenterology 2007 Jan;54(73):186-9.
54. Cillo U, Vitale A, Brolese A, Zanus G, Neri D, Valmasoni M, et al. Partial hepatectomy as first-line treatment for patients with hepatocellular carcinoma. J Surg Oncol 2007 Mar 1;95(3):213-20.
55. Vivarelli M, Bellusci R, Cucchetti A, Cavrini G, De RN, Aden AA, et al. Low recurrence rate of hepatocellular carcinoma after liver transplantation: better patient selection or lower immunosuppression? Transplantation 2002 Dec 27;74(12):1746-51.
56. Cillo U, Vitale A, Bassanello M, Boccagni P, Brolese A, Zanus G, et al. Liver transplantation for the treatment of moderately or well-differentiated hepatocellular carcinoma. Ann Surg 2004 Feb;239(2):150-9.
57. Schwartz M. Liver transplantation: the preferred treatment for early hepatocellular carcinoma in the setting of cirrhosis? Ann Surg Oncol 2007 Feb;14(2):548-52.
58. Kim BW, Park YK, Kim YB, Wang HJ, Kim MW. Salvage liver transplantation for recurrent hepatocellular carcinoma after liver resection: feasibility of the Milan criteria and operative risk. Transplant Proc 2008 Dec;40(10):3558-61.
59. Del Gaudio M, Ercolani G, Ravaioli M, Cescon M, Lauro A, Vivarelli M, et al. Liver transplantation for recurrent hepatocellulr carcinoma on cirrhosis after liver resection: University of Bologna Experience. American Journal of Transplantation 2008;8:1177-85.





