R. S. ROß, S. VIAZOV, T. HITZIGER, M. ROGGENDORF, ESSEN
Das Nationale Referenzzentrum für Hepatitis C stellt sich vor

PD Dr. R. S. Roß
Das NRZ für das Hepatitis C-Virus (HCV) ist seit mehr als einem Jahrzehnt am Institut für Virologie des Universitätsklinikums Essen angesiedelt. Seine grundlegenden Aufgaben sind - wie auch die der zurzeit 15 anderen NRZ - in einem generellen Katalog niedergelegt.1
DIAGNOSTIK UND QUALITÄTSSICHERUNG
Die analytische Sensitivität der heute zum anti-HCV-Nachweis eingesetzten Enzymimmuno-Assays (EIAs) der dritten Generation beläuft sich auf 98-100%.2 Dem korrespondiert in einem Untersuchungsgut beispielsweise chronisch Leberkranker mit einer unterstellten HCV-Prävalenz von 60% ein positiver prädiktiver Wert (PPW) von nahezu 100%, wohingegen sich für das HCV-"Screening" der bundesdeutschen Normalbevölkerung (HCV-Prävalenz: 0,4%3) für die EIAs der dritten Generation ein PPW von nur rund 20% errechnet. Daher ist gerade in Kollektiven, die nur ein geringes Risiko aufweisen, sich mit HCV zu infizieren, die Durchführung so genannter Bestätigungsteste noch immer unerlässlich, um die im EIA gemessene Reaktivität entweder zu veri- oder zu falsifizieren. Doch auch die als Bestätigungsteste überwiegend verwandten Immunoblot-Assays führen keineswegs in allen Fällen zu einer definitiven Klärung der serologischen Befundkonstellation. Dies macht ein exemplarischer Blick auf die Ergebnisse von Untersuchungen an französischen Blutspendern deutlich: Unter mehr als zwei Millionen Spenden fanden sich 758 Plasmen, die im Immunoblot eine isolierte Reaktivität gegen HCV-Core, -NS 3, -NS 4 bzw. -NS 5 aufwiesen. Lediglich sieben dieser Spenden stammten von akut respektive chronisch HCV-Infizierten.4 In den verbleibenden 751 Fällen gelang es auch durch in Abständen von einigen Monaten mehrfach wiederholte Analysen nicht, die Ursache für die im HCV-Immunoblot beobachtete isolierte Reaktivität aufzuklären, so dass unklar blieb, ob es sich dabei bloß um eine unbedeutende analytische Unspezifität oder doch um eine ausgeheilte HCV-Infektion handelte. Derartige serologische Befundkonstellationen ziehen häufig nicht nur ganze Serien von Folgeuntersuchungen nach sich, die fast ausschließlich das bereits initial fragliche Resultat bestätigen, sondern werfen bisweilen auch gravierende Fragen auf wie beispielsweise die nach dem Vorliegen einer eventuell abgelaufenen HCV-Infektion im Rahmen des berufsgenossenschaftlichen Prüfungsverfahrens von Verdachtsanzeigen.5 Hier stellt dann die Untersuchung der zellulären Immunantwort faktisch die einzig verbleibende Möglichkeit dar, um zu einer definitiven diagnostischen Aussage zu gelangen.6
Ein von uns initiiertes Projekt war daher darauf ausgerichtet, diese zelluläre Immunantwort bei HCV RNA negativen Personen mit isolierter anti-HCV-Reaktivität detailliert zu untersuchen. Aus den Vollblut-Proben, die von Blutspendediensten im gesamten Bundesgebiet stammten, wurden in einem ersten Schritt über eine Dichtegradienten-Zentrifugation die peripheren mononukleären Zellen (PBMCs) isoliert und anschließend mit rekombinanten HCV-Proteinen stimuliert. Das Maß der potentiellen Stimulierbarkeit der Zellen ermittelten wir über deren Proliferation und ihre Fähigkeit, Interferon-γ zu sezernieren, wobei neben dem 3H-Thymidin- und dem ELISpot-Assay auch der CFSE-Test eingesetzt wurde, der eine Zellproliferation insofern erkennen lässt, als bei jedem Teilungsschritt die intrazelluläre und durchflusszytometrisch erfassbare "Farbstoffkonzentration" abnimmt.
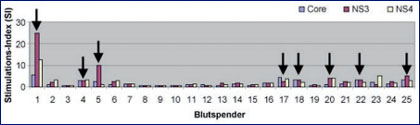
Abb. 1: Im 3H-Thymidin-Proliferations-Assay gemessene Stimulationsindices nach Inkubation der PBMCs von 25 Blutspendern mit verschiedenen rekombinanten HCV-Antigenen (Core, NS 3 und NS 4). Die Pfeile kennzeichnen über dem testspezifischen "cut-off" liegende Werte
In Abbildung 1 sind die Resultate der 3H-Thymidin-Proliferationsassays bei 25 der untersuchten Blutspender mit isolierter anti-HCV-Reaktivität dargestellt. Für die Spender 1, 4, 5, 17, 18, 20, 22 und 25 konnten mit mindestens einem der drei zur Stimulation der PBMCs verwandten rekombinanten HCV-Antigene Werte oberhalb des testspezifischen "cut-offs" nachgewiesen werden. Die Ergebnisse der CFSE-Assays und der ELISpot-Analysen bestätigten im allgemeinen die Resultate der Proliferations-Tests, so dass bei acht der 25 Blutspender von einer ausgeheilten HCV-Infektion auszugehen war, während bei den übrigen Personen die Reaktivitäten im anti-HCV-EIA und im bestätigenden Immunoblot als eher unspezifisch gelten mussten.
RINGVERSUCH ZUR HCV-GENOTYPISIERUNG
Die zunehmende Bedeutung der HCV-Genotypisierung für die Planung und Überwachung beispielsweise einer antiviralen Kombinationstherapie chronischer HCV-Infektionen7 ließ es sinnvoll erscheinen, die zur Charakterisierung von HCV-Varianten in diagnostischen Laboratorien regelmäßig eingesetzten Verfahren einer strikteren Qualitätskontrolle als bisher zu unterwerfen und daher - erstmals in Deutschland - einen Ringversuch zur HCV-Genotypisierung anzubieten. Dieses Vorhaben konnten wir im Herbst 2006 gemeinsam mit Herrn Prof. Dr. H. Zeichhardt und Herrn Dr. H.-P. Grunert (Institut für Virologie, Charité, CBF, Berlin) in Zusammenarbeit mit INSTAND (Gesellschaft zur Förderung der Qualitätssicherung in medizinischen Laboratorien e. V., Düsseldorf) realisierten. Die in den Ringversuch-Proben enthaltenen HCV-Isolate wurden mittels kommerziell erhältlicher Assays zur HCV-Genotypisierung sowie durch direkte Sequenzierung von Fragmenten aus unterschiedlichen Abschnitten des HCV-Genoms mit anschließender phylogenetischer Analyse charakterisiert. Insgesamt nahmen 94 Laboratorien an diesen Ringversuch teil. Zutreffende Genotyp-Zuordnungen wurden in 93-99% erreicht, während sich die Rate richtiger Subtypisierungen lediglich auf 68-88% belief.
Derartige Ringversuche zur externen Kontrolle der in diagnostischen Laboratorien verwandten Verfahren zur Typisierung von HCV-Isolaten sollen Interessierten von INSTAND in Kooperation mit dem NRZ für HCV zukünftig einmal im Jahr angeboten werden.
TYPISIERUNG VON HCV-ISOLATEN
Pro Woche erreichen uns durchschnittlich 10-15 Einsendungen von niedergelassenen Kollegen, aus diagnostischen Laboratorien, Blutbanken und Krankenhäusern. Sie betreffen hauptsächlich Seren oder Plasmen mit auswärts unklarer HCV-Befundkonstellation, oder es handelt sich um Proben, die mit den verfügbaren kommerziellen Testsystemen zur HCV-Genotypisierung nicht eindeutig klassifizierbar waren.
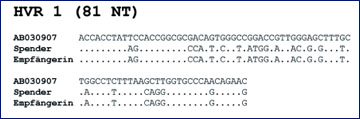
Abb. 2: Sequenzen der 81 Nukleotide (NT) umfassenden hypervariablen Region 1 (HVR 1) des HCV, wie sie beim Blutspender, der Empfängerin des Erythrozyten-Konzentrats sowie in einem epidemiologisch nicht verwandten HCV-Subtyp 2b-Isolat aus der GenBank (AB030907) nachgewiesen wurden. Verändert nach9
Ein im Kontext der weitergehenden "Feintypisierung" bemerkenswerter Fall, dessen diagnostische Klärung in Zusammenarbeit mit der betroffenen Blutspende-Einrichtung und dem Paul-Ehrlich-Institut gelang, sei hier stellvertretend für andere gleichgelagerte etwas ausführlicher beschrieben: Im Jahr 2005 wurde bei einem Mehrfachblutspender erstmals eine HCV-Infektion diagnostiziert. Von der letzten anti-HCV- und HCV-RNA-negativen ("Minipool-Testung") Spende hatte man im vorangegangenen Oktober ein Erythrozyten-Konzentrat und ein Frischplasma gewonnen, von denen lediglich das Konzentrat appliziert wurde. Die Empfängerin der Transfusion, eine 81jährige Patientin, die sich zuvor einer tumorbedingten Nephrektomie sowie einer Cholezystektomie unterzogen hatte, erwies sich als ebenfalls mit HCV infiziert. Sowohl beim Spender (nach dessen Serokonversion) als auch bei der Patientin ließ sich ein HCV-Isolat des in Deutschland unverändert seltenen Subtypen 2b nachweisen.8 Die Sequenzen der beiden Virus-Varianten stimmten nicht nur im gut konservierten "Core-Bereich" des HCV-Genoms, sondern auch in der hypervariablen Region 1 (HVR 1) zu 100% überein, so dass beide Personen mit demselben HCV-Isolat infiziert waren (Abb. 2).
Das noch vorhandene Frischplasma vom Oktober 2004 diente als Ausgangsmaterial für Untersuchungen mit verschiedenen kommerziell verfügbaren Assays zum qualitativen und quantitativen HCV-RNA-Nachweis. Die HCV-RNA-Konzentration der Probe war derart niedrig, dass sie sich in den meisten der angewandten Verfahren der Detektion selbst auf der Ebene der "Einzeltestung" der Spende entzog. Zudem ergaben sich teilweise erhebliche Diskrepanzen zwischen der vom Hersteller angegebenen analytischen Sensitivität der Tests und deren tatsächlicher Leistungsfähigkeit, was in diesem Fall wohl am ehesten auf das Vorliegen einer Infektion mit einem Genotyp 2-Isolat zurückzuführen war.9
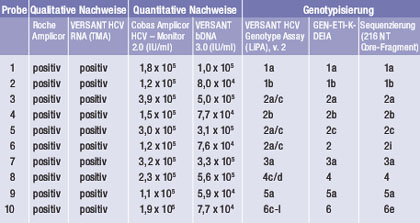
Tab. 1: Charakteristika der Proben des so genannten "HCV-Genotypisierungs-Panels", das vom NRZ HCV auf Anfrage zur Verfügung gestellt wird
SAMMLUNG VON REFERENZSTÄMMEN
Bereits seit 1998 bietet das NRZ HCV ein umfassend charakterisiertes Genotypisierungs-Panel an (http://www.uni-duisburg-essen.de/ virologie/hc_hcv-panel.html. Letzter Zugang: 24. September 2008)10, das sich in der Zwischenzeit zu einer international anerkannten Referenzpräparation entwickelt hat, die Anwendung findet sowohl zur Qualitätskontrolle von Genotypisierungsmethoden in diagnostischen Laboratorien als auch zur Standardisierung von PCR-Methoden und insbesondere zum Nachweis einer genotyp-unabhängigen Detektion bzw. Quantifizierung von HCV RNA mittels Nukleinsäure-Amplifikations-Techniken dient. Diese "Stammsammlung" wurde bereits hunderten diagnostischer Laboratorien im In- und Ausland zur Verfügung gestellt und enthält Varianten aller wesentlichen HCV-Geno- bzw. -Subtypen (Tab. 1).
BERATUNGSTÄTIGKEIT
Die Beratungstätigkeit stellt einen ebenso essentiellen wie zeitaufwendigen Teil des Katalogs der Aufgaben der NRZ dar. Durchschnittlich erreichten uns in den letzten Jahren schätzungsweise täglich 20 Anfragen, die meisten davon telefonisch oder per E-Mail. Inhaltlich bezogen sie sich überwiegend auf die Auswahl diagnostischer Methoden, die Interpretation unklarer diagnostischer Befundkonstellationen, die HCV-Übertragbarkeit, das Infektionsrisiko, die Möglichkeiten einer antiviralen Behandlung akuter und chronischer HCV-Infektionen einschließlich des notwendigen Therapiemonitoring sowie schließlich eventuelle berufliche Tätigkeitseinschränkungen, die HCV Infizierten auferlegt werden sollten. In mehreren Fällen waren wir in der Vergangenheit als Gutachter zu so genannten lokalen Expertengremien geladen, die über die Frage der Weiterbeschäftigung operativ tätiger, HCV infizierter Mitarbeiter zu entscheiden hatten. Regelmäßig versenden wir Informationsmaterial an Ärzte und Patienten, die sich mit der Bitte um Unterstützung an uns wenden und kommen darüber hinaus unserer Beratungstätigkeit auch durch das Halten zahlreicher Fortbildungsvorträge und die Ausrichtung entsprechender Weiterbildungsveranstaltungen nach.
INTERNATIONALE ZUSAMMENARBEIT
Wie jedes wissenschaftlich tätige Laboratorium, so arbeiten auch wir im Rahmen unserer Aufgabenstellung als NRZ für HCV mit vielen Referenzinstitutionen des Auslands zusammen. Exemplarisch sind hier das Institut für Virologie der Universität Wien, das "Biomedical Research and Study Centre" in Riga sowie der "Hepatitis Branch" der "Centers for Disease Control and Prevention" in Atlanta zu nennen. Auf internationaler Ebene fungierten wir als "Sollwert-Laboratorium" für die verschiedenen "HCV-Panels" der "Quality Control for Molecular Diagnostics" (QCMD)-Gruppe (http://www.qcmd.org/index.php. Letzter Zugang: 24. September 2008). Zudem stellten wir interessierten Nutzern in der ganzen Welt über die "HCV Sequence Database" (http://www.hcvdb.org/index.asp?bhcp=1. Letzter Zugang: 24. September 2008) Primersequenzen und Protokolle zur HCV-Typisierung zur Verfügung, die wir seit langem verwenden.
SURVEILLANCE-PROJEKTE
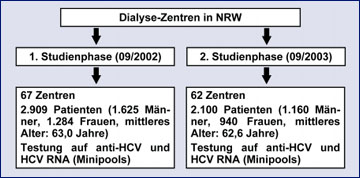
Abb. 3: "Design" der Studie zur Ermittlung der HCV-Inzidenz unter nordrhein-westfälischen Hämodialyse-Patientinnen und -Patienten
Unter den zahlreichen von uns seit der Bestellung zum NRZ für HCV initiierten Surveillance-Projekten nimmt eine prospektive Studie zur HCV-Inzidenz unter Patientinnen und Patienten in nordrhein-westfälischen Hämodialyse-Zentren schon allein wegen ihres Umfangs sowie des damit verbundenen organisatorischen und analytischen Aufwands eine Sonderstellung ein. Das "Design" dieser groß angelegten Untersuchung ist in Abbildung 3 schematisch dargestellt.
In der ersten Studienphase konnten wir bei 2.909 Individuen aus 67 Einrichtungen eine bestätigte HCV-Antikörper-Prävalenz von 5% und in 4% der Fälle eine Virämie feststellen. In einer "nested" Fall-Kontroll-Analyse ergaben sich als statistisch signifikante Risikofaktoren für eine HCV-Transmission die Applikation von Blutprodukten vor 1991 (RR 1,9) sowie die Zahl der Jahre, die sich die Patienten bereits einer Dialyse-Behandlung unterziehen mussten (RR 1,12). Die zweite Studienphase begann exakt ein Jahr nach der ersten. Insgesamt war es uns möglich, bei rund 72% der ursprünglich in die Erhebung einbezogenen 2.909 Patientinnen und Patienten innerhalb dieses einen Jahres zweimal den "HCV-Status" zu bestimmen und so "belastbare" Daten zur HCV-Inzidenz im Risikokollektiv der Hämodialysierten zu gewinnen. In 125 der 2.100 (5%) Patientenseren waren HCV-Antikörper mittels Elisa und Immunoblot nachweisbar; die Rate der Virämie belief sich wiederum auf 4%. In keinem einzigen Fall ereignete sich in den beteiligten 62 Dialyse-Zentren jedoch eine HCV-Neuinfektion. Auch fanden sich in der zweiten Studienphase keine Seren, in denen HCV RNA bei fehlenden Antikörpern isoliert nachweisbar war.
Das Ausbleiben jeglicher HCV-Neuinfektion in diesem Patienten-Kollektiv konnte nun prinzipiell einerseits begründet sein in der strikten Einhaltung strenger allgemein-hygienischer Kautelen oder andererseits gerade als Erfolg der "Separationsmaßnahmen" gewertet werden, die in den beteiligten Einrichtungen angewandt wurden. Um der Frage nachzugehen, welchem der beiden genannten Faktoren die unerwartet niedrige HCV-Inzidenz in den Hämodialyse-Zentren wohl geschuldet ist, untersuchten wir Seren von mehr als 400 der Probanden auch auf GBV-C RNA. Dabei ließen sich über die einjährige prospektive Studienphase hinweg zwar bei drei Patienten eine de novo Infektionen mit GBV-C nachweisen. Die phylogenetische Analyse der erhaltenen 354 Nukleotide langen NS5-Fragmente zeigte jedoch, dass die infrage stehenden drei Isolate mit keinem derjenigen GBV-C-"Stämme" hinreichend übereinstimmten, die sich bei anderen ebenfalls mit diesem Virus infizierten Patienten innerhalb derselben Zentren fanden. Die drei GBV-C Neuinfektionen wurden daher nicht durch die Behandlung in den Dialyse-Zentren hervorgerufen, und es schien somit der Schluss gerechtfertigt, dass das gänzliche Fehlen von HCV-Neuinfektionen neben den "Separationsmaßnahmen" offensichtlich auch den allgemein hohen Hygiene-Standards und der strikten Beachtung der so genannten "universal precautions" in den Dialyse-Einrichtungen zuzuschreiben war.11
"AUSBRUCHSUNTERSUCHUNGEN"
An uns gerichtete Fragen zu Häufungen von HCV-Infektionen und die damit zusammenhängende Bitte, geeignete molekularbiologische Untersuchungen durchzuführen, entstammen immer wieder dem "nosokomialen Kontext". Als besonders heikel erweisen sich dabei Situationen, in denen eine Übertragung des Virus von infiziertem medizinischem Personal auf von ihm behandelte Patientinnen und Patienten vorliegt.12 In diesen Fällen sind so genannte Rückschau-Untersuchungen meist unvermeidlich.
Einer der bislang umfangreichsten derartigen "Surveys" überhaupt ereignete sich vor folgendem Hintergrund: Ende Dezember 1999 hatte sich eine junge Frau einer Kaiserschnitt-Entbindung unterzogen. Sie erkrankte rund neun Wochen später an einer akuten, ikterischen Hepatitis C. Als im März 2000 bekannt wurde, dass ein an der Sectio beteiligter Gynäkologe ebenfalls mit HCV infiziert war, leiteten die Verantwortlichen vor Ort epidemiologische Untersuchungen zur weiteren Klärung des Sachverhalts ein. Die junge Patientin wies keine Risikofaktoren für eine HCV-Infektion auf und in ihrer medizinischen Vorgeschichte war es auch nicht zu Hepatitis-Erkrankungen gekommen. In einer am 6. Januar 2000 von ihr entnommenen Serumprobe fanden sich weder HCV-Antikörper noch HCV RNA. Bei dem betroffenen Gynäkologen bestanden bereits seit mindestens Juli 1993 Erhöhungen der "Transaminasen". Eine HCV-Infektion wurde erstmals 1997 diagnostiziert. Die von uns durchgeführten molekularbiologischen Analysen zeigten, dass die Patientin und der Gynäkologe mit dem HCV-Subtyp 1b infiziert waren. Beide HCV-Isolate stimmten in der HVR 1 zu 100% überein und wiesen zudem eine seltene, charakteristische Insertion auf. Angesichts dieses Befundes wie auch der epidemiologischen Zusammenhänge musste eine Übertragung des Virus durch den infizierten Gynäkologen auf die Patientin während der Kaiserschnitt-Entbindung Ende Dezember 1999 unterstellt werden. Da die Möglichkeit bestand, dass der langjährig HCV positive Gynäkologe während seiner operativen Tätigkeit weitere Patientinnen mit HCV infiziert hatte, wurden alle Frauen retrospektiv auf Zeichen einer HCV-Infektion untersucht, die der Gynäkologe zwischen dem 1. Juli 1993 (Beginn der Tätigkeit im Krankenhaus) und dem 15. März 2000 (vorläufiges krankheitsbedingtes Ende der Tätigkeit) operiert hatte. Betroffen von dieser singulären Maßnahme waren insgesamt 2.907 frühere Patientinnen, von denen insgesamt 2.285 (78,6%) nachuntersucht werden konnten. Sieben der Frauen waren HCV positiv; bei fünf von ihnen fand sich zum Zeitpunkt der Untersuchung HCV RNA. Die nachgewiesenen HCV-Isolate stimmten ausweislich der Nukleinsäure-Sequenzierung und Typisierung mittels phylogenetischer Analyse nicht mit dem des Gynäkologen und der Index-Patientin überein. Somit ergab sich kein Anhalt dafür, dass der infizierte Gynäkologe das Virus auf eine der retrospektiv untersuchten Patientinnen übertragen hatte, was in einer glücklicherweise nur sehr niedrigen Transmissions-Rate von insgesamt 0,04% resultierte (1/2.286; 95% Konfidenz-Intervall: 0,008%-0,25%).13
Eine zweites von uns wesentlich unterstütztes "Look-Back" betraf frühere Patientinnen und Patienten eines Traumatologen, der seit mindestens August 1999 an einer berufsbedingten HCV-Infektion litt. Da es initial keinerlei Hinweise auf eine iatrogene Übertragung des Virus gab, schloss die Erhebung zunächst nur diejenigen 229 Operierten ein, an denen der Chirurg für sich selbst besonders verletzungsträchtige Eingriffe vorgenommen hatte. Unter den schließlich 207 Nachuntersuchten fanden sich drei HCV-Infizierte. Die molekularen und epidemiologischen Untersuchungen ergaben eindeutig, dass zwei dieser Infektionen nicht zu Lasten des Chirurgen gingen, während beim dritten Patienten - ebenso wie bei seinem Operateur - der in Deutschland seltene HCV-Subtyp 2b nachgewiesen wurde. Die analysierten jeweils fünf klonalen Sequenzen der HVR 1 beider Varianten wiesen eine hohe Homologie auf und bildeten in der phylogenetischen Analyse einen auch statistisch signifikant von den anderen Isolaten unterscheidbaren "Cluster". Das Resultat belegte gemeinsam mit den epidemiologischen Analysen, dass der Chirurg seinen Patienten höchstwahrscheinlich bei der Ende März 2000 erfolgten, kompliziert verlaufenden Hüftgelenks-Ersatz-Operation mit HCV infizierte.14 Hierbei handelte es sich unseres Wissens um die erste nachgewiesene iatrogene HCV-Übertragung durch einen infizierten Arzt während eines orthopädischen Eingriffs. Die mit 0,48% (1/207; 95% Konfidenzintervall: 0,09%-2,68%) vergleichsweise hohe Gesamt-Transmissionsrate erklärte sich wahrscheinlich dadurch, dass lediglich diejenigen Patientinnen und Patienten nachuntersucht wurden, die sich so genannten "exposureprone procedures"15 unterzogen hatten.
Schließlich erkrankte in einer norddeutschen Spezialklinik eine Patientin sechs Wochen nach einer Hüftgelenksoperation an einer akuten Hepatitis C. Im Rahmen der daraufhin eingeleiteten Nachforschungen stellte sich heraus, dass ihr Operateur ebenfalls an einer bisher unerkannten HCV-Infektion mit dem Subtyp 1b litt. Die Patientin hatte sich in der Zwischenzeit einer antiviralen Therapie unterzogen und war daher nicht mehr virämisch, so dass wir keinen Sequenz-Vergleich anstellen konnten. Da man in der betroffenen Klinik allerdings den zeitlichen Zusammenhang zwischen Eingriff und akuter HCV-Infektion als ein starkes Indiz für eine intraoperative Übertragung des Erregers wertete, wurde nach Maßgabe der einschlägigen Richtlinien ein lokales Expertengremium mit dem Fall befasst. Diese Kommission entschied, dass alle Patientinnen und Patienten, die der Chirurg im Zeitraum von 1996-2001 operiert hatte, retrospektiv auf Marker einer HCV-Infektion zu untersuchen seien. Insgesamt waren von dieser "Rückschau" 1.508 Personen betroffen. Für 1.250 (82,5%) von ihnen ließen sich entsprechende Befunde erheben, wobei unsere molekularbiologischen Analysen den Verdacht, dass es zu weiteren Arzt-Patient-Übertragungen des HCV gekommen sein könnte, in keinem Fall hinreichend untermauerten.16
ERARBEITUNG VON EMPFEHLUNGEN
Über unsere reguläre Berichts- und Beratungspflicht hinaus waren wir wiederholt federführend an der Formulierung von Empfehlungen und Leitlinien beteiligt. Zu nennen sind unter anderem:
- Die Empfehlungen der Deutschen Vereinigung zur Bekämpfung der Viruskrankheiten (DVV) zur Prävention der nosokomialen Übertragung von Hepatitis B-Virus (HBV) und Hepatitis C-Virus (HCV) durch im Gesundheitswesen Tätige.17
- Die europäische Konsensus-Empfehlung: "Guidelines for prevention of transmission of HBV and HCV from health-care workers to patients".18
- Die Leitlinien zur Diagnostik von HCV-Infektionen durch die Gesellschaft für Virologie, die Deutsche Vereinigung zur Bekämpfung der Viruskrankheiten sowie die deutsche Gesellschaft für Verdauungs- und Stoffwechselerkrankungen.19
- Die "consensus proposals for a unified system of nomenclature of HCV genotypes".20
- Die Neufassung des Votums 34 das "Arbeitskreises Blut" (http://www.rki.de/cln_049/nn_206134/DE/Content/Infekt/Blut/AK__Blut/Voten/voten__node.html?__nnn=true. Letzter Zugang: 24. September 2008).
Literatur
1. N. N. Evaluation der Nationalen Referenzzentren. Epidemiol Bull 24/2007; 205.
2. Chevalier S, Pawlotsky JM. Use of virological assays in the diagnosis and management of hepatitis C virus infection. Clin Liver Dis 2005; 9: 371-382.
3. Thierfelder W, Hellenbrand W, Meisel H, Schreier E, Dortschy R. Prevalence of markers for hepatitis A, B and C in the German population. Results of the German National Health Interview and Examination Survey 1998. Eur J Epidemiol 2001; 17: 429-435.
4. Lemaire JM, Courouce AM, Defer C, Bouchardeau F, Coste J, Agulles O, Cantaloube JF, Barlet V, Barin F. HCV RNA in blood donors with isolated reactivities by third-generation RIBA. Transfusion 2000; 40: 867-870.
5. Roß RS, Niederau C, Viazov S, Schreier E, Heberer J, Häussinger D, Roggendorf M. Begutachtungsfragen bei akuter und chronischer Hepatitis C. In: Häussinger D, Niederau C (Hrsg.). Hepatitis C. 2. Auflage. Boston et al.: Blackwell 2001: 347-373.
6. Takaki A, Wiese M, Maertens G, Depla E, Seifert U, Liebetrau A, Miller JL, Manns MP, Rehermann B. Cellular immune responses persist and humoral responses decrease two decades after recovery from a single-source outbreak of hepatitis C. Nat Ned 2000; 6: 578-582.
7. Weck K. Molecular methods of hepatitis C genotyping. Expert Rev Mol Diag 2005; 5, 507-520.
8. Roß RS, Viazov S, Renzing-Köhler K, Roggendorf M. Changes in the epidemiology of hepatitis C infection in Germany: shift in the predominance of hepatitis C subtypes. J Med Virol 2000 60: 122-125.
9. Kretzschmar E, Chudy M, Nübling CM, Roß RS, Kruse F, Trobisch H. First case of hepatitis C virus transmission by a red blood cell concentrate after introduction of nucleic acid amplification technique screening in Germany: a comparative study with various assays. Vox Sang 2007; 92: 297-301.
10. Roß RS, Viazov S, Fiedler M, Roggendorf M. Plasma panel for standardisation of hepatitis C virus genotyping techniques. Lab Med 1998; 22: 673.
11. Roß RS, Viazov S, Clauberg R, Wolters B, Fengler I, Eveld K, Scheid-hauer R, Hüsing J, Philipp Th, Kribben A, Roggendorf M. Lack of de novo hepatitis C virus infections and absence of nosocomial transmissions of GB virus C in a large cohort of German haemodialysis patients. J Viral Hepat. Im Druck.
12. Roß RS, Viazov S, Roggendorf M. Zur Diskussion um nosokomiale Hepatitis-C-Übertragungen durch infiziertes medizinisches Personal. Dt Med Wschr 2000; 125: 1055-1057.
13. Roß RS, Viazov S, Thormählen M, Bartz L, Tamm J, Rautenberg P, Roggendorf M, Deister A. Incident Investigation Team. Risk of hepatitis C virus transmission from an infected gynecologist to patients: Results of a 7-year retrospective investigation. Arch Intern Med 2002; 162: 805-810.
14. Roß RS, Viazov S, Roggendorf M. Phylogenetic analysis indicates transmission of hepatitis C virus from an infected orthopedic surgeon to a patient. J Med Virol 2002; 66: 461-467.
15. Centers for Disease Control (CDC). Recommendations for preventing transmission of human immunodeficiency virus and hepatitis B virus to patients during exposure-prone invasive procedures. Morbid Mortal Wkly Rep MMWR 1991; 40 (RR08): 1-9.
16. Roß RS, Frommelt L, Viazov S, Roggendorf M. Lack of hepatitis C virus transmission from an infected orthopedic surgeon. Jahrestagung der Gesellschaft für Virologie, Abstractband 2003: 179.
17. Deutsche Vereinigung zur Bekämpfung der Viruskrankheiten (DVV). Empfehlungen zur Prävention der nosokomialen Übertragung von Hepatitis B-Virus (HBV) und Hepatitis C-Virus (HCV) durch im Gesundheitswesen Tätige (Stand Juli 2007). In: Roß RS, Roggendorf M (Hrsg.). Übertragungsrisiko von HBV, HCV und HIV durch infiziertes medizinisches Personal. 2. Auflage, Lengerich et al.: Pabst Science Publishers 2007: 139-148.
18. Gunson RN, Shouval D, Roggendorf M, Zaaijer H, Nicholas H, Holzmann H, de Schryver A, Reynders D, Connell J, Gerlich WH, Marinho RT, Tsantoulas D, Rigopoulou E, Rosenheim M, Valla D, Puro V, Struwe J, Tedder R, Aitken C, Alter M, Schalm SW, Carman WF, European Consensus Group. Hepatitis B virus (HBV) and hepatitis C virus (HCV) infections in health care workers (HCWs): guidelines for prevention of transmission of HBV and HCV from HCW to patients. J Clin Virol 2003; 27: 213-230.
19. Dienes HP. Definition und Diagnostik der akuten und chronischen Hepatitis C. Z Gastroenterol 2004; 42: 705-706.
20. Simmonds P, Bukh J, Combet C, Deleage G, Enomoto N, Feinstone S, Halfon P, Inchauspe G, Kuiken C, Maertens G, Mizokami M, Murphy DG, Okamoto H, Pawlotsky JM, Penin F, Sablon E, Shin-I T, Stuyver LJ, Thiel HJ, Viazov S, Weiner AJ., Widell A. Consensus proposals for a unified system of nomenclature of hepatitis C virus genotypes. Hepatology 2005; 42: 962-973.





