THOMAS BERG, BERLIN
Chronische Hepatitis C-Therapie Management von Relapse und Nonresponse
Die Indikation zur Re-Therapie nach erfolgloser Behandlung der chronischen Hepatitis C sollte differenziert gestellt werden. Die Chancen auf ein dauerhaftes Ansprechen sind abhängig von der Art der Vortherapie, den Gründen für das frühere Therapieversagen sowie der Viruskinetik bei Re-Therapie. Eine Verlängerung der Therapiedauer hilft, das dauerhafte virologische Ansprechen zu verbessern.
| Charakteristika | Anzahl Patienten (%) Alle n=2.312 |
|---|---|
| Männlich | 1.650 (71%) |
| Vortherapie mit Standard-IFNα + Ribavirin | 1.425 (62%) |
| Vortherapie mit Peg-IFNα2a plus Ribavirin | 375 (16%) |
| Vortherapie mit Peg-IFNα2b plus Ribavirin | 488 (21%) |
| Relapse auf Vortherapie | 647 (28%) |
| Nonresponse auf Vortherapie | 1.401 (61%) |
| Therapieversagen nicht eindeutig definiert | 264 (11%) |
| Fibrose F2 | 658 (28%) |
| Fibrose F3 | 676 (29%) |
| Fibrose F4 | 974 (43%) |
| HCV Typ 1 | 1.859 (80%) |
| HCV Typ 2 | 75 (3%) |
| HCV Typ 3 | 294 (13%) |
| HCV Typ 4 | 68 (3%) |
| HCV RNA = 600.000 IU/ml | 853 (37%) |
| HCV RNA > 600.000 IU/ml | 1.451 (63%) |
Tab. 1: EPIC-Studie: Patienten-Charakteristika
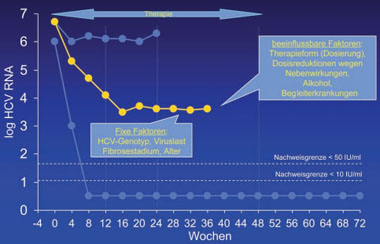
Abb. 1a: Gründe für eine Nonresponse
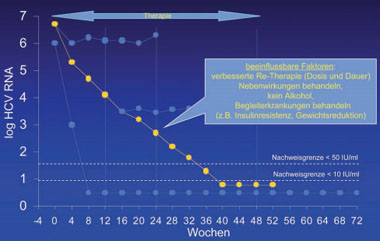
Abb. 1b: Möglichkeiten der Therapieoptimierung
| Charakteristika | Standard-IFNα+ Ribavirin (n=903) | Peg-IFNα-2a o.2b + Ribavirin (n=476) |
|---|---|---|
| Alle Patienten | 18% | 6% |
| G1 F4 | 7% | 4% |
| G1 F3 | 16% | 4% |
| G1 F2 | 18% | 6% |
| G2/3 F4 | 40% | 18% |
| G2/3 F3 | 39% | 38% |
| G2/3 F2 | 68% | 56% |
Tab. 2: SVR Raten bei Nonresponder Patienten in Abhängigkeit von der Art der Vortherapie (Standard- vs. Peg-IFNα), dem Fibrosestadium und HCV Typ
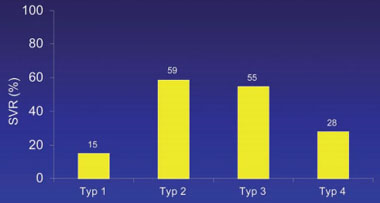
Abb. 2: EPIC-Studie: SVR-Raten in Abhängigkeit vom HCV Typ. (nach Poynard T et al. EASL 2008)
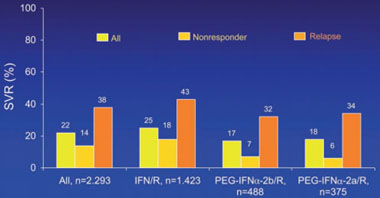
Abb. 3: EPIC-Studie: SVR-Raten in Abhängigkeit der Response auf die Vortherapie sowie die Form der
Vortherapie (Standard-IFNα plus Ribavirin [IFN/R] versus Peg-IFNα2a/2b plus Ribavirin
[Peg-IFNα/R]) (nach Poynard T et al. EASL 2008)
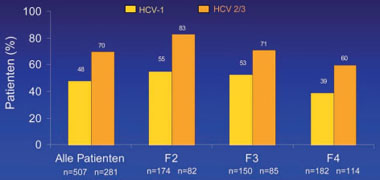
Abb. 4: SVR-Raten bei Patienten mit kompletter virologischer Response zur Woche 12 in Abhängigkeit
vom Fibrosestadium nach METAVIR und dem HCV Genotyp (nach Poynard T et al. EASL 2008)
| Absolute HCV-RNA Konzentration zur Therapiewoche 12 |
SVR % (Anzahl Patienten) |
|---|---|
| >750 IU/ml | 0% (0/53) |
| 500-750 IU/ml | 6% (1/17) |
| 250-500 IU/ml | 10% (2/21) |
| 125-250 IU/ml | 16% (5/32) |
| positiv aber nicht quantifizierbar | 23% (15/65) |
| Nicht nachweisbar (1) | 56% (463/823) |
| (1) Nachweisgrenze des real-time PCR Tests 125 IU/ml | |
Tab. 3: Bedeutung der absoluten HCV-RNA Konzentration für die SVR Wahrscheinlichkeit bei allen Patienten, die mindestens einen 2 log Abfall der HCV-RNA zur Woche 12 erreicht haben
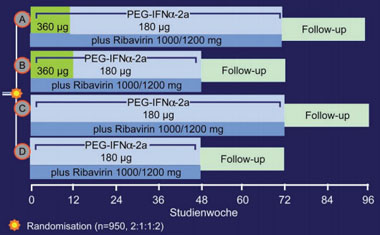
Abb. 5: REPEAT-Studie: Studiendesign
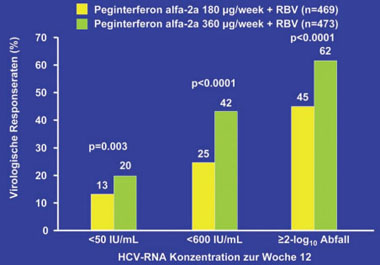
Abb. 6: REPEAT-Studie: Virologische Responseraten nach 12-wöchiger Induktionstherapie (360 µg
vs. 180 µg Peg-IFNα-2a plus Ribavirin) (nach Marcellin, EASL 2008)
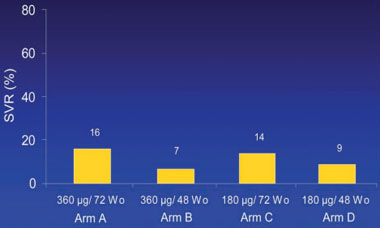
Abb. 7: REPEAT-Studie: SVR-Raten in den 4 Studienarmen (nach Jensen DM et al. AASLD 2007)
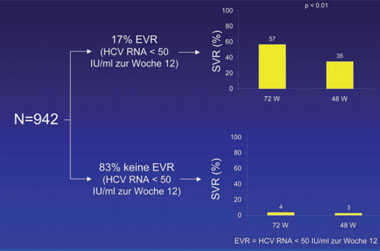
Abb. 8: REPEAT-Studie: SVR-Raten in Abhängigkeit von der virologischen Response und der
Therapiedauer. Nur Patienten mit Response zur Woche 12 profitieren signifikant von der Verlängerung
der Therapiedauer (nach Jensen DM et al. AASLD 2007)
| Charakteristik | Studienarm: Peg-IFNa Dosis und Therapiedauer | |||
|---|---|---|---|---|
| Arm A 360/180 µg/Wo 72 Wochen n=317 |
Arm B 360/180 µg/Wo 48 Wochen n=156 |
Arm C 180 µg/Wo 72 Wochen n=156 |
Arm D 180 µg/Wo 48 Wochen n=313 |
|
| Männlich | 64% | 60% | 69% | 68% |
| Kaukasier | 88% | 90% | 88% | 90% |
| Alter im Mittel ± SD (Jahre) |
48.1 ± 8.7 | 48.8 ± 9.9 | 49.4 ± 8.5 | 48.5 ± 9.0 |
| Gewicht im Mittel ± SD (kg) |
81.5 ± 18.2 | 81.1 ± 16.8 | 81.2 ± 16.0 | 80.9 ± 16.9 |
| HCV Typ 1 (%) | 91 | 91 | 91 | 91 |
| HCV RNA im Mittel ± SD (x 106 IU/ml) |
5.4 ± 6.4 | 5.3 ± 7.1 | 4.9 ± 5.1 | 4.9 ± 6.0 |
| Cirrhose (%) | 25 | 29 | 30 | 28 |
Tab. 4: REPEAT-Studie: Patienten-Charakteristika
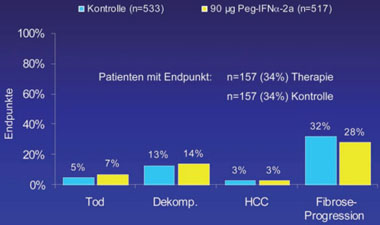
Abb. 9a: HALT-C Studie: Frequenz klinischer Endpunkte nach 3,5 Jahren Erhaltungstherapie mit 90 µg
Peg-IFNα2a versus unbehandelte Kontrollgruppe (nach Di Bisceglie AM et al. AASLD 2007; Abstract
LB#1)
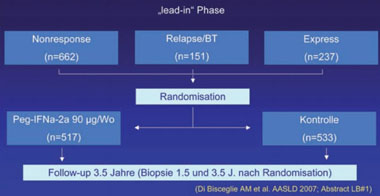
Abb. 9b: HALT-C Studie. Studiendesign
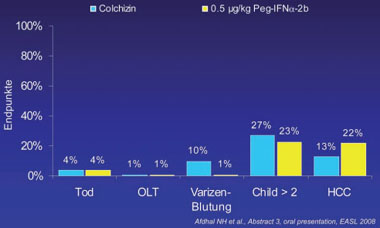
Abb. 10a: COPILOT-Studie: Frequenz klinischer Endpunkte nach 4 Jahren Erhaltungstherapie mit 0,5 µg/kg
Peg-IFNα2b versus eine Colchizin behandelten Kontrollgruppe. Nur hinsichtlich der Reduktion der Ösophagusvarizenblutung
zeigte sich ein Vorteil für die Peg-IFNα-behandelten Patienten (n gesamt = 555) (Afdhal NH
et al., Abstract 3, oral presentation, EASL 2008
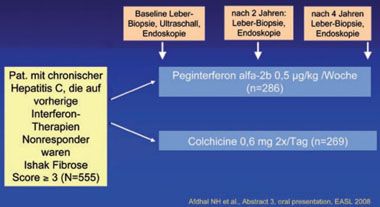
Abb. 10b: COPILOT-Studie. Studiendesign
Mit zunehmender Behandlungsfrequenz steigt die Zahl der Patienten, die keine anhaltende Remission erreichen, stetig an. Beim Therapieversagen müssen zwei unterschiedliche Formen unterschieden werden:
- Nonresponder-Patienten, bei denen es innerhalb von 12 Wochen zu keinem Abfall der Viruslast um =2 log Stufen kommt bzw. die zu Woche 24 weiterhin HCV-RNA positiv sind.
- Patienten mit Relapse, definiert durch ein komplettes virologisches Ansprechen (spätestens zur Woche 24 HCV-RNA negativ), aber mit Wiederauftreten der Hepatitis C-Virämie nach Therapieende.
Eine Re-Therapie mit Peg-Interferon alfa-2b plus Ribavirin ist sowohl für Patienten mit Nonresponse als auch Relapse zugelassen (die Zulassung für Peg-IFNα-2a wird erwartet). Eine differenzierte Betrachtung der Indikationsstellung zur Re-Therapie ist dennoch notwendig, da sich die therapeutischen Strategien und auch die zu erwartenden Heilungschancen bei Re-Therapie in Abhängigkeit vom Ansprechen der Primärtherapie deutlich unterscheiden. Ein besseres Verständnis der zugrunde liegenden Mechanismen der Nonresponse bzw. des Relapse wäre zusätzlich hilfreich, um optimierte Therapiestrategien zu etablieren.
GRÜNDE FÜR EINEN RELAPSE
Auch wenn die Mechanismen der unterschiedlichen Therapieresponse auf die Standardtherapie mit pegyliertem Interferon und Ribavirin im Einzelnen ungeklärt sind, so spricht doch vieles dafür, dass der Relapse vor allem die Folge einer unzureichenden Therapiedauer ist. Die Bedeutung der Ribavirindosis darf in diesem Zusammenhang aber auch nicht unterschätzt werden. Die Ribavirindosis hat einen entscheidenden Einfluss auf die Induktion und vor allem auf die Aufrechterhaltung der Response unter und nach Absetzen der Behandlung. Darüber hinaus besteht das Problem, dass ein negatives Ergebnis der HCV-RNA-Messung im Serum nicht mit einem kompletten Fehlen einer Hepatitis C-Virämie gleichzusetzen ist und auch nicht die Persistenz einer Replikation in anderen Kompartimenten ausschließt. Verlaufsdaten mit hoch-sensitiven HCV-RNA Assays sprechen dafür, dass auch Patienten mit raschem und markantem Abfall der Viruslast im weiteren Verlauf der Therapie über lange Therapiephasen hinweg (zum Teil bis zum Therapieende) weiterhin minimal virämisch bleiben können. Die Übergänge zwischen Relapse und Nonresponse können daher im Einzelfall fließend sein und es belegt, wie stark die Definition von Relapse bzw. Nonresponse von der Sensitivität der HCV-RNA Detektion abhängig ist.
GRÜNDE FÜR EINE NONRESPONSE
Nur ein geringer Prozentsatz (<10%) aller Patienten zeigt keinen Abfall der Virämie unter der antiviralen Kombinationstherapie. Bei der Mehrzahl der Patienten beobachtet man einen Abfall der Virämie um ca. 1 log Stufe innerhalb von 12 Wochen, entsprechend einer Reduktion der Viruslast um 90%. Der Begriff Nonresponse ist somit relativ. Steigerungen der Interferondosis und/oder der Ribavirindosis können zu einer stärkeren Suppression der Virämie beitragen. Es ist wahrscheinlich, dass ein Nichtansprechen wesentlich durch individuell unzureichende Dosierungen sowie pharmakokinetische Effekte (variable Resorption der Medikation, individuell unzureichende Wirkspiegel) zurückzuführen ist (Abb. 1a+b).
CHANCEN BEI RE-THERAPIE
Bei jedem Patienten ohne anhaltende Response sollte individuell die Indikation zur Re-Therapie geprüft werden. Die Wahrscheinlichkeit einer erfolgreichen Re-Therapie ist von zahlreichen, inzwischen gut charakterisierten Faktoren abhängig.
Anhand dieser Charakteristika ist es möglich, geeignete Patienten für die Re-Therapie zu identifizieren. Gerade im Hinblick auf zukünftige Therapieoptionen mit direkt antiviralen Substanzen (z.B. Protease- und Polymerase-Inhibitoren) erscheint es nicht sinnvoll, Patienten mit sehr geringer Heilungschance oder solche mit einer sehr milden Erkrankung unselektiv wiederzubehandeln.
Fragen bei Versagen der Primärtherapie
- Welche Ersttherapie wurde durchgeführt?
- IFN?/ Peg-IFN- Monotherapie?
- IFN / Peg-IFN/ RBV-Kombinationstherapie? - Wurde die Ersttherapie korrekt durchgeführt?
- Therapiepause nach negativer PCR zu Woche 12?
- Genotyp- und Viruslast-gerechte Therapiedauer? - Compliance des Patienten?
- Alkoholkonsum?
- Therapieadhärenz? - Erfolgte eine Dosisreduktion?
- War diese wirklich notwendig oder kam es zu gravierenden Nebenwirkungen?
OPTIMIERUNG DER RE-THERAPIE
Im Rahmen der großen internationalen Studien EPIC und REPEAT wurde die Wirksamkeit einer Re-Therapie bei Patienten mit Therapieversagen untersucht. Die Studien unterscheiden sich deutlich hinsichtlich der Patientencharakteristika und der Therapieform. Es können jedoch gemeinsame Schlussfolgerungen aus diesen Daten gezogen werden. Im Folgenden werden die zwei Studien vorgestellt, die die Grundlage für die Zulassung von Peg-IFNα plus Ribavirin in der Re-Therapie bilden.
EPIC-STUDIE
Die EPIC-Studie untersucht primär die Effektivität der Langzeiterhaltungstherapie mit Peg-IFNα bei Patienten mit fortgeschrittener Fibrose, die auf eine Kombinationstherapie mit Standard-Interferon oder Peg-IFNα plus Ribavirin nicht dauerhaft angesprochen haben. Alle Patienten erhielten jedoch initial eine körpergewichtsadaptierte Re-Therapie mit Peg-IFNα-2b plus Ribavirin. Responder zur Woche 12 wurden über 48 Wochen behandelt und dann die Therapie beendet. Der primäre Endpunkt war das Erreichen einer SVR. Patienten ohne virologisches Ansprechen wurden im Rahmen der Langzeitstudie beobachtet.
Insgesamt wurden 2.312 Patienten in die Studie eingeschlossen. Die Charakteristika der Patienten sind in der Tabelle 1 (S. 9) dargestellt. Die Mehrzahl der Patienten hatte eine Vortherapie mit Standardinterferon plus Ribavirin und 28% waren Relapser.
Die Abbildungen 2 bis 4 fassen die Ergebnisse der Studie zusammen. Die Chance eine SVR zu induzieren wird umso höher, je günstiger die Ausgangsfaktoren sind. Die SVR-Raten variieren daher erheblich von minimal 4% bei HCV Typ 1 und fortgeschrittener Fibrose und Nonresponse auf eine Peg-IFNα/Ribavirin-Therapie bis zu 76% SVR-Rate bei HCV Typ 2/3 und Relapse nach einer Standard-Interferon/Ribavirin-Therapie (siehe Tab. 2).
Ein wichtiges Ergebnis der Studie ist, dass die Response zu Woche 12 eine hohe Prädiktion für das dauerhafte Therapieansprechen besitzt. Unabhängig vom Genotyp und der Vortherapie haben Patienten mit einer kompletten virologischen Response (HCV-RNA <125 IU/ml mittels Real time PCR) eine Chance von ca. 40-60% eine SVR zu erreichen (Tab. 3). Die Studie belegt erneut, dass ein 2 log10 Abfall der Viruslast per se kein guter Prädiktor hinsichtlich des Erreichens einer SVR darstellt. Auch bei minimaler Virämie zur Woche 12 waren die SVR-Raten mit 0-23% gering.
REPEAT-STUDIE
Im Unterschied zur EPIC-Studie wurden in die REPEAT-Studie nur Patienten eingeschlossen, die auf eine Behandlung mit Peg-Interferon alfa-2b plus Ribavirin nicht angesprochen hatten (Nonresponder). Die Mehrzahl aller Patienten war mit HCV Typ 1 infiziert (Tab. 4, S. 13). Die Studie prüft den Effekt einer Re-Therapie mit Peg-IFNα-2a plus Ribavirin in einer Dosierung von entweder 180 µg vs. 360 µg einmal pro Woche für die ersten 12 Therapiewochen (gefolgt von der Standarddosis mit 180 µg) sowie die Bedeutung einer Verlängerung der Therapiedauer auf 72 Wochen. Das 4-armige Studiendesign ist in der Abbildung 5 (S. 12) dargestellt. Insgesamt wurden 950 Patienten in die Studie eingeschlossen. Der primäre Endpunkt war der Vergleich der SVR in Arm A vs. D (360 mg/180 µg über 72 Wochen vs. Standarddosis 180 µg für 48 Wochen).
In Abbildung 6 und 7 sind die virologischen Responseraten zusammengefasst. Die Induktionstherapie mit doppelter Peg-IFNα-2a Dosis führte bei signifikant mehr Patienten zum virologischen Ansprechen zu Woche 12, doch dieser günstige Effekt ließ sich nicht auf die SVR-Raten übertragen. Die Verlängerung der Therapiedauer führte jedoch zu einer signifikanten Steigerung der SVR-Raten (16% vs. 9%). In Analogie zu den Ergebnissen der EPIC-Studie, hatte auch in REPEAT die Response zu Woche 12 eine entscheidende prognostische Bedeutung für die Wahrscheinlichkeit, eine SVR zu erzielen (Abb. 8, S. 13). Interessanterweise profitierten ausschließlich virologische Responder zur Woche 12 von der Therapieverlängerung.
Anders als bei unvorbehandelten Patienten führt eine 48-wöchige Kombinationstherapie in einer Nonresponderpopulation mit komplettem virologischen Ansprechen zur Woche 12 nur zu relativ geringen SVR-Raten (35% vorbehandelte vs. 68% unvorbehandelte Patienten). Das könnte dafür sprechen, dass die Mehrzahl dieser Patienten mit Woche 12 Response (definiert als HCV-RNA <50 IU/ml) noch weiterhin eine minimale Restvirämie aufweisen, die mit Standard HCV-RNA Test nicht zu detektieren ist.
FIBROSEPROGRESSIONS-
HEMMUNG DURCH INTERFERON- LANGZEITTHERAPIE?
Für Nonresponder mit fortgeschrittener Fibrose, die auch auf eine optimierte Re-Therapie mit Peg-IFNα plus Ribavirin kein Ansprechen zeigen, bestand die Hoffnung durch eine niedrig-dosierte Peg-IFNα-Erhaltungstherapie die Progression der chronischen Hepatitis C günstig zu beeinflussen. Frühere unkontrollierte Studien legten nahe, dass auch Nonresponder mit Zirrhose von der Interferon-Langzeitbehandlung profitieren und zwar insbesondere durch eine Reduktion der Häufigkeit des hepatozellulären Karzinoms (HCC). Die Ergebnisse von zwei kontrollierten Studien zu dieser Fragestellung liegen jetzt vor (HALT-C und COPILOT- Studie). Ziel beider Studien war es, die klinischen Endpunkte (Tod, hepatozelluläres Karzinom, Fibroseprogression, Ösophagusvarizenblutung, klinische Dekompensation einer Leberzirrhose, Lebertransplantation) mit einer niedrig dosierten Peg-Interferon alfa-2a/2b Monotherapie zu reduzieren.
Die Ergebnisse sind in den Abbildungen 9a+b und 10a+b dargestellt und belegen, dass in dieser Hinsicht kein Vorteil gegenüber der unbehandelten Kontrollgruppe zu erreichen ist (Afdhal et al., 2008; Di Bisceglie et al., 2007).
Ob bestimmte Subgruppen (z.B. Patienten mit portaler Hypertension) von der niedrig-dosierten PEG-IFNα Erhaltungstherapie profitieren, muss anhand der Ergebnisse weiterer Studien (z.B. EPIC3) abgewartet werden (Di Bisceglie et al., 2007; Afdhal et al., 2008).
Interessant sind Subgruppenanalyse der HALT-C Studie die dafür sprechen, dass eine effektive initiale Reduktion der Viruslast langfristig einen gewissen günstigen Effekt hinsichtlich der Reduktion der oben genannten klinischen Endpunkte aufweist und zwar unabhängig davon, ob der Patient eine Peg-IFNα-Erhaltungstherapie bekommen hat oder nicht.
FAZIT
Bei allen Patienten mit Therapieversagen sollte individuell die Option der Re-Therapie erwogen werden. Insbesondere bei Patienten, die keine adäquate Vortherapie erhalten hatten, Patienten mit HCV-Genotyp 2 oder 3, Patienten mit Relapse oder einer bereits fortgeschrittenen Fibrose, ist die Indikation zur Re-Therapie großzügig zu stellen. Eine Verlängerung der Therapiedauer auf 48 Wochen bei Typ 2/3- bzw. 72 Wochen bei Typ 1 (4-6) erscheint sinnvoll und wird empfohlen. Die Frage der optimalen Peg-IFNα und Ribavirindosis für die Re-Therapie kann zurzeit nicht sicher beantwortet werden. Zahlreiche Studien belegen jedoch, dass sowohl eine Steigerung der Peg-IFNα-Dosis als auch der Ribavirindosis die initialen virologischen Responseraten steigern. Dieser Effekt kann im Einzelfall genutzt werden. Für eine Erhaltungstherapie mit niedrig-dosiertem Peg-IFNα bei Patienten mit fortgeschrittener Fibrose und Nonresponse auf die Standardtherapie gibt es derzeit keine Indikation.





