PD DR. JÖRG PETERSEN, HAMBURG
Hepatitis B-Heilung: Immunologische Kontrolle oder Eradikation?
Eine Schlüsselrolle bei den Überlegungen zur Elimination des Hepatitis B Virus spielt der hepatozelluläre Zelltod. Die Elimination HBV-infizierter Hepatozyten erscheint notwendig nicht allein um die Anzahl der infizierten Leberzellen zu reduzieren, sondern auch um die Proliferation benachbarter Hepatozyten zu fördern, die dann durch Zellteilung ihre cccDNA verlieren bzw. vermindern können.
Für die Therapie der chronischen Hepatitis B sind aktuell in Deutschland fünf Substanzen zugelassen: Interferon-alpha, pegyliertes Interferon alpha 2a, Lamivudin, Adefovir und Entecavir. Die subkutan verabreichten Interferone können bei etwa einem Drittel der behandelten Patienten zu einer langfristigen Viruskontrolle ohne echte Viruseradikation führen. Sie sind jedoch im Vergleich zu den oralen Nukleos(t)idanaloga (NA) nebenwirkungsreicher. NA unterdrücken die Virusreplikation zunächst effektiv und führen zu histologischer Verbesserung. Ungelöste Probleme stellen jedoch die hohe Rate an Rückfällen (Relapse) nach Absetzen der antiviralen Therapie und die Entwicklung von resistenten Virusvarianten dar. Die Wirksamkeit aller verfügbaren Therapieoptionen wird von viralen und klinischen Parametern beeinflusst, die bei der zukünftigen Auswahl der antiviralen Therapeutika individuell stärker berücksichtigt werden sollten. Ein zentraler Aspekt in der zukünftigen Ausrichtung von Studien ist die Frage, ob eine virale Eradikation in der Zukunft möglich sein wird und nötig sein wird.
HEILUNG BEI CHRONISCHER HEPATITIS C
Bei der Therapie der chronischen Hepatitis C hat sich in den letzten Jahren nachdrücklich gezeigt, dass die sogenannte „SVR“ (sustained viral response), also die Abwesenheit von HCV-RNA sechs Monate nach Beendigung einer antiviralen Therapie mit pegyliertem Interferon alpha und Ribavirin, in über 95% einer langfristigen Heilung der Patienten von der chronischen Hepatitis C entspricht. Hepatitis C Viren replizieren allerdings im Unterschied zu Hepatitis B Viren auch nur im Zytoplasma infizierter Hepatozyten. Allerdings gibt es nach überstandener Infektion mit Hepatitis C keinen Schutz vor Reinfektion, da es nicht zur Ausbildung neutralisierender Antikörper gegen das Hepatitis C Virus kommt.
ROLLE DER cccDNA
Für die Hepatitis B Virusinfektion gilt bislang, dass der komplexe Replikationszyklus des DNA-Virus mit Bildung einer hocheffizienten Matrize im Zellkern infizierter Hepatozyten (die sogenannte covalently closed circular DNA oder cccDNA) und die effiziente Reinfektionsmöglichkeit von virusfreien Hepatozyten (intrahepatischer „viral spread“) verantwortlich sind für eine langjährige Persistenz funktionsfähiger Virusformen in der Leber. Weiterhin besitzen Hepatozyten eine lange Halbwertzeit und teilen sich nur unwesentlich. Antivirale Therapien chronisch HBV-infizierter Individuen stehen also vor dem Problem der Eliminierung nicht nur replikativer Formen viraler DNA im Zytoplasma infizierter Hepatozyten, sondern auch der cccDNA im Nukleus. Da cccDNA sich jedoch üblicherweise nicht semikonservativ repliziert, ist es bislang kein direktes Ziel antiviraler Therapie und bereits gebildete cccDNA im Nukleus wird nicht direkt attackiert. Weiterhin ist die Halbwertzeit, intrinsische Stabilität, und Regulation von HBV und anderer Säuger - cccDNA nur rudimentär bekannt. Selbst nach immunologischer Kontrolle der Erkrankung mit Ausbildung von AntiHBe-Antikörpern oder sogar nach Bildung von neutralisierenden AntiHBs-Antikörpern, die in der Regel vor einer Neuinfektion schützen, kommt es nicht zur Eradikation von HBV.
OKKULTE HEPATITIS B
Der Verlust des HBs Antigens unter antiviraler Therapie bedeutet in der Regel eine klinische Ausheilung der HBV-Erkrankung, die in etwa 1% der Fälle pro Jahr auch spontan erfolgen kann. Die Persistenz von HBV Genomen in HBsAg-negativen Individuen wird hingegen okkulte HBV Infektion genannt1. Ein okkulter HBV-Status ist in einigen Fällen mit dem Vorhandensein mutierter HBV Virione assoziiert, die mit den üblichen HBsAg Assays nicht detektiert werden können, in der Mehrheit der Fälle aber mit einer starken Suppression der viralen Replikation und Genexpression verbunden. Die verfügbaren Daten zur Prävalenz einer okkulten Infektion sind zum Teil sehr widersprüchlich, vermutlich aufgrund sehr unterschiedlicher Sensitivität und Spezifität der verwendeten Methoden in den verschiedenen Detektionsstudien. Eine okkulte HBV Infektion kann in mehrerer Hinsicht Einfluss auf die Erkrankung nehmen, einschließlich der Übertragung der HBV Infektion durch Bluttransfusionen und Organtransplantation und durch die Reaktivierung einer chronischen HBV Infektion mit Reserokonversion zu erneutem HBs-Antigennachweis unter Immunsuppression. Weiterhin mehren sich die Evidenzen in den letzten Jahren, dass eine okkulte Infektion mit der Progression einer Leberfibrose und der Entwicklung von Hepatozellulären Karzinomen assoziiert ist2. Die okkulte HBV Infektion ist als Phänomen vor allem assoziiert mit der intrahepatischen Persistenz von HBV cccDNA und einer starken Suppression der viralen Replikation und Genexpression.
REPLIKATIONSZYKLUS
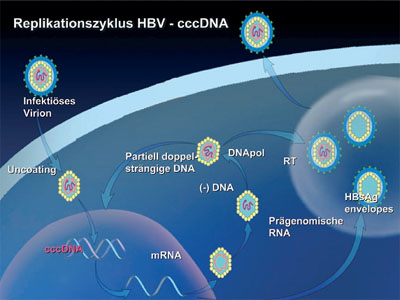
Abb. 1: Replikationszyklus Hepatitis B – cccDNA
Der Replikationszyklus des Hepatitis B Virus (Abb. 1) beginnt mit der Aufnahme des Virus in die Hepatozyten, wobei der oder die beteiligten zellulären Rezeptoren bislang nicht eindeutig identifiziert werden konnten. Weiterhin ist nur wenig bekannt, wie das virale Genom aus seiner Virushülle freigesetzt wird und in den Zellkern gelangt. Im Zellkern angelangt, wird das partiell doppelsträngige virale Genom zu einem vollständig geschlossenen zirkulären Strang DNA-Strang (covalently closed circular DNA, kurz cccDNA) vervollständigt. Die cccDNA wird anschließend mit Histon- und Nichthistonproteinen zu einem HBV-Minichromosom im Kern der Hepatozyten verpackt und dient dort, nicht integriert, als Vorlage oder Matrize für die Transkription der prägenomischen RNA und HBV-messenger RNAs. Die sich anschließenden Replikationsschritte des HBV Virus erfolgen im Zytoplasma nach einem durch die virale Reverse Transkriptase katalysierten Zwischenschritt, weshalb HBV funktionell auch eher einem Pararetrovirus gleichzusetzen ist. Das HBV RNA Prägenom wird zusammen mit der viruseigenen Polymerase in das HBV Kapsid verpackt. Die Reifung des Virus erfolgt dann am Endoplasmatischen Retikulum, in das die Oberflächenproteine eingelagert werden, ehe das infektiöse Virion über das Endoplasmatische Retikulum, den Golgi-Apparat und die Plasmamembran ausgeschleust wird. Die besondere Rolle der cccDNA wird zudem durch einen funktionsfähigen Recyclingmechanismus unter-strichen, in dem ein Teil neusynthetisierter HBV DNA in den Zellkern zurücktransportiert wird und dort in zusätzliche cccDNA konvertiert wird und somit eine stabile cccDNA Kopienanzahl von 1-50 pro Zelle erreicht wird. Die Akkumulation von cccDNA wird hierbei durch virale Hüllproteine reguliert. Weiterhin korreliert die Menge gebildeter cccDNA im Zellkern mit dem Ausmaß viraler Genexpression und Replikation. Da cccDNA die Matrize der Infektion darstellt, ist sie für die Persistenz der HBV Infektion verantwortlich und muss eliminiert werden, wenn eine tatsächliche virale Clearance das Ziel der antiviralen Therapie darstellt.
TIERMODELLE UND KLINISCHE STUDIEN ZUR HBV cccDNA
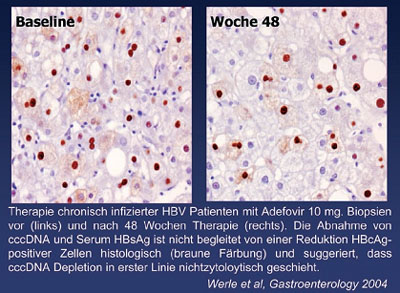
Abb. 2: HBV Clearance von Hepatozyten erscheint in erster Linie nicht-zytolytisch
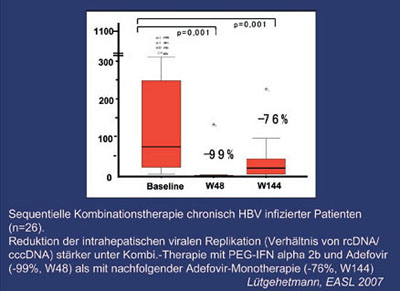
Abb. 3: Intrahepatische virale Produktivität während antiviraler Therapie –
Verhältnis rcDNA/cccDNA
Studien mit dem mit HBV eng verwandten Woodchuck Hepatitis B Virus (WHV, amerikanisches Murmeltier) haben gezeigt, dass der Pool von cccDNA trotz antiviraler Therapie mit Nukleosidanaloga und starker viraler Suppression im Serum persistieren kann3,4. Eine signifikante Reduktion des cccDNA Pools konnte erst nach langfristiger antiviraler Therapie in Woodchucks und bei chronisch infizierten Patienten in kürzlich publizierten klinischen Studien erzielt werden5,6,7. NA stellen Polymeraseinhibitoren dar und besitzen keinen direkten Effekt auf die cccDNA Formation, daher ist die Abnahme von cccDNA Spiegeln unter langfristiger antiviraler Therapie in erster Linie durch die Inhibierung viraler DNA Synthese im Zytoplasma infizierter Hepatozyten mit konsekutivem insuffizienten Recyclingmechanismus viraler Nukleokapside in den Zellkern zu erklären5 (Abb. 2). Dieser Prozess ist langwierig, bedingt durch die vermutlich lange Halbwertzeit von cccDNA und durch die geringe Teilungsaktivität von Hepatozyten, und er lässt eine generelle Reduktion von cccDNA Kopien pro Zell erwarten. Immunmodulatorische HBV-Therapien mit pegyliertem Interferon alpha führen zur Abräumung infizierter Hepatozyten. Die Kombination von pegyliertem Interferon alpha 2b und Adefovir führte in einer Pilotstudie zu einer stärkeren Reduktion von cccDNA als die alleinige Therapie mit Adefovir. Unter Kombinationstherapie war die Suppression der intrahepatischen Replikation auch stärker als unter der sich anschließenden Monotherapie mit Adefovir (Abb. 3). Interessanterweise haben Experimente mit HBV-replizierenden transgenen Mäusen und Schimpansen eindeutig zeigen können, dass inflammatorische Zytokine die virale Replikation durch nichtzytolytische immunvermittelte Prozesse supprimieren können8,9,10. Auf der anderen Seite belegen histologische Untersuchungen eindeutig Leberzelltod und Regeneration in transient und chronisch HBV-infizierten Lebern und suggerieren, dass eine Eradikation von HBV die Destruktion eines bislang unbekannten Anteils infizierter Hepatozyten durch die Immunabwehr voraussetzt. Eine bereits langjährige Diskussion beschäftigt sich gerade mit dieser Frage, wie viel Destruktion von Hepatozyten während der Resolution einer HBV Infektion wirklich geschieht. Eine solche Information könnte das Verständnis vertiefen, ob die Elimination infizierter Hepatozyten wirklich notwendig ist, um das Virus aus der Leber nachhaltig zu eradizieren. Die Elimination infizierter Zellen in der Leber setzt eine anschließende Substitution und Akkumulation von nicht-infizierten Hepatozyten voraus (Abb. 2). Der Ursprung dieser neuen Hepatozyten ist bislang unbekannt und daher umstritten. Es hat in den letzten Jahren Vermutungen gegeben, dass nicht-infizierte Hepatozyten nach Differenzierung aus Progenitorzellen entstehen können11 oder alternativ von vormals infizierten Hepatozyten herrühren, die ihre cccDNA verloren haben12.
CLEARANCE VON cccDNA
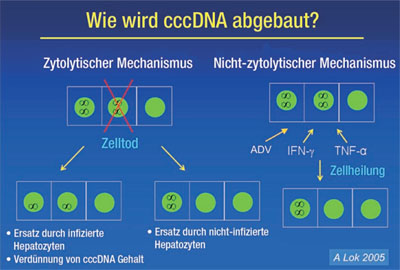
Abb. 4: Mögliche Clearance-Mechanismen von cccDNA cccDNA kann vermutlich
nicht-zytolytisch und zytolytisch reduziert werden
Die Arbeitsgruppen von Mason und Summers haben in den letzten Jahren in einer Reihe von eleganten Experimenten zeigen können, dass HBV DNA Integrationen in das Wirtsgenom als genetische Marker genutzt werden können, um das Schicksal infizierter Hepatozyten und den Zell-Turnover während chronischer Infektionen verfolgen zu können. HBV DNA Integrationen in zelluläre DNA stellen keine Voraussetzung für die virale Replikation dar. Der Integrationsprozess kann daher als alternativer Weg für virale Genome angesehen werden, die, anstatt in cccDNA Moleküle transformiert zu werden, in nichtfunktionale Integrationen umgeleitet werden. Mason und Mitarbeiter konnten nun zeigen, dass uninfizierte Zellen klonal aus vormals infizierten Hepatozyten hervorgehen können, und damit demonstrieren, dass Clearance von cccDNA tatsächlich ohne eine Destruktion infizierter Zellen geschehen kann13 (Abb. 4). Zellteilung kann weiterhin eine Dilution von cccDNA unter antiviraler Therapie begünstigen und cccDNA freie Hepatozyten exprimieren keine viralen Antigene, und könnten, nicht weiter Ziel der Immunabwehr, rascher expandieren als Zellkolone, die virale Proteine sezernieren. Interessanterweise haben Studien zeigen können, dass geringe Mengen von cccDNA unbegrenzt in wenigen Leberzellen persistieren kann und möglicherweise eine lebenslange Immunantwort gegen HBV trotz klinischer Resolution der Erkrankung aufrecht erhalten kann14. Die Bestimmung von cccDNA ist nur aus Leberbiopsiematerial möglich und somit für die tägliche Praxis nicht praktikabel. Zudem korreliert die Höhe der Serum HBV DNA nicht mit der Menge der intrahepatischen cccDNA. Viele Arbeitsgruppen suchen daher nach nichtinvasiven Surrogatparametern, um die intrahepatische replikative Aktivität, die über die Persistenz der viralen Replikation entscheidet, besser beurteilen zu können. Ein interessanter Parameter ist hier die Quantifizierung von HBsAg, allerdings bleibt abzuwarten, ob die Quantifizierung von HBsAg in der Zukunft sich als genügend robuste Methode zur nichtinvasiven Charakterisierung der intrahepatischen Replikation eignet7.
PD Dr. med. Jörg Petersen
Leitender OA · I. Medizinische Klinik Gastroenterologie, Hepatologie, Infektiologie
Universitätsklinikum Hamburg-Eppendorf
Martinistr. 52 20246 Hamburg
Email: joepeter@uke.uni-hamburg.de
FAZIT FÜR DIE PRAXIS
Es ist zu erwarten, dass sich durch neue Therapieregime, besser definierte therapeutische Endpunkte und längere Therapiezeiten, sowie durch neue Nukleos(t)idanaloga wie Telbivudin und Tenofovir weitere Fortschritte in der Hepatitis B-Therapie erzielen lassen. Die klinische Heilung der Hepatitis B ist mit einer immunologischen Kontrolle der Erkrankung eng vergesellschaftet und neben neuen Nukleos(t)idanaloga wird zukünftig vor allem eine bessere Kenntnis der Aktivierungsmechanismen virusassoziierter Immunantworten zu erfolgreicheren Therapien führen. Erst dann wird sich zeigen, ob die virale Eradikation in Zukunft möglich sein wird oder nötig sein wird.
Literatur
1. Raimondo G, et al. Occult hepatitis B virus infection. J Hepatol 2007;46:160-70 (Review).
2. Pollicino T, et al. Molecular and functional analysis of occult hepatitis B virus isolates from patients with hepatocellular carcinoma. Hepatology 2007;45:277-85.
3. Moraleda G, et al. Lack of effect of antiviral therapy in nondividing hepatocyte cultures on the cccDNA of woodchuck hepatitis virus. J Virology 1997;71;9392-99.
4. Dandri M, et al. Increased hepatocyte turnover and inhibition of woodchuck hepatitis B virus replication by Adefovir in vitro do not lead to reduction of the closed circular DNA. Hepatology 2000;32:139-46.
5. Werle B, et al. New Insights of cccDNA persistence during the natural history of Chronic Hepatitis B and Adefovir Dipivoxil Therapy. Gastroenterology 2004;126:1750-58
6. Wursthorn K, et al. Peginterferon alfa-2b plus Adefovir induce strong cccDNA decline and HBsAg reduction in chronic Hepatitis B patients. Hepatology 2006;44:675-84
7. Lütgehetman M, et al. Substantial loss of intrahepatic HBV cccDNA during antiviral combination therapy translates into long-term clinical benefit. EASL 2007 Barcelona, J Hepatol 2007;46: Suppl.1:S28, Abstract # 59.
8. Guidotti LG, et al. Noncytolytic control of viral infections by the innate and adaptive immune response. Annu Rev Immunol 2001;19:65-91
9. Guidotti LG, et al. Viral clearance without destruction of infected cells during acute HBV infection. Science 1999;284:825-29.
10. Wieland SF, et al. Expansion and contraction of the Hepatitis B Virus transcriptional template in infected chimpanzees. Proc Natl Acad Sci USA 2004;101:2129-34.
11. Thorgeirsson SS. Hepatic stem cells in liver regeneration. FASEB J 1996;10:1249-56.
12. Citivico GM, et al. The half life of duck hepatitis B virus supercoiled DNA in congenitally infected primary hepatocytes cultures. Virology 1994;203:81-89.
13. Mason WS, et al. Clonal expansion of hepatocytes during chronic woodchuck hepatitis virus infection. Proc Natl Acad Sci USA 2005;102:1139-44.
14. Rehermann B, et al. The hepatitis B virus persists for decades after patients recovery from acute viral hepatitis despite active maintenance of a cytotoxic T-lymphocyte response. Nat Med 1996;2:1104-08.





