Sofosbuvir/Ledipasvir nach Sofosbuvir/Ribavirin-Versagen
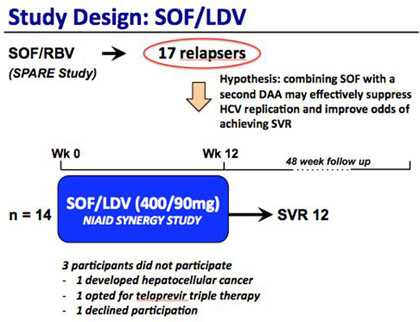
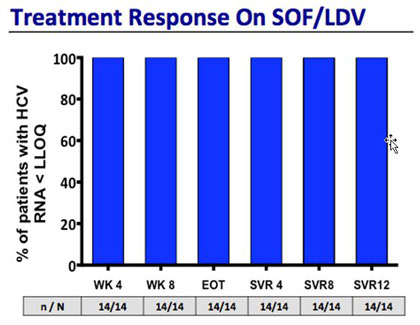
In der NIAID SPARE-Studie hatten 17 der 55 Patienten mit GT1 nach 24 Wochen Sofosbuvir/Ribavirin einen Relaps. 14 Dieser Patienten wurden jetzt in der SYNERGY-Studie 12 Wochen lang mit der Fixkombination Sofosbuvir/Ledipasvir (NS5B-/NS5A-Inhibitor, 400mg/90mg) behandelt.
57% hatten GT1a und die Hälfte eine fortgeschrittene Fibrose bzw. Zirrhose. Alle Patienten erreichten die SVR12, einschließlich eines Patienten, bei dem nach dem Relaps die Sofosbuvir-assoziierte Mutation S282T nachgewiesen wurde.
Relaps bei GT 2/3
In einer weiteren offenen Untersuchung wurde Patienten mit GT2 oder 3, die nach 12 Wichen Sofosbuvir/Ribavirin einen Relaps erlitten hatten, 12 Wochen Sofosbuvir plus peg-Interferon/Ribavirin oder 24 Wochen Sofosbuvir/Ribavirin angebotet.
107 Patienten nahmen teil. 93% hatten GT3 und 35% eine Zirrhose.
Vorgestellt wurden die Daten von 26 Patienten nach 24 Wochen oraler Therapie sowie von 40 Patienten nach Tripletherapie.
Alle
waren zu Woche 4 negativ. Die SVR12 erreichten 92% der Patienten nach
Tripletherapie und zwar 88% und 93% mit Zirrhose. Durch 24 Wochen
Sofosbvur/Ribavirin wurden dagegen nur 69% der Patienten geheilt, wobei
Patienten mit Zirrhose mit einer SVR12 von 47% besonders schlecht abschnitten.