Holger Hinrichsen, Kiel
Switch von Telaprevir auf Boceprevir
Lange Infektionsdauer
Wir berichten aktuell über einen Fall, bei dem ein Wechsel von Telaprevir auf Boceprevir aufgrund von Nebenwirkungen notwendig war. Bei der 43jährigen bisher unbehandelten normgewichtigen Patientin (68 kg bei 170cm) mit neu entdeckter Hepatitis C-Virusinfektion vom Genotyp 1b leiteten wir im Dezember 2011 eine antivirale Therapie ein. Es lag eine mehr als 20jährige Infektionsdauer bei Posttransfusionshepatitis nach Gabe von 2 Erythrozytenkonzentraten und Frischplasma nach einem gynäkologischen Eingriff 1987 vor. Die Posttransfusionshepatitis war bekannt (Non A-Non-B-Hepatitis), doch die Infektion geriet im Lauf der Zeit in Vergessenheit und wurde erst im Rahmen einer betriebsärztlichen Untersuchung vor einem geplanten 3monatigen Auslandsaufenthalt wieder „entdeckt“. Die Viruslast lag initial bei 2.250.000 IU/ml, der IL28b-Genotyp war CT und das Leberfibrosestadium wurde mit I-II (Fibroscan 8,3 KPa) bestimmt. Die Transaminasen waren passend zur chronischen Hepatitis C erhöht: GPT (ALT) 58 U/ml (Norm < 45) und GOT (AST) 49IU/ml (Norm > 40). Alle weiteren Routinelaborparameter waren unauffällig. Eine gut eingestellte arterielle Hypertonie wurde mit einem ACE-Hemmer (Ramipril 2,5mg/d) behandelt.
Nach Vorliegen aller Untersuchungsergebnisse veranlaßten wir zunächst eine Hepatitis A- und B-Immunsierung bei fehlendem Impfschutz aufgrund der STIKO-Empfehlungen für Patienten mit einer chronischen Lebererkrankung, aber auch wegen des geplanten beruflichen Auslandsaufenthaltes in Afrika. Bedenken gegen den geplanten Auslandsaufenthalt bei kompensierter Lebererkrankung bestanden nicht, so dass wir mit der Patientin, die einen starken Therapiewunsch hatte, eine antivirale Therapie nach der Rückkehr aus Afrika vereinbarten. Hierzu stellte sich die Patientin im Dezember 2011 wieder vor.
Nach Aufklärung über die beiden Therapieregime und deren Vor- und Nachteile entschied sich die Patientin für eine Telaprevir-basierte Tripletherapie. Bei gleichen Heilungschancen sah die Patientin einen Vorteil in der höheren Chance einer verkürzten Therapiedauer unter Telaprevir-basierter Triple-Therapie versus der Boceprevir-basierten Triple-Therapie. Befürchtungen im Hinblick auf mögliche Nebenwirkungen hatte die Patientin nicht.
Unerträglicher Juckreiz
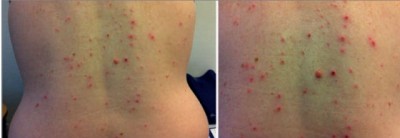 Abbildung 1 und 2: Stark juckender Hautausschlag am Rücken bei einer 53-jährigen Patientin unter Telaprvirbasierter Triple-Therapie nach 3 Wochen Therapiedauer.
Abbildung 1 und 2: Stark juckender Hautausschlag am Rücken bei einer 53-jährigen Patientin unter Telaprvirbasierter Triple-Therapie nach 3 Wochen Therapiedauer.
Wir leiteten daher im Dezember 2011 die Behandlung mit Telaprevir 3*750mg/d, PEG-Interferon alfa-2a 180 µg/Woche und Ribavirin 1000 mg/d ein. Noch vor Therapiebeginn wiesen wir die Patientin darauf hin, die Haut regelmäßig mit rückfettenden Substanzen zu pflegen und starke Sonnenexposition (Solarium, Urlaub in südlichen Ländern usw.) zu meiden. Zwei Wochen nach Therapiestart berichtete die Patientin über zunehmenden Juckreiz zunächst ohne sichtbare Hautveränderungen, der zu ausgeprägten Schlafstörungen führte. Ein Therapieversuch mit einem sedierenden Antihistaminikum (Cetirizin) wurde nach einer Woche wegen Erfolglosigkeit von der Patientin abgebrochen. Ab Ende der dritten Therapiewoche entwickelte die Patientin am gesamten Stamm stark juckende Hautveränderungen, die im Verlauf zum Teil ulcerierten (Abb. 1 und 2). Ein Behandlungsversuch mit Betamethason-Creme besserte zwar den Hautausschlag deutlich, hatte aber keinen Einfluß auf den Juckreiz. Auf einer Skala von 0-10 (keine Beschwerden bis unerträglich) wies die Patientin sich den Wert 9 zu. Nach vier Wochen Therapie stellte sich die Patientin erneut vor und war entschlossen die komplette Therapie wegen des für sie unerträglichen Pruritus zu beenden, da sie auch ihre Arbeitsfähigkeit durch das Schlafdefizit gefährdet sah. Sie hatte in einem Selbstversuch in der vierten Therapiewoche für einen Tag die Therapie mit Telaprevir ausgesetzt und das Gefühl gehabt darunter sei eine leichte Besserung eingetreten.
Switch auf Boceprevir
Aufgrund des bekannten Nebenwirkungsspektrums haben wir Telaprevir für die von der Patientin berichteten Nebenwirkungen (Pruritus mit konsekutivem Schlafmangel und die Hautveränderungen) verantwortlich gesehen. Allerdings können diese Nebenwirkungen auch unter dualer Therapie mit PEG-Interferon und Ribavirin auftreten. Da eine Fortführung der Tripletherapie mit Telaprevir aufgrund der Nebenwirkungen von der Patientin abgelehnt wurde, haben wir uns in diesem Einzelfall zu einem direkten Wechsel von Telaprevir auf Boceprevir entschieden.
Praktisch haben wir zunächst eine Viruslastbestimmung zu diesem Zeitpunkt veranlaßt und bis zum Erhalt des Ergebnisses eine Packungsgröße von einer Woche Boceprevir mit der Maßgabe 3*800mg/d einzunehmen, verordnet. Die HCV-RNA war negativ und der Juckreiz klang bereits zwei Tage nach Absetzen von Telaprevir langsam ab. Nach einer Woche Boceprevir basierter Tripletherapie war der Juckreiz nahezu abgeklungen und die Patientin war wieder hochmotiviert die Therapie bis zum Ende durchzuhalten.
Neuer Algorithmus
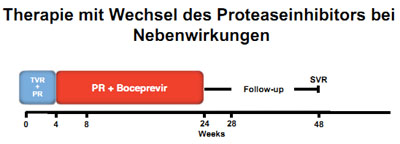 Abbildung 3: Therapieschema der Patientin bei Switch von Telaprevir auf Boceprevir zu Woche 4 wegen nicht beherrschbarem Juckreiz.
Abbildung 3: Therapieschema der Patientin bei Switch von Telaprevir auf Boceprevir zu Woche 4 wegen nicht beherrschbarem Juckreiz.
Aufgrund der unterschiedlichen Therapieschemata stellten sich uns jetzt die Fragen: Wie lang sollte die Gesamttherapiedauer sein? Wie lang muß Boceprevir gegeben werden? Da zu diesen beiden Fragen keine wissenschaftlich geprüften Antworten vorlagen, entschlossen wir uns der Patientin aufgrund des raschen virologischen Ansprechens (RVR zu Woche 4 der Tripletherapie mit Telaprevir), zu einer 24-wöchigen Gesamttherapiedauer zu raten, sofern zwei weitere HCV-RNA-Messungen zu Woche 8 und 12 Wochen (4 und 8 Wochen nach Beginn Boceprevir) ebenfalls negativ ausfallen sollten. Dies war im weiteren Verlauf der Fall, so dass Boceprevir für die gesamte restliche Therapiedauer von 20 Wochen verordnet wurde und damit 4 Wochen kürzer als in der Standardtherapie vorgesehen (24 Wochen Triple-Therapie nach 4 Wochen lead-in mit PEG-Interferon und Ribavirin) gegeben wurde (Abb. 3). Die Patientin hatte vier Wochen Telaprevir eingenommen, was uns zu der Annahme führte, dass 24 Wochen Therapiedauer mit einem Proteaseinhibitor gerade bei dem raschen virologischen Ansprechen ausreichend sind.
Die Behandlung der Patientin konnte ohne wesentliche weitere Komplikationen bis Anfang Juni 2012 durchgeführt werden. Ende September wies die Patientin bei einer weiteren Kontrolle eine negative HCV-RNA auf, so dass eine SVR 12 gegeben ist. Eine abschließende Untersuchung 24 Wochen nach Therapieende steht noch aus.
Fazit
Zusammenfassend kann es in Einzelfällen in einer frühen Therapiephase (innerhalb der ersten acht Wochen) gerechtfertigt sein, bei nicht beherrschbaren Nebenwirkungen den Proteseinhibitor zu wechseln. Allerdings liegen keine hinreichenden Erfahrungen vor, für welchen Zeitraum dann die geänderte Therapie fortgeführt werden muss. Voraussetzung für den Wechsel ist in jedem Fall die engmaschige Beobachtung der Nebenwirklungen und eine Kontrolle des virologischen Ansprechens, das eine Fortsetzung der antiviralen Therapie rechtfertigt.





