Andrej Potthoff und Kinan Rifai, Hannover
Update – nicht-invasive
Fibrose-Bestimmung
Nicht-invasive Fibrose-Messverfahren zeigen in kontrollierten Untersuchungen exzellente Ergebnisse bei der Detektion von fortgeschrittener Leberfibrose und Zirrhose. Die Diskrimination niedriger Fibrosegrade ist allerdings immer noch unzureichend, wobei hier auch die histologische Beurteilungunzuverlässig ist. Die Elastografieverfahren (TE, ARFI) eignen sich bereits jetzt gut zum Screening und zur Verlaufsbeurteilung von chronischen Lebererkrankungen, möglicherweise auch zur Risikoabschätzung der Krankheitsprogression. Trotz hoher Investitionskosten ist die Leber-Elastografie inzwischen in der Hepatologie weit verbreitet.
Die Morbidität und Mortalität von chronischen Lebererkrankungen hängen im Wesentlichen von dem Vorhandensein und dem Ausmaß der Leberfibrose ab. Die Leberbiopsie gilt immer noch als Goldstandard zur Klärung der Ätiologie, zur Quantifizierung der hepatischen Inflammation und zur Einschätzung des Stadiums der Lebererkrankung. Weiterhin wird sie häufig noch zur Verlaufsbeurteilung bei chronischer Lebererkrankung herangezogen. Die Leberbiopsie birgt allerdings Risiken und hat Limitationen. Zu den Komplikationen zählen postinterventionelle Schmerzen, klinisch relevante Blutungen (ca. 0,5 %)1, Pneumothorax oder eine biliäre Peritonitis. Limitationen sind intra- oder interindividuelle Varianzen der beurteilenden Pathologen, die begrenzte Repräsentativität der Biopsie [„Sampling error“] sowie die Heterogenität des Lebergewebes. Aus all diesen Gründen ist die Etablierung neuer nicht-invasiver Tests zur Beurteilung der Leberfibrose sinnvoll.
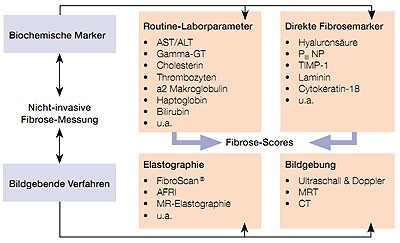
Abbildung 1: Übersicht über nicht-invasive Verfahren zur Fibrosemessung
Nicht-invasive Fibrosemessungen sollten komplikationsarm, reproduzierbar durchführbar und ökonomisch vertretbar sein sowie der Leberbiopsie im Hinblick auf die diagnostische Treffsicherheit nicht nachstehen. In den letzten Jahren wurden eine Reihe nicht-invasiver Testverfahren entwickelt, einerseits biochemische Marker und andererseits bildgebende Verfahren (Elastographie, Sonographie, CT und MRT) (Abb. 1). Ein Großteil der zur Verfügung stehenden nicht-invasiven Methoden haben eine Sensitivität und Spezifität von über 80 % bei der Diskriminierung einer fortgeschrittenen Fibrose/Zirrhose gegenüber einer milden Fibrose. Die Kombination einzelner Tests miteinander erhöht meist die diagnostische Treffsicherheit.
Biochemische Marker
Hinweise auf einen fibrotischen Umbau der Leber lassen sich
bereits aus den Routinelaborparametern gewinnen. Mit zunehmender Fibrose sinkt
die hepatische GPT-Expression, sodass sich der GPT/GOT-Quotient
(DeRitis-Quotient) zu Gunsten der GOT verschiebt. Vorwiegend im Rahmen
entzündlicher Lebererkrankungen (AIH, HCV, HBV) ist dies ein Hinweis auf einen
fortgeschrittenen Leberumbau. Als weitere, nicht leberspezifische Parameter
verändern sich auch die Thrombozytenzahl (Thrombopenie) und die
γ-Globulin-Fraktion in der Serumelektrophorese (Hypergammaglobulinämie).
Gemeinsam ist diesen Parametern, dass sie sich erst im Rahmen eines weit
fortgeschrittenen fibrotischen Geschehens verändern und somit frühe
Fibrosestadien nicht adäquat detektieren. Zudem fehlen die genannten
Veränderungen bei einem substanziellen Anteil der Patienten mit Leberzirrhose,
sodass bei normalen Laborwerten ein signifikanter Leberschaden nicht sicher
ausgeschlossen werden kann. Alternativ bieten sich Parameter der metabolischen
und Entgiftungsfunktion der Leber sowie der hepatischen Synthesefunktion an
(zum Beispiel Bilirubin, Ammoniak, Albumin, Cholinesterase,
Gerinnungsparameter). Hier finden sich signifikante Veränderungen aber erst in
noch weiter fortgeschrittenen Stadien als bei den obigen Parametern. Somit sind
die Standard-
laborparameter wegen mangelnder Sensitivität und Spezifität nicht als adäquater
Ersatz der Leberbiopsie geeignet. Allenfalls bei einem kleinen Teil der
Patienten dienen sie dazu, eine fortschrittene Fibrose zu vermuten.
Direkte Fibrosemarker
Direkte Fibrosemarker basieren auf Substanzen des
Bindegewebsstoffwechsels, von Kollagensynthese oder –abbau,
Glykoproteinen und Proteoglykanen der Extrazellularmatrix sowie
matrixmodifizierenden Enzymen und deren Inhibitoren 2. Zu ihnen zählen die
Hyaluronsäure, das N-terminale Prokollagen-III-Peptid, verschiedene
Metalloproteasen (MMPs) und ihre Inhibitoren (TIMPs). Die Verwendung einzelner
direkter
Fibrosemarker hat aber besonders bei
geringen Fibrosegraden nicht die erwünschte Sensitivität und Spezifität
erbracht, da ihre Aktivität sowohl von der Fibrose als auch von der Fibrogenese
abhängt. Die Nachweisverfahren sind zudem häufig experimentell. Zur Ver-besserung
der nichtinvasiven Staging-Diagnostik von Lebererkrankungen wurden daher
multiparametrische Scores wie der FibroTest® und der ELF-Score® entwickelt, die
eine deutlich bessere Voraussagekraft als die Einzelparameter haben und zum
Teil Treffsicherheiten aufweisen, die insbesondere bei fortgeschritten
Fibrosestadien nahe an der diagnostischen Genauigkeit der Leberbiopsie
liegen (Tab. 1) 3-9.
| Auswahl an multiparametrischen Scores zum nicht-invasiven Fibrosestaging (modifiziert nach Martinez et al. Hepatology 2011) | ||||
| name | Parameter | Ätiologie | AuC F4 + | Autor |
|---|---|---|---|---|
| Fibro Test® | α2 - Makroglobulin, Haptoglobulin, Bilirubin, g-GT, Apolipoprotein A1, Alter, Geschlecht | diverse | 0.82-0.92 | Imbert-Bismuth F et al. Lancet 2001 |
| Forns- Index | Thrombozyten, g-GT, Colesterin, Alter | HCV | – | Forns X et al. Hepatology 2002 |
| APRI- Score | Thrombozyten, GOT | HCV | 0.61-0.94 | Wai CT et al. Hepatology 2003 |
| Hepa- score | Hyaluronsäure, α2- Makro- globulin, Bilirubin, g-GT, Alter, Geschlecht | HCV | 0.80-0.94 | Adams LA et al. Clin Chem 2005 |
| Fibro Meter ® | Hyaluronsäure, α2- Makro- globulin, Bilirubin, g-GT, Apolipoprotein A1, Thrombozyten, Quick | diverse | 0.94 | Cales P et al. Hepatology 2005 |
| ELF- Score ® | Hyaluronsäure, TIMP-1, PIII NP, Alter | diverse | 0.87-0.90 | Rosenberg WM et al. Gastro- enterology 2006 |
Abkürzungen: HCV, chronische Hepatitis C; AUC, area under the curve, F4, Leberzirrhose; + AUC- Werte beziehen sich auf Studien bei Patienten mit chronischer HCV-Infektion
Tabelle 1: Auswahl an multiparametrische Scores zum nicht-invasiven Fibrosestaging
Eine kürzlich publizierte prospektive multizentrische
Studie verglich die Wertigkeit verschiedener nicht-invasiver biochemischer
Scores gegen den Fibroscan® bei 382 Patienten mit chronischer Hepatitis
C-Infektion 10.
Die AUC-Werte („Area under the curve“) in der ROC-Analyse lagen beim
FibroMeter®, dem FibroTest® und dem HepaScore® bei 0.84-0.86. Durch die
Kombination der verschiedenen Tests konnte die Sensitivität und Spezifität in
der Unterscheidung
„signifikante vs. geringe Fibrose“ von
70-73 % auf 80-83 % gesteigert werden. Das Vorliegen
einer Leberzirrhose konnte durch die einzelnen Tests exzellent detektiert
werden. Eine Kombination mehrerer Testverfahren erbrachte in der Detektion
einer Leberzirrhose keinen Zugewinn.
Zusammenfassend lässt sich feststellen, dass die multiparametrischen Scores, die ausschließlich auf Routinelabormessgrößen basieren, schlechter zwischen verschiedenen Fibrosestadien diskriminieren als Scores, die direkte Fibrosemarker beinhalten. Dabei erreichen die besten Scores ein Diskriminierungsniveau, welches im Bereich der Leberbiopsie liegt. Der hohen Treffsicherheit bestimmter Scores stehen die hohen Kosten gegenüber. Dennoch sind einzelne Scores auch schon als kommerzielle Assays verfügbar (z. B. FibroTest®, ELF-Test®). Der Fibro-Test® findet in Frankreich in der klinischen Praxis bereits breitere Anwendung.
Ätiologie-spezifische Scores
Die Mehrzahl der veröffentlichten Studien, in denen die
Verwendung von Serum-Markern für die Beurteilung der Leberfibrose herangezogen
wurde, ist an Patienten mit chronischer Hepatitis C evaluiert worden 4, 5, 9. Bei
Hepatitis B-infizierten Patienten ist die Studienlage im Hinblick auf die
Verwendung nicht-
invasiver Fibrosemessung schlechter.
Sebastiani und seine Mitarbeiter untersuchten den Nutzen mehrerer nicht-
invasiver Marker in einer Kohorte von 110 Patienten mit chronischer Hepatitis
B, die sich einer Leberbiopsie unterzogen hatten. Der FibroTest® und der
APRI-Score erreichten die höchste diagnos-
tische Treffsicherheit zur Feststellung einer signifikanten Fibrose. Die
Kombination beider Test erreichte eine Genauigkeit von 97 % 11.
Speziell auf eine Ätiologie beschränkte Scores finden sich bei der nichtalkoholischen Fettleber (NAFLD) und der Steatohepatitis (NASH). Bei Patienten mit NASH korrelierten die fibrotischen Veränderungen direkt mit der Ausprägung des metabolischen Syndroms, weswegen Einflussgrößen wie der Body Mass Index (BMI), die Insulinresistenz oder die Existenz eines Diabetes mellitus in die entsprechenden Scores einfließen (NAFLD-Fibrosis Score und BARD-Score) 12.
In den letzten Jahren werden zunehmend verschiedene sequentielle Algorithmen untersucht, um der unkritischen Anwendung einzelner Scores entgegenzuwirken. Dabei werden kostengünstige, einfache Scores in der Primärdiagnostik eingesetzt und erst im zweiten Schritt komplexere Scores bei den Patienten eingesetzt, bei denen die Primärdiagnostik kein eindeutiges Ergebnis erzielt hat.
Bildgebende Verfahren
Die klassische Sonographie sowie die konventionelle Kernspin- und Computertomographie eignen sich zur Beurteilung des fibrotischen Leberumbaus nur begrenzt. Mit diesen bildgebenden Verfahren kann man zwar eine Veränderung des Gewebes feststellen, aber eine genaue Bestimmung des Fibrosegrades ist nicht sicher möglich. Erst die Leberzirrhose kann per Ultraschall, MRT oder CT mit einer Sensitivität von > 90 % diagnostiziert werden.
Neben den ultraschall-basierten Systemen zur Beurteilung
der Lebersteifigkeit existieren auch CT (Fibro-CT)- und MRT-basierte Systeme.
Eine Arbeit aus dem Jahre 2008 konnte mit der MR-Elastographie in einer Kohorte
von Patienten mit verschiedenen Hepatopathien außerordentlich hohe
Treffsicherheiten für das Vorliegen einer signifikanten Fibrose (AUROC 0,99)
und einer Leberzirrhose (AUROC 1,0) nachweisen. Die Ergebnisse lagen über denen
der ultraschall-
basierten Elastographie 13.
Diese exzellenten Resultate sind allerdings noch an größeren
Patientenkollektiven mit definierter Ätiologie zu validieren. Die Nachteile der
MR- und CT-basierten Verfahren liegen sicherlich in dem hohen Zeitaufwand, den
Kosten und der Strahlenbelastung (CT).
Elastographie
| A Diagnostische Treffsicherheit des Fibro- scans zur Detektion einer Leberfibrose bei 711 Patienten (modifiziert nach Foucher 2006) | |||
| Fibro- segrad | AuroC | Cut-off (kPa) | Sensitivität/ Spezifität (%) |
|---|---|---|---|
| F = 2 | 0,80 | 7,2 | 64/85 |
| F = 3 | 0,90 | 12,5 | 65/95 |
| F = 4 | 0,96 | 17,6 | 77/97 |
B Diagnostische Treffsicherheit von ARFIi zur Detektion einer Leberfibrose bei 518 Patienten (modifiziert nach Friedrich Rust 2012) | |||
| Fibro- segrad | AuroC | Cut-off (m/s) | Sensitivität/ Spezifität (%) |
| F = 2 | 0,87 | 1,34 | 79/85 |
| F = 3 | 0,91 | 1,55 | 86/86 |
| F = 4 | 0,93 | 1,80 | 92/86 |
Abkürzungen: F: Fibrosegrad nach Metavir; AUROC: Area under the curve; F: Fibrosestadium nach Metavir; kPa: kilo Pascal; m/s: Meter pro Sekunde; ARI: Acoustic radiation force impulse imaging
Tabelle 2
Die ultraschall-basierte Messung der
Lebersteifigkeit (Elastographie) ist bereits in die aktuelle S3-Leitlinie zur
Hepatitis-C-Infektion aufgenommen worden 14.
Die transiente dynamische Elas-tographie (TE) mit mechanischer Scherwellenauslösung
(Fibroscan®) ist die am besten untersuchte bildgebende nicht-invasive Methode
zur Bestimmung des Leberfibrosegrades 15.
Ein transthorakal applizierter Transducer sendet niederfrequente Vibrationen in
das Leberparenchym und aus der Geschwindigkeit der Scherwelle wird die
Lebersteifigkeit abgeleitet (Werte in kPa). Die TE wur-
de in vielen großen Studien getestet (Tab. 2a), deren Ergebnisse bereits in
Meta-Analysen zusammengefasst wurden 16, 17.
Die AUC-Werte der ROC-Analyse lagen dabei je nach detektiertem Fibrosestadium
zwischen 0,84-0,94. Die Methode wurde bei verschiedenen Lebererkrankungen
getestet und zeigt eine hervorragende Reproduzierbarkeit. Bei hoher hepatischer
Inflammation oder intrahepatischer Cholestase ist das Verfahren allerdings nicht
sinnvoll einsetzbar, da das Fibrosestadium dann überschätzt wird 18, 19. Weitere
Einschränkungen ergeben sich bei Aszites, deutlicher Verfettung und engen
Interkostalräumen.
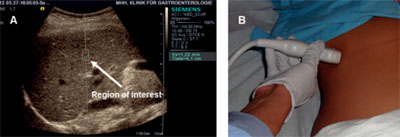
Durchführung einer Leber-Elastographie mit ARFI. A: Messung unter Sicht nach Positionierung der „Region of interest (ROI)“. Die Geschwindigkeit der Scherwelle wird in m/s angegeben. B: Messung im Interkostalschnitt mit der konvexen Sonde (C4-1).
Abbildung 2: Acoustic Radiation Force Impulse imaging (ARFI)
„Acoustic Radiation Force Impulse Imaging (ARFI)“ ist eine weiter entwickelte Technologie der Elastografie mit der Möglichkeit, die Verformbarkeit des Gewebes direkt zu skalieren und damit zu quantifizieren. Im Gegensatz zur TE kann ARFI während der routinemäßigen Ultraschalluntersuchung der Leber durchgeführt werden, da es in einem konventionellen Ultraschallgerät inte-griert ist (Abb. 2). Ein weiterer Vorteil ist die Messung unter Sicht, bei welcher der Untersucher den Messort genau definieren kann. Die mit dieser Methode erzeugten transversal verlaufenden Scherwellen stehen im messbaren Verhältnis zur Gewebesteifigkeit (Ergebnisse in m/s). Jüngste Studien zeigen eine gute diagnostische Treffsicherheit zur Beurteilung des Fibrosegrades in der Leber bei Patienten mit unterschiedlichen Lebererkrankungen 20, 21. Acht der bislang vorliegenden Studien zu ARFI wurden kürzlich in einer Metaanalyse zusammengefasst (518 Patienten) (Tab. 2b) 22. Damit ist ARFI der TE ebenbürtig, auch wenn die wissenschaftliche Evaluation noch weniger weit fortgeschritten ist.
Nicht-invasive Fibrosemarker als Prognosefaktor
Die Steifheit der Leber korreliert signifikant mit klinischen, biologischen und morphologischen Parametern der Lebererkrankung. Obwohl die Höhe der durch den Fibroscan gemessenen Lebersteifigkeit mit dem portalen Druck und dem Grad der Ösophagusvarizen korreliert, reicht unter Berücksichtigung aller Studien das Potential der TE nicht aus, um generell invasive Maßnahmen einzusparen 23. Ein limitierender Faktor scheint zu sein, dass die Korrelation zwischen portaler Hypertension und Lebersteife abnimmt, wenn der hepatisch-venöse Druckgradient Werte von 12 mmHg überschreitet 24.
In einer japanischen Arbeit wurde die Risikoabschätzung mittels TE für die Entwicklung eines hepatozellulären Karzinoms (HCC) untersucht 25. Bei insgesamt 866 HCV-positiven Patienten wurde eine TE zu Studienbeginn und regelmäßig über einen mittleren Zeitraum von 3 Jahren durchgeführt. Die „3-Jahres kumulative Wahrscheinlichkeit“ für die Entwicklung eines HCC korrelierte mit dem TE-Wert zu Studienbeginn. Bei Patienten mit Werten ≤ 10 kPa lag die HCC-Rate bei 0,4 %, bei Werten > 25 kPa bei 38 %.
Ob nicht-invasive Marker zur Beurteilung des Therapieansprechens herangezogen werden können, wurde sowohl bei Patienten mit chronischer HBV-Infektion als auch bei HCV/HIV-koinfizierten Patienten untersucht. Halfon und seine Mitarbeiter untersuchten 114 HIV/HCV-koinfizierte Patienten vor und nach Behandlung mit pegyliertem Interferon und Ribavirin und verglichen verschiedene nicht-invasive Fibrosetests mit der Leberhistologie. 26 Bei den Patienten mit virologischem Ansprechen (SVR 25 %) sanken der Forns-Score, der FibroTest®, der FIB-4, der FibroMeter® und der APRI deutlich nach Virusclearance und korrelierten sowohl mit der histologisch bestätigten Nekroinflammation als auch mit dem Fibrosegrad. In Zukunft könnten daher Fibrosemarker bei der Überwachung von antifibrotischen Therapien hilfreich sein.
Obwohl die genaue Bedeutung nicht-invasiver Fibrosemarker als Prognosefaktor bei Patienten mit chronischen Lebererkrankungen noch unklar ist, ergeben sich aus den hier dargestellten Studien interessante Ansätze für die Zukunft. Die nicht-invasive Fibrosemessung könnte eventuell zur Verlaufskontrolle herangezogen werden, allerdings sind alle Verfahren zur Verlaufskontrolle nicht Evidenz-basiert. Prinzipiell wäre abhängig vom Fibrosegrad eine Kontrolle alle 1-2 Jahre ausreichend.
1. Cadranel JF, Rufat P, Degos F. Practices of liver biopsy in France: results of a prospective nationwide survey. For the Group of Epidemiology of the French Association for the Study of the Liver (AFEF). Hepatology 2000;32:477-81.
2. Martinez SM, Crespo G, Navasa M, Forns X. Noninvasive assessment of liver fibrosis.
Hepatology 2011;53:325-35.
3. Cales P, Oberti F, Michalak S, Hubert-Fouchard I, Rousselet MC, Konate A, Gallois Y, Ternisien C, Chevailler A, Lunel F. A novel panel of blood markers to assess the degree of liver fibrosis. Hepatology 2005;42:1373-81.
4. Adams LA, Bulsara M, Rossi E, DeBoer B, Speers D, George J, Kench J, Farrell G,
McCaughan
GW, Jeffrey GP. Hepascore: an accurate validated predictor of liver fibrosis in chronic hepatitis C infection. Clin Chem
2005;51:1867-73.
5. Forns X, Ampurdanes S, Llovet JM, Aponte J, Quinto L, Martinez-Bauer E, Bruguera M, Sanchez-Tapias JM, Rodes J. Identification of chronic hepatitis C patients without hepatic fibrosis by a simple predictive model. Hepatology 2002;36:986-92.
6. Imbert-Bismut F, Ratziu V, Pieroni L, Charlotte F, Benhamou Y, Poynard T. Biochemical markers of liver fibrosis in patients with hepatitis C virus infection: a prospective study. Lancet 2001;357:1069-75.
7. Rosenberg WM, Voelker M, Thiel R, Becka M, Burt A, Schuppan D, Hubscher S, Roskams T, Pinzani M, Arthur MJ. Serum markers detect the presence of liver fibrosis: a cohort study. Gastroenterology 2004;127:1704-13.
8. Sterling RK, Lissen E, Clumeck N, Sola R, Correa MC, Montaner J, M SS, Torriani FJ, Dieterich DT, Thomas DL, Messinger D, Nelson M. Development of a simple noninvasive index to predict significant fibrosis in patients with HIV/HCV coinfection. Hepatology 2006;43:1317-25.
9. Wai CT, Greenson JK, Fontana RJ, Kalbfleisch JD, Marrero JA, Conjeevaram HS, Lok AS.
A
simple noninvasive index can predict both significant fibrosis and cirrhosis in patients with chronic hepatitis C.
Hepatology 2003;38:518-26.
10. Zarski JP, Sturm N, Guechot J, Paris A, Zafrani ES, Asselah T, Boisson RC, Bosson JL, Guyader D, Renversez JC, Bronowicki JP, Gelineau MC, Tran A, Trocme C, De Ledinghen V, Lasnier E, Poujol-Robert A, Ziegler F, Bourliere M, Voitot H, Larrey D, Rosenthal-Allieri MA, Fouchard Hubert I, Bailly F, Vaubourdolle M. Comparison of nine blood tests and transient elastography for liver fibrosis in chronic hepatitis C: the ANRS HCEP-23 study. J Hepatol 2012;56:55-62.
11. Sebastiani G, Vario A, Guido M, Alberti A. Sequential algorithms combining non-invasive
markers and biopsy for the assessment of liver fibrosis in chronic hepatitis B. World J Gastroenterol
2007;13:525-31.
12. Guha IN, Parkes J, Roderick PR, Harris S, Rosenberg WM. Non-invasive markers associated with liver fibrosis in non-alcoholic fatty liver disease. Gut 2006;55:1650-60.
13. Huwart L, Sempoux C, Vicaut E, Salameh N, Annet L, Danse E, Peeters F, ter Beek LC, Rahier J,
Sinkus R, Horsmans Y, Van Beers BE. Magnetic resonance elastography for the
noninvasive staging of liver fibrosis.
Gastroenterology 2008;135:32-40.
14. Sarrazin C, Berg T, Ross RS, Schirmacher P, Wedemeyer H, Neumann U, Schmidt HH, Spengler U,
Wirth S, Kessler HH, Peck-Radosavljevic M, Ferenci P, Vogel W, Moradpour D,
Heim M, Cornberg M, Protzer U, Manns
MP, Fleig WE, Dollinger MM, Zeuzem S. [Prophylaxis, diagnosis and therapy of hepatitis C virus (HCV) infection: the
German guidelines on the
management of HCV infection]. Z Gastroenterol 2010;48:289-351.
15. Friedrich-Rust M, Rosenberg W, Parkes J, Herrmann E, Zeuzem S, Sarrazin C. Comparison of ELF, FibroTest and FibroScan for the non-invasive assessment of liver fibrosis. BMC Gastroenterol 2010;10:103.
16. Friedrich-Rust M, Ong MF, Martens S, Sarrazin C, Bojunga J, Zeuzem S, Herrmann E.
Performance of transient elastography for the staging of liver fibrosis: a meta-analysis.
Gastroenterology
2008;134:960-74.
17. Talwalkar JA. Methodologic issues with transfer of ultrasound-based transient elastography into clinical practice. J Hepatol 2007;47:301-2.
18. Arena U, Vizzutti F, Corti G, Ambu S, Stasi C, Bresci S, Moscarella S, Boddi V, Petrarca A, Laffi G, Marra F, Pinzani M. Acute viral hepatitis increases liver stiffness values measured by transient elastography. Hepatology 2008;47:380-4.
19. Colombo S, Buonocore M, Del Poggio A, Jamoletti C, Elia S, Mattiello M, Zabbialini D, Del
Poggio P. Head-to-head comparison of transient elastography (TE), real-time tissue elastography (RTE), and acoustic
radiation force impulse (ARFI) imaging in the
diagnosis of liver fibrosis. J Gastroenterol 2012.
20. Friedrich-Rust M, Wunder K, Kriener S, Sotoudeh F, Richter S, Bojunga J, Herrmann E, Poynard T, Dietrich CF, Vermehren J, Zeuzem S, Sarrazin C. Liver fibrosis in viral hepatitis: noninvasive assessment with acoustic radiation force impulse imaging versus transient elastography. Radiology 2009;252:595-604.
21. Rifai K, Cornberg J, Mederacke I, Bahr MJ, Wedemeyer H, Malinski P, Bantel H, Boozari B, Potthoff A, Manns MP, Gebel M. Clinical feasibility of liver elastography by acoustic radiation force impulse imaging (ARFI). Dig Liver Dis 2011;43:491-7.
22. Friedrich-Rust M, Nierhoff J, Lupsor M, Sporea I, Fierbinteanu-Braticevici C, Strobel D, Takahashi H, Yoneda M, Suda T, Zeuzem S, Herrmann E. Performance of Acoustic Radiation Force Impulse imaging for the staging of liver fibrosis: a pooled meta-analysis. J Viral Hepat 2012;19:e212-9.
23. Castera L, Pinzani M, Bosch J. Non invasive evaluation of portal hypertension using transient elastography. J Hepatol 2011;56:696-703.
24. Lemoine M, Katsahian S, Ziol M, Nahon P, Ganne-Carrie N, Kazemi F, Grando-Lemaire V, Trinchet JC, Beaugrand M. Liver stiffness measurement as a predictive tool of clinically significant portal hypertension in patients with compensated hepatitis C virus or alcohol-related cirrhosis. Aliment Pharmacol Ther 2008;28:1102-10.
25. Masuzaki R, Tateishi R, Yoshida H, Sato S, Kato N, Kanai F, Sugioka Y, Ikeda H, Shiina S, Kawabe T, Omata M. Risk assessment of hepatocellular carcinoma in chronic hepatitis C patients by transient elastography. J Clin Gastroenterol 2008;42:839-43.
26. Halfon P, Carrat F, Bedossa P, Lambert J, Penaranda G, Perronne C, Pol S, Cacoub P. Effect of antiviral treatment on serum markers of liver fibrosis in HIV-hepatitis C virus-coinfected patients: the Fibrovic 2 Study - ANRS HC02. Antivir Ther 2009;14:211-9.





