The International Liver Congress™ 2012 , Barcelona, 18.–22. April
2012
Rasanter Fortschritt bei Interferon-freier Therapie
Im Mittelpunkt des Internationalen Leberkongresses stand ganz klar die Hepatitis-C-Therapie. Die dramatischen Fortschritte auf diesem Gebiet waren sicher ein wichtiger Grund für den erneuten Anstieg der Teilnehmerzahl auf den bisherigen Höchststand von über 9000 bei der 47. Tagung der EASL (European Association for the Study of the Liver). Auch das Interesse der Wissenschaftler war groß. 2400 Abstracts wurden eingereicht, über 1000 wurden präsentiert.
Adieu Interferon
Bei der Hepatitis-C-Therapie gab es so viele Updates und Neuvorstellungen, dass es schwierig ist, den Überblick zu behalten. Als kurze Zusammenfassung kann man festhalten, dass
- die Interferon-freie Therapie wirkt
- die Therapiedauer kürzer wird
- die Verträglichkeit durch den Wegfall von Interferon besser ist und
- der IL28B-Genotyp und die Fibrose weiterhin wichtige Prädiktoren sind.
| Therapieregime bei Hepatitis C | erfolgschancen |
|---|---|
|
Tripletherapie mit pegIFN, Ribavirin und einem DAA/HTA mit niedriger Resistenzschwelle Tripletherapie mit pegIFN, Ribavirin und einem DAA/HTA mit hoher Resistenz- schwelle Quadrupletherapie mit pegIFN, Ribavirin und zwei DAA/HTA Interferon-frei |
SVR stark abhängig von Interferon-Wirkung SVR weniger abhängig von Interferon- Wirkung SVR weniger abhängig von Interferon- Wirkung SVR abhängig von Potenz und Resistenz- barriere der Kombination |
Tabelle 1: Übersicht aktuell verfügbare und experimentelle Therapieregime
Bei den derzeitigen verfügbaren und experimentellen Therapieregimen unterscheidet man die Tripletherapie mit einem direkt antiviralen Medikament (DAA) oder einem auf Wirtsstrukturen zielenden antiviralen Medikament (HTA=Host Targeted Antiviral), die Quadrupletherapie mit zwei DAA und die Interferon-freie Therapie (Tab. 1).
Die direkt antiviralen Substanzen unterscheiden sich im Hinblick auf die antivirale Potenz, die Wirksamkeit bei erschiedenen Genotypen, die Resistenzbarriere und das Nebenwirkungsprofil. Die kürzere Therapiedauer und die mittlerweile etablierte SVR12 führen zu einer Verkürzung der Entwicklung dieser neuen Substanzen und des Regimes. Konkret heißt das, die Interferon-freie Therapie wird schneller zur Verfügung stehen als ursprünglich gedacht. Sollte es keinen Rückschlag geben, könnte die Behandlung ohne Interferon bereits in zwei bis drei Jahren klinischer Alltag sein.
Tripletherapie mit Boceprevir/Telaprevir
Die beiden aktuell verfügbaren HCV-Proteasehemmer Boceprevir und Telaprevir gelten als DAA mit geringer Resistenzschwelle. Die Wirksamkeit von Interferon spielt daher eine große Rolle. Patienten mit günstigem IL28B-Genotyp schneiden besser ab. Bei therapienaiven Patienten mit Genotyp IL28B CC könnte sogar eine insgesamt 12-wöchige Tripletherapie ausreichen. Das legt eine retrospektive Analyse der Phase-2-Studie PROVE 2 nahe, in der alle 12 der nicht vorbehandelten Patienten nach 12 Wochen Telaprevir plus pegIFN und Ribavirin ein anhaltendes virologisches Ansprechen erreichten (Bronowicki A et al., #1094).
Ribavirin spielt bei der Kombination ebenfalls eine große Rolle, jedoch kann man hier die Dosis reduzieren, ohne auf die Chancen einer Heilung zu verzichten. In den Telaprevir-Studien ADVANCE, ILLUMINATE und REALIZE war die zusätzliche Gabe von Erythropoietin nicht erlaubt. Ribavirin wurde hier wegen Anämie auf bis zu 600 mg/d verhindert. Weder das Ausmaß der Dosisreduktion noch der Zeitpunkt noch die Dauer der Reduktion hatte die SVR-Raten nennenswert vermindert, und zwar sowohl bei den therapienaiven wie den vorbehandelten Patienten (Sulkowski M et al., #1162).
Bei Anämie Ribavirin reduzieren
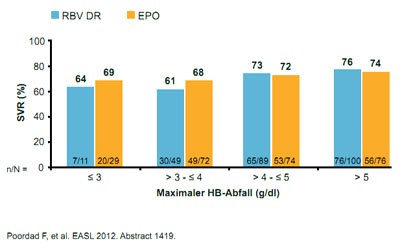
Abbildung 1: Keine Korrelation von Hämoglobin-Abfall und SVR-Rate unter
Boceprevir-Tripletherapie bei verschiedenen Anämie-Managementstrategien
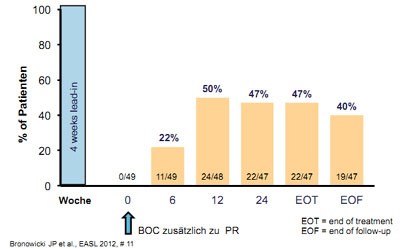
Abbildung 2: Kumulatives Ansprechen auf
Boceprevir-Tripletherapie bei Nullrespondern
In den Zulassungsstudien von Boceprevir war dagegen die Gabe von Erythropoietin erlaubt. Eine Phase-3-Studie, deren Ergebnisse erstmals präsentiert wurden, belegt nun, dass die Reduktion der Ribavirin-Dosis bei Anämie unter einer Tripletherapie mit Boceprevir den gleichen anti-anämischen Effekt hat wie die Gabe von Erythropoietin, ohne die SVR-Rate zu verschlechtern. An der Untersuchung nahmen über 600 therapienaive Patienten teil. Bei mehr als der Hälfte fiel das Hämoglobin (Hb) unter 10 mg/dl. Diese Patienten erhielten entweder 40.000 IU/w Erythropoietin oder die Ribavirin-Dosis wurde in 200-mg-Schritten reduziert. Bei einem Hb < 8,5 g/dl konnte zusätzlich entweder Erythropoietin eingesetzt bzw. die Ribavirin-Dosis vermindert oder Erythrozyten transfundiert werden. Bei einem Hb < 7,5 g/dl wurde die Studie abgebrochen. In beiden Studienarmen erreichten gleich viele Patienten eine SVR (71 %) und gleich viele erlitten einen Relaps (10 %). Der Abfall des Hämoglobins korrelierte nicht mit der SVR (Abb. 1). Die Verträglichkeit beider Managementoptionen war vergleichbar und wegen einer Anämie mussten nur rund 2 % der Patienten in jedem Arm die Behandlung abbrechen (Poordad F et al., #1419).
Boceprevir bei Nullrespondern
In den Phase-3-Studien RESPOND-2 zu Boceprevir bei vorbehandelten Patienten waren Nullresponder ausgeschlossen. In der offenen Untersuchung PROVIDE wurden vortherapierte Patienten, darunter auch 52 Nonresponder (< 2log Abfall der HCV-RNA unter pegIFN/RBV zu Woche 12) mit einer Boceprevir-Tripletherapie behandelt. Erwartungsgemäß schnitten die Relapser mit einer SVR von 68 % am besten ab. Doch auch partielle bzw. Nullresponder erreichten mit 56 % und 40 % noch hohe SVR-Raten (Abb. 2). Die Relaps-Rate war gering und interessanterweise in allen drei Gruppen vergleichbar. Prädiktoren für das Abschneiden waren Nullresponse, Thrombozytenzahl, Geschlecht und Ausgangsviruslast. Keinen Einfluss hatten in dieser Studie Alter, Ethnie, HCV Subtyp, BMI, Fibrose und GPT (Bronowicki GP et al., #204).
Vorsicht bei Leberzirrhose
Die Tripletherapie ist wirksamer als die Standardtherapie, aber sie ist auch schlechter verträglich. Insbesondere bei Patienten mit fortgeschrittener Lebererkrankung ist Vorsicht geboten. Diese Patienten brauchen zwar die Therapie am dringendsten, sie haben aber auch weitaus häufiger schwere Nebenwirkungen als in klinischen Studien beschrieben. Im Rahmen des französischen Early Access-Programmes ANRS CO20-CUPIC wurden 159 Patienten mit Boceprevir und 296 mit Telaprevir plus pegIFN/RBV behandelt. Hinweise auf die Leberzirrhose waren z. B. eine mittlere Thrombozytenzahl von 150.000/µl, ein Prothrombinzeit von 88, ein Albumin von 40 g/dl und ein Bilirubin von 15 µmol/l. 15 % hatten Ösophagusvarizen.
Bereits zu Woche 16 wurden bei 38 % und 48 % der Zirrhotiker schwere Nebenwirkungen beobachtet, im Vergleich zu 9 %
und 14 % in klinischen Studien (Abb. 3). 24 % und 26 % mussten die Therapie wegen Nebenwirkungen vorzeitig abbrechen,
jeweils 10 % entwickelten eine Anämie < 10 g/dl und 7 % und 13 % eine Thrombopenie < 50.000/µl. Bei jeweils 4 %
kam es zur Leberdekompensation und 2 (1 %) und 6 (2 %) der Patienten verstarben (Hezode C et al., #161).
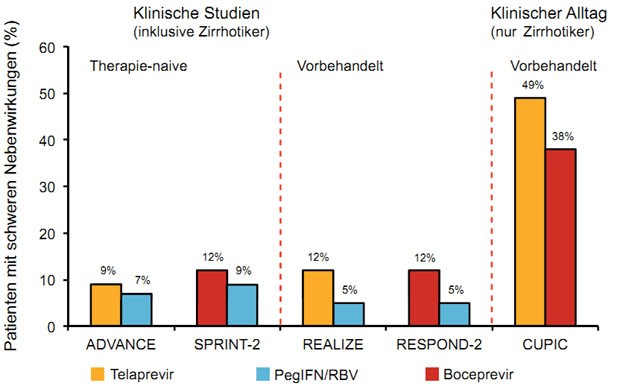
Abbildung 3: CUPIC: Häufigkeit von Nebenwirkungen unter Tripletherapie bei Patienten mit Leberzirrhose im klinischen Alltag vs. Studien.
Transplantat-Hepatitis
Die Franzosen berichteten auch über erste Erfahrungen bei schwerer HCV-Reinfektion nach Lebertransplantation. Die 28 Patienten erhielten eine Tripletherapie mit Boceprevir (n=17) oder Telaprevir (n=11). Rund die Hälfte der Patienten war bereits nach Transplantation konventionell behandelt worden. Zu Woche 4 nach Beginn der Dreifachkombination waren 35 % bzw. 36 %, zu Woche 8, 70 % bzw. 56 % der Patienten Virus-frei. Die Interaktionen zwischen den Immunsuppressiva und dem Proteasehemmer konnten gut kontrolliert werden. Die beiden Proteasehemmer erhöhen die Cyclosporin- und Tacrolimus-Spiegel, was jedoch durch Dosisreduktion ausgeglichen werden konnte. Die häufigste Nebenwirkung war die Anämie. 93 % der Patienten brauchten Erythropoietin (Coilly A et al., #47).
Kombinationen mit Interferon
Zu den Proteasehemmern der zweiten Generation bzw. Polymerasehemmern wurden zahlreiche Phase-2-Studien vorgestellt.
Vorteil dieser Substanzen ist die einfachere Einnahme (meist ein- bis zweimal täglich) unabhängig von der Mahlzeit und
eine bessere Verträglichkeit. Viele haben bereits einen generischen Namen (z.B. Asunaprevir, Daclatasvir, Danoprevir,
Mericitabine, Simeprevir usw.), andere tragen noch eine Nummer (GS-7977, ABT 450, BI 201335 und 207127 usw.). In
Tripletherapie mit pegIFN/RBV wurden SVR-Raten bis 94 % erreicht (Tab. 2a und b). Auch die Quadrupletherapie mit einem
Proteasehemmer und einem Polymerasehemmer plus pegINF und Ribavirin zeigte eine hohe Wirksamkeit. So erreichten
beispielsweise in einer Untersuchung mit Daclastasvir und Asunaprevir in Kombination mit pegIFN/RBV 90 % der
Nullres-ponder (!) ohne Zirrhose eine SVR4 (Suzuki F et al., #14).
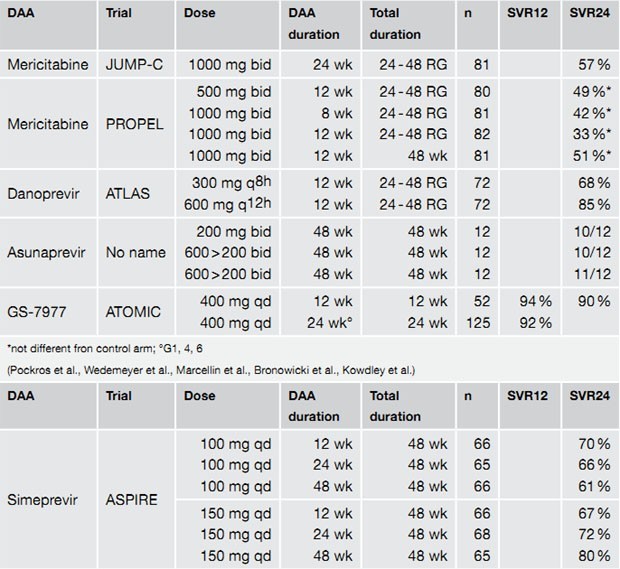
Tabelle 2 a und b: Tripletherapie bei therapienaiven Patienten (a) und vorbehandelten Patienten (b) mit pegIFN/RBV und einem direkt antiviralen Medikament. Nach Pawlotsky JM, ILM 2012.
Wissenschaft und Aktienmarkt
Für die neuen HCV-Medikamente interessieren sich nicht nur Betroffene und Ärzte, sondern auch die Finanzwelt. Nachdem zur Substanz GS-7977 auf dem amerikanischen Leberkongress AASLD sehr vielversprechende Daten präsen- tiert wurden, schnellte der Aktienkurs des Unternehmens Gilead Sciences rasant in die Höhe, um dann nach Veröffentlichung des ersten Rückschlags wieder abzufallen. Mit Aktien ist viel Geld zu verdienen, das konnte man auf dieser Tagung hautnah spüren. Vor den Postern drängten sich manchmal fast so viele Analysten wie Ärzte. Doch weder die einen noch die anderen können sicher vorhersagen, welche Substanz als erste zugelassen werden wird und welche Kombination am besten ist.
Interferon Lambda
Interferon Lambda ist ein neues pegyliertes Interferon, das besser verträglich ist als pegyliertes Interferon alpha. In der Phase-2-Studie EMERGE an Patienten mit GT 2 und 3 erreichten gleich viele Patienten eine SVR. Eine Reduktion der Interferon-Dosis war unter Interferon Lambda seltener notwendig (7 % vs. 27 %) und „leichtere“ Beschwerden wie Muskelschmerzen (28 % vs. 63 %) und Müdigkeit (28 % vs. 53 %) waren ebenfalls seltener. Neuropsychiatrische Nebenwirkungen waren dagegen gleich häufig (Zeuzem S et al., #10).
Interferon-freie Kombinationen
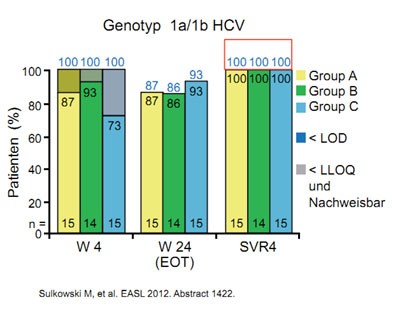
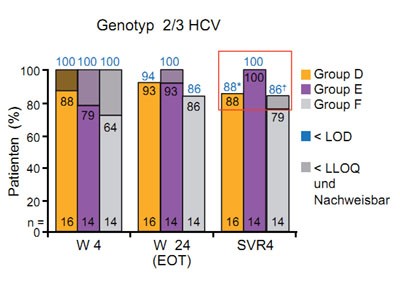
Abbildung 4a und b: Daclatasvir plus GS-7977 mit/ohne Ribavirin. Wirksamkeit in Abhängigkeit vom Genotyp.
Das Bessere ist der Feind des Guten. Dieser Spruch beschreibt den momentanen Stand der Therapieentwicklung bei der Hepatitis C sehr gut. Die Kombination der neueren direkt antiviralen Substanzen mit Interferon und Ribavirin haben das Potenzial, die SVR-Raten selbst bei schwer zu behandelnden Patienten auf über 80 % zu steigern. Doch die Interferon-freien Regime können noch mehr. In den vorgestellten Arbeiten wurden SVR-Raten bis zu 100 % vorgestellt, und das bei so kurzer Therapiedauer wie 12 Wochen und weitaus besserer Verträglichkeit. Besonderes Aufsehen erregte in diesem Zusammenhang die Kombination des NS5A-Inhibitors Daclatasvir und des NS5B-Inhibitors GS-7977. Beide Medikamente werden einmal täglich eingenommen und führten bei einer Therapiedauer von 24 Wochen bei allen Patienten mit GT1 zu einer SVR4 unabhängig vom HCV GT1-Subtyp und dem IL28B-Status. Darüber hinaus erreichten auch über 90 % der Patienten mit Genotyp 2 und 3 die SVR4 (Abb. 4 a und b). Die Verträglichkeit war gut. Es wurden keine schweren Nebenwirkungen beobachtet (Sulkowski M et al., #1422). Leider wird diese vielversprechende Kombination nicht weiterentwickelt, denn die Substanzen gehören unterschiedlichen Firmen: GS-7977 gehört Gilead Sciences und Daclatasvir Bristol-Myers Squibb. Die Entscheidung der Unternehmen hatte einige negative Kommentare vonseiten der Community ausgelöst, doch es gab keine öffentliche Kritik oder Aktionen.
Host Targeted Antivirals
Alisporivir (früher Debio 025) greift nicht direkt HCV an, sondern blockiert Cyclophilin in der Wirtszelle und hemmt dadurch die Replikation von HCV. Die Substanz wirkt gegen alle HCV-Genotypen und hat eine hohe Resistenzbarriere. In der Studie VITAL-1 an therapienaiven Patienten mit GT 2 und 3 erreichten unter Alisporivir /Ribavirin SVR-Raten bis 94 % (Pawlotsky JA et al., #1405). Die Studie war jedoch kurz vor Ende gestoppt worden, da einige Patienten (6/1800) eine lebensbedrohliche Pankreatitis entwickelt hatten. Diese Patienten hatten Alisporivir in Kombination mit Interferon/Ribavirin eingenommen. Wie es mit Alisporivir jetzt weitergeht, ist noch unklar. Sollte diese Substanz nicht weiterentwickelt werden, wäre das ein Rückschlag, aber nicht das Ende für die Cyclophilin-Inhibitoren. Es gibt schon einen Nachfolger, nämlich BC-556.
Miravirsen ist der erste microRNA-Inhibitor. Er hemmt miR-122, eine leberspezifische Micro-RNA, die HCV zur Replikation braucht. Die Substanz muss subkutan gespritzt werden und wirkt bei allen HCV-Genotypen. In der vorgestellten Studie zeigte Miravirsen eine gute Verträglichkeit und eine dosisabhängige Wirksamkeit bei einer Halbwertszeit von 30 Tagen (Reesink HW et al., #58).
Relaps und Resistenz

iLiver®
Die neue App der EASL iLiver®, die auf der Konferenz offiziell gestartet wurde, ist eine interaktive und dynamische Platform für Ärzte, quasi ein Minilehrbuch der Hepatologie für das iPhone. Die App wird von der EASL, so war zu hören, stets auf dem neuesten Stand gehalten. Sie kann kostenfrei im App-Store heruntergeladen werden.
Wann ist man geheilt? Bislang galt die Regel: sechs Monate nach Therapieende. Mittlerweile wartet man nicht mehr so lange. Die SVR12, d. h. HCV-RNA negativ 12 Wochen nach Therapieende, wird mittlerweile allgemein akzeptiert. Nun wurde eine Arbeit vorgestellt, in der die SVR4 propagiert wurde. In dieser Analyse von zwei Phase-2-Studien (ELECTRON und PROTON) mit dem neuen Nukleotid GS-7977 mit und ohne Interferon korrelierten die SVR-Raten SVR4, SVR12 und SVR24 zu 100 %, und zwar im Rahmen eines Interferon-haltigen wie Interferon-freien Therapieregimes. In den beiden Studien wurden 117 Patienten mit HCV Genotyp 1-3 behandelt. Lediglich bei vier Patienten kam es zum Relaps, und zwar bei allen Patienten bereits in den ersten vier Wochen nach Therapieende nachweisbar (Lawitz E et al., #7). Die Patientenzahl bei dieser Analyse war allerdings klein und die Relapsrate ausgesprochen gering. Das wichtigste Argument gegen die SVR4 lieferte jedoch eine andere Studie. In diese Untersuchung war die Interferon-freie Kombination von ABT-450/r und ABT-072 plus Ribavirin bei Patienten mit GT1 und IL28BCC ausgesprochen erfolgreich, doch bei einem Patienten kam es zwischen Woche 24 und 36 zum Relaps (Lawitz E et al., #13).
Zur Resistenz gab es keine Überraschungen. Die NS3/4A-Proteasehemmer Boceprevir und Telaprevir haben eine niedrige Resistenzbarriere, wobei sich unter GT 1a virale Durchbrüche deutlich häufiger sind, da bei diesem Genotyp lediglich eine Mutation ausreicht während bei Genotyp 1b zwei Mutationen für die Resistenz erforderlich sind. Wie lange die resistenten Varianten überleben, ist derzeit noch unklar. Bei den meisten Patienten verschwinden sie innerhalb von ein bis zwei Jahren, in Einzelfällen waren sie jedoch noch nach vier Jahren nachweisbar. Die „Nachfolger“ Simeprevir (ehemals TMC 435) und BI 201335, die ebenfalls NS3/4A-Inhibitoren sind, zeigen ein ähnliches Resistenzprofil, d. h., es ist eine zumindest teilweise Kreuzresistenz zu erwarten (Sarrazin C).
Leitlinien Update Hepatitis B
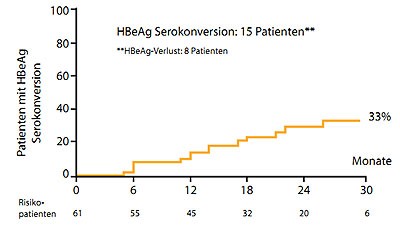
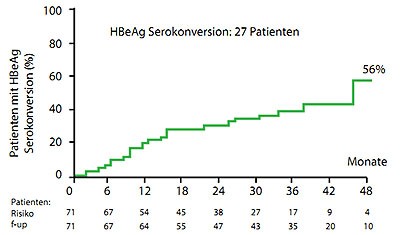
Abbildung 5a und b: HBeAg-Serokonversion unter 30 Monaten Tenofovir (a) und 48 Monaten Entecavir (b).
(Lampertico P et al., #522 und 525)
Die Hepatitis B war auf dieser Tagung eher ein Randthema. Dennoch gab es einige interessante Aspekte. Zum einen wurde das neue Update der Leitlinien zur Hepatitis B vorgestellt. Neuerungen betreffen unter anderem die Bereiche Prophylaxe, Therapieversagen und Schwangerschaft. Bei Immunsuppression, z.B. Chemotherapie oder Therapie mit TNF Alpha-Blockern, wird die frühzeitige Prävention der Hepatitis B-Reaktivierung mit einem Polymerasehemmer empfohlen. Bei Therapieversagen unter einem Polymerasehemmer sollte man nicht mehr wie früher eine zweite Substanz dazugeben („Add-on“), sondern auf eine potentere Substanz, z.B. Entecavir oder Tenofovir, wechseln. Eine Therapie der Hepatitis B in der Schwangerschaft ist möglich und bei sehr hoher Viruslast auch empfehlenswert, wobei insbesondere zu Tenofovir und Telbivudin günstige Daten zur Sicherheit vorliegen. Die Leitlinien stehen im Internet auf der Homepage der EASL frei zur Verfügung (www.easl.eu).
Interferon bei Hepatitis B
Viele Arbeiten beschäftigten sich damit, wie man den Einsatz von pegyliertem Interferon bei der Hepatitis B optimieren könnte. Die Gabe von Entecavir in Kombination mit Interferon hat zumindest im Tierversuch neben dem direkt antiviralen Effekt auch die Sensitivität der Hepatozyten auf Interferon gesteigert (Allweiss K et al., #42). Prädiktoren für das Ansprechen einer Interferon-Therapie könnten neben der HBsAg-Konzentration auch das Fehlen von Mutationen sein. In einer holländischen Untersuchung an über 200 HBeAg-positiven Patienten kam es bei denen mit HBV-Wildtyp häufiger zum HBsAg-Verlust als bei Patienten mit PC- oder BCP-Mutanten (Sonneveld MJ et al., # 54). Neue Substanzen gegen Hepatitis B sind leider kaum in Sicht. Alisporivir könnte ein Lichtblick sein. Das Medikament, das derzeit klinisch bei der Hepatitis C geprüft wird, hemmte in vitro auch die Replikation von HBV und zeigte einen synergistischen Effekt mit dem Polymerasehemmer Telbivudin (Phillips S et al., #506).
Zu den gängigen Polymerasehemmer Tenofovir und Entecavir wurden Langzeitdaten von italienischen Praxiskohorten präsentiert. In der Tenofovir-Kohorte hatten 95 % der therapienaiven Patienten nach 36 Monaten keine nachweisbaren HBV-Viren mehr im Blut, bei einem Drittel war es zur HBeAg-Serokonversion gekommen und 5 Patienten hatten HBsAg verloren (Lampertico P et al., #525). In der Entecavir-Kohorte betrug die Beobachtungszeit 54 Monaten und alle Patienten hatten eine HBV-DNA unter der Nachweisgrenze. Bei 56 % kam es zur HBeAg-Serokonversion und bei 21 % zum HBsAg-Verlust (Lampertico P et al., #522). Die zusätzliche Gabe von Entecavir war in der Tenofovir-Gruppe bei einem Patienten, umgekehrt bei 20 Patienten notwendig. Ein Patient unter Entecavir entwickelte eine Resistenz. Hier muss man – ebenso wie bei HBeAg-Serokonversion und HBs-Verlust – berücksichtigen, dass die Patienten in der Entecavir-Gruppe bereits zwei Jahre länger behandelt wurden.

Foto: Guillaume de
Fenoyl/EASL






