Karsten Wursthorn, Hannover
Prävention der Hepatitis B Reaktivierung
Die Hepatitis B Reaktivierung wird als ein Wiederauftreten
der HBV-Replikation mit einem Anstieg der Serum HBV-DNA und der ALT als Zeichen
der Leberentzündung bei zuvor inaktiven HBsAg-Trägern
oder Patienten mit durch-
gemachter Infektion beschrieben 1, 2.
Typischerweise lässt sich zuerst die HBV-DNA im Serum nachweisen, bevor es zu
einem ALT-Anstieg kommt. Die reaktivierte akute Hepatitis kann ebenso wie nach
einer Erstinfektion mit dem Hepatitis B Virus entweder zu einem akuten
Leberversagen bis hin zum Tod führen, oder einen chronischen Verlauf mit seinen
bekannten Komplikationen wie Leberzirrhose und Entwicklung eines
hepatozellulären Karzinoms (HCC) nehmen.
Häufigkeit und Folgen
| Virologische / Serologische ursachen | Weitere ursachen |
|---|---|
| HBsAg-positiv | Art der malignen Erkrankung (v. a. Lymphome) |
| Anti-HBc positiv | Medikamentöse Immunsuppression / Chemotherapie (v. a. Steroide, Rituximab) |
| Anti-HBs niedrig positiv (<100IU/ml) | Immunrekonstitution |
| HBV-DNA nachweisbar |
|
Tabelle 1: Prädiktoren einer Hepatitis B Reaktivierung
Ist die Hepatitis B Reaktivierung medikamentös bedingt,
macht sie oft eine Dosisreduktion, Pausierung der Behandlung oder gar einen
kompletten Therapieabbruch infolge der Lebererkrankung notwendig, die den
Erfolg der immunsuppressiven Behandlung und / oder der Chemotherapie gefährden.
Nach der Reduktion oder dem kompletten Absetzen der Immunsuppression bzw.
Chemotherapie kann es zu einer Rekonstitution des Immunsystems mit einer
Erholung der neutrophilen Lymphozytenpopulation kommen, die ihrerseits die
Schädigung der Leber verstärkt. Das Risiko einer Reaktivierung ist dabei u. a.
abhängig vom serologischen Status und kommt häufiger bei HBsAg-positiven
Patienten als bei anti-HBc-positiven / anti-HBs-positiven Patienten vor. Ohne
Prophylaxe kann es bei bis zu 85 %
der HBsAg-positiven Patienten mit einem Non-Hodgkin Lymphom (NHL) unter
Steroid-haltiger Chemotherapie zu einer Hepatitis B Reaktivierung mit einer
hohen HBV-
assoziierten Letalität kommen. Aber auch weitere Faktoren wie die Viruslast,
die Art der malignen Erkrankung oder die eingesetzten Medikamente spielen eine
Rolle (Tab. 1).
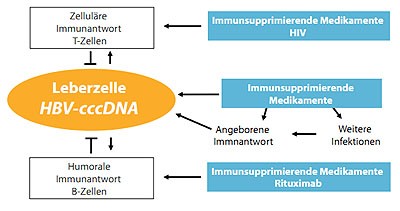
Abbildung 1: Mechanismen, die zu einer Reaktivierung der Hepatitis B bei immungeschwächten Patienten führen.
Immunsupprimierende Medikamente beeinflussen den zellulären und humoralen Arm des Immunsystems, die beim Gesunden die HBV Infektion kontrollieren. Bei Patienten, die entweder aufgrund einer Erkrankung wie HIV/AIDS oder aufgrund einer immunsuppressiven Medikation wie des anti-CD20 Antikörpers Rituxi-mab eine verminderte zelluläre oder humorale Immunantwort aufweisen, kann es zu einem Wiederauftreten der viralen Replikation und in dessen Folge auch zu einer Hepatitis mit potentiell letalem Ausgang kommen.
Innerhalb der ersten 24 Stunden nach der Infektion mit dem Hepatitis B Virus formiert sich in den Leberzellen der betroffenen Patienten ein Minichromosom, die „covalently closed circular“ cccDNA als das zentrale Molekül der HBV-Replikation. Die cccDNA Menge ist abhängig von der Phase der Hepatitis B: HBeAg-positive Patienten haben mehr cccDNA Moleküle als HBeAg-negative Patienten, HBsAg-positive Patienten haben mehr cccDNA Moleküle als HBsAg-negative Patienten. Dabei ist die cccDNA sehr langlebig und sogar noch bei Patienten nach einer ausgeheilten Hepatitis B mit anti-HBs Antikörpern nachweisbar 3. Die verbliebene hepatozelluläre cccDNA ist der Ausgangspunkt einer Hepatitis B Reaktivierung, wenn sich die kontrollierende zelluläre Antwort oder der Antikörper produzierende humorale Arm unter medikamentöser oder krankheitsbedingter Immunsuppression ab- oder gar komplett ausfallen (Abb. 1).
Auslösende Medikamente
Eine Reaktivierung der Hepatitis B kann letztlich durch jedes Medikament hervorgerufen werden, das die Funktion des Immunsystems beeinflusst. Einige tun dies jedoch mehr als andere, v. a. Steroide und der zunehmend häufiger eingesetzte monoklonale Antikörper Rituximab werden in der Folge näher beleuchtet.
Steroide
Bei Patienten, die eine Steroidtherapie erhalten, steigt die HBV-DNA. Verantwortlich dafür scheint eine Sequenz des Hepatitis B Virus zu sein, die durch Steroide aktiviert wird, und zu einer Stimulierung der HBV-Transkription und Hemmung der HBV-spezifischen zytotoxischen T-Zell Antwort führt 4-6. Werden die Steroide in der Folge reduziert oder abgesetzt, kann dies zu einer Exazerbation der Hepatitis B mit fulminantem, mitunter tödlichem Verlauf führen 7-10. Ursächlich hierfür ist u. a. die beschriebene Immunrekonstitution, die zu einem (Wieder-)Erstarken des Immunsystems führt.
Rituximab
HBsAg-positive Patienten, die Rituximab alleine oder in Kombination mit Steroiden erhalten, haben ein deutlich erhöhtes Risiko der Hepatitis B Reaktivierung. Rituximab ist ein chimärer anti-CD20 Antikörper, der die B-Zell-Population und damit die Antikörperproduzierenden Zellen gezielt angreift. Er wird alleine oder in Kombination zur Behandlung der B-Zell-NHL eingesetzt. Weitere Indikationen kamen in der Vergangenheit dazu, sodass die zugelassenen Anwendungsgebiete derzeit neben dem NHL die Chronisch Lymphatische Leukämie (CLL) und die Rheumatoide Arthritis (RA) umfassen 11. Darüber hinaus wird Rituximab u. a. zur Behandlung von Abstoßungsreaktionen nach Nierentransplantation oder der Thrombotisch Thrombozytopenischen Purpura (TTP) versuchsweise eingesetzt. Aufgrund gehäufter Todesfälle durch fulminant verlaufende Hepatitis B Reaktivierungen in Verbindung mit der (mehrfachen) Gabe von Rituximab wurde die Fachinformation zwar um die Empfehlung der Testung von Risikopatienten und die engmaschige klinische und laborchemische Überwachung von HBsAg-positiven Patienten erweitert. Dies steht jedoch deutlich hinter den Empfehlungen der Fachgesellschaften zurück. Mehrere Studien belegen die Rolle von Rituximab bei der Hepatitis B Reaktivierung. Eine kürzlich erschienene Metaanalyse kommt zu dem Ergebnis, dass eine Hepatitis B Reaktivierung bei anti-HBc positiven Patienten im Schnitt drei Monate nach der letzten Gabe auftritt, 29 % jedoch mehr als sechs Monate danach. Das Risiko einer Reaktivierung ist bei Patienten, die Rituximab erhalten, signifikant erhöht 12.
Zwei Fälle
Ein 62 Jahre alter Mann wurde mit einem akuten Leberversagen infolge einer Hepatitis B Reaktivierung vorgestellt. Fünf Monate zuvor war ein großzelliges B-Zell Lymphom auf Höhe des zweiten Lendenwirbels bei diesem Patienten diagnostiziert worden. Unter der Erstlinien-Therapie mit R-CHOP (Rituximab, Cyclophos-phamid, Doxorubicin, Vincristin und Prednison) wurde eine rapide Remission des B-Zell Lymphoms nach sechs Zyklen erreicht. Vor dem Start der Chemotherapie gab es keinen anamnestischen Hinweis auf eine HBV-Infektion, allerdings war eine Hepatitisserologie nicht bestimmt worden. Zum Zeitpunkt der Aufnahme zeigten sich laborchemisch erhöhte Transaminasen und Bilirubin, serologisch waren sowohl HBsAg und anti-HBc als auch anti-HBs vorhanden. In der Leberbiopsie zeigte sich ein zellulärer Schaden wie er bei einer viralen Hepatitis typisch ist, während eine Lymphominfiltration ausgeschlossen werden konnte. Aufgrund dieser Ergebnisse wurde eine Reaktivierung einer vorbestehenden Hepatitis B vermutet und eine antivirale Therapie mit Entecavir begonnen. Trotz der zügig eingeleiteten Behandlung kam es zu einem raschen Voranschreiten des Leberversagens mit zunehmend eingeschränkter Leberfunktion und hepatischer Enzephalopathie. Nach Ausschluss eines residualen NHLs wurde der Patient mit einem MELD Score von 40 zur Lebertransplantation gelistet und neun Tage nach Aufnahme transplantiert. Bis heute ist der Patient dank der postoperativen Rezidivprophylaxe mit Hepatitis B Immunglobulin (HBIG) und Entecavir HBsAg negativ und erfreut sich guter Gesundheit.
Bei einem weiteren Fall am hiesigen Zentrum kamen jedoch die Interventionen zu spät. Ein zum Zeitpunkt der Aufnahme 53-jähriger Mann wurde unter dem klinischen und laborchemischen Bild eines akuten Leberversagens aus einer peripheren Klinik auf die Intensivstation verlegt. Drei Monate zuvor war ein Mukosa-assoziiertes Lymphom (MALT) des Magens diagnostiziert und nach dem R-CHOP Schema behandelt worden. Erneut gab es vor Initiierung der Chemotherapie keinen anamnestischen oder klinischen Anhalt für eine Hepatitis B Virusinfektion, eine Hepatitisserologie fehlte jedoch. Nach dem 4. Zyklus entwickelte der Patient einen Ikterus und wurde zur Behandlung eines Leberversagens mit vermindertem Albumin, INR und Cholinesterase sowie erhöhtem Bilirubin stationär aufgenommen. Die Hepatitisserologie war positiv für HBsAg, anti-HBc und anti-HBe, die HBV-DNA war mit 837 Mio. IU/ml hochtitrig nachweisbar. Es wurde bereits auswärtig eine antivirale Therapie mit Lamivudin begonnen, die im Verlauf auf Entecavir umgestellt wurde. Histologisch zeigte sich bei Aufnahme eine schwere nekrotische Hepatitis mit geringer Leberregeneration und ohne Tumorinfiltration. Aufgrund der fraglichen Tumorremission nach nur 4 Zyklen R-CHOP war eine Lebertransplantation bei 29 MELD Punkten nicht möglich. Zum Bridging bis zum Abschluss der Chemotherapie wurde nach Erhalt eines positiven Ethikvotums über vier Tage eine Leberzelltransplantation durchgeführt. Darunter kam es zwar zu einem Abfall der Transaminasen und des Bilirubins, die Lebersyntheseparameter waren aber weiterhin deutlich erniedrigt. Nach Entfernung des Portalvenenkatheters kam es zu einer letalen intra-abdominellen Blutung 13.
Beide Fälle demonstrieren die rasche Dynamik einer Hepatitis B Reaktivierung unter und nach Rituximab-Gabe, die den behandelnden Ärzten nur wenige therapeutische Optionen lässt. In beiden Fällen wurde es entgegen der Leitlinien der European Society for Medical Oncology (ESMO) versäumt, vor Einleitung der Therapie auf Hepatitis B zu untersuchen. Weitere in der Literatur und durch eigene Recherche dokumentierte Fälle 14 belegen, dass eine Reaktivierung des Hepatitis B Virus auch mehrere Monate bis über ein Jahr nach Beendigung der eigentlichen Chemotherapie auftreten können.
Leitlinien zur Prophylaxe
Die Leitlinien der European Society for the Study of the Liver (EASL), die aktualisierte Leitlinie der Deutschen Gesellschaft für Verdauung und Stoffwechsel (DGVS) sowie die amerikanischen Leitlinien zur Behandlung der Hepatitis B empfehlen das Screening auf HBsAg und anti-HBc vor der Einleitung einer immunsuppressiven Behandlung und/oder Chemotherapie 1, 15, 16.
Unabhängig von der Viruslast sollte bei HBsAg-positiven
Patienten, bei denen eine immunsuppressive Behandlung und/oder Chemotherapie
geplant ist, eine prophylaktische antivirale Therapie mit einem
Nukleos(t)id-Analog begonnen werden und für mindestens sechs 1, besser bis 12
Monate nach Beendigung der immunmodulatorischen Behandlung fortgesetzt werden 15, 16. Die
umfassendste Erfahrung liegt mit der Anwendung von Lamivudin vor, das bei
Patienten mit einer geringeren Virusmenge < 2000
IU/mL ausreichend ist. Dabei senkt die präventive Gabe von Lamivudin das Risiko
der Hepatitis B-assoziierten Mortalität und Morbidität 17, 18. Für Patienten mit einer
höheren Viruslast sollte die Prophylaxe mit Nukleos(t)id-Analoga mit hoher
Resistenzbarrieren und hoher antiviraler Potenz, z. B. Tenofovir oder
Entecavir durchgeführt werden.
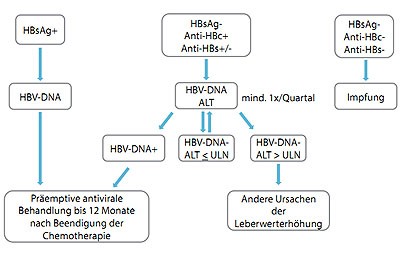
Abbildung 2: Vorgehen zur Verhinderung einer Hepatitis B Reaktivierung (Empfehlungen gemäß der deutschen und europäischen Leitlinien zur Behandlung der Hepatitis B)
Unabhängig von der Viruslast sollte bei HBsAg-positiven Patienten eine präemptive antivirale Therapie mit einem Nukleos(t)id-Analog begonnen werden und für 12 Monate nach Beendigung der immunmodulatorischen Behandlung fortgesetzt werden. Bei HBsAg-negativen, anti-HBc positiven Patienten sollte die HBV-DNA im Serum getestet werden. Ist die HBV-DNA im Serum nachweisbar, wird ebenfalls eine präemptive Therapie empfohlen. Bei HBsAg-negativen, anti-HBc positiven Patienten ohne nachweisbare HBV-DNA sollten ein- bis drei-monatliche Kontrollen der Viruslast und ALT ausreichen. Patienten ohne Hinweis für eine Infektion mit Hepatitis B sollten vor dem Beginn der Chemotherapie gegen das Hepatitis B Virus geimpft werden.
Bei HBsAg-negativen, anti-HBc positiven Patienten sollte die HBV-DNA im Serum getestet werden. Für die okkulte Hepatitis B, d. h. das Vorhandensein von HBV-DNA bei negativem HBsAg, wird ebenfalls eine präemptive Therapie vergleichbar zu den HBsAg-positiven Trägern empfohlen 15. Bei HBsAg-negativen, anti-HBc positiven Patienten ohne nachweisbare HBV-DNA gehen die Meinungen auseinander. Während manche eine ein- bis drei-monatliche („engmaschige“) Kontrolle der Viruslast für ausreichend halten, sehen andere die Indikation zur antiviralen Prophylaxe abhängig von der Art der Chemotherapie (Rituximab) oder dem Vorliegen einer hämatologischen Grunderkrankung gegeben, wobei die Dauer der Prophylaxe unklar ist. Kommt es zu einer Leberwerterhöhung ohne gleichzeitigen virologischen oder serologischen Hinweis für eine Hepatitis B, ist von einer möglicherweise toxischen oder anderen viralen Erregern (Cytomegalievirus, CMV, Herpesvirus) hervorgerufenen Ursache auszugehen.
Impfung
Patienten ohne serologischen oder virologischen Hinweis für eine Infektion mit Hepatitis B sollten vor dem Beginn der immunsuppressiven Behandlung und/oder Chemotherapie gegen das Hepatitis B Virus geimpft werden. Wurde bei den Betroffenen jedoch bereits mit einer immunsuppressiven Behandlung begonnen, kann bei anti-HBs negativen Patienten ein beschleunigtes Impfschema mit ggf. erhöhten Antigenkonzentrationen geprüft werden, um ein adäquates Impfansprechen zu erreichen (Abb. 2).
1. Lok AS, McMahon BJ. Chronic hepatitis B: update 2009. Hepatology. 2009 Sep;50(3):661-2.
2. Wursthorn K, Wedemeyer H, Manns MP. Managing HBV in patients with impaired immunit Gut. 2010 Oct;59(10):1430-45.
3. Werle-Lapostolle B, Bowden S, Locarnini S, Wursthorn K, Petersen J, Lau G, et al. Persistence of cccDNA during the natural history of chronic hepatitis B and decline during adefovir dipivoxil therapy. Gastroenterology. 2004 Jun;126(7):1750-8.
4. Chou CK, Wang LH, Lin HM, Chi CW. Glucocorticoid stimulates hepatitis B viral gene expression in cultured human hepatoma cells. Hepatology. 1992 Jul;16(1):13-8.
5. Tur-Kaspa R, Burk RD, Shaul Y, Shafritz DA. Hepatitis B virus DNA contains a glucocorticoid-responsive element. Proc Natl Acad Sci U S A. 1986 Mar;83(6):1627-31.
6. Tur-Kaspa R, Shaul Y, Moore DD, Burk RD, Okret S, Poellinger L, et al. The glucocorticoid receptor recognizes a specific nucleotide sequence in hepatitis B virus DNA causing increased activity of the HBV enhancer. Virology. 1988 Dec;167(2):630-3.
7. Koga Y, Kumashiro R, Yasumoto K, Shakado S, Ono N, Noguchi H, et al. Two fatal cases of hepatitis B virus carriers after corticosteroid therapy for bronchial asthma. Intern Med. 1992 Feb;31(2):208-13.
8. Ohtsu T, Sai T, Oka M, Sugai Y, Tobinai K. Activation of hepatitis B virus infection by chemotherapy containing glucocorticoid in hepatitis B virus carriers with hematologic malignancies. Jpn J Clin Oncol. 1991 Oct;21(5):360-5.
9. Buti M, Esteban R, Esteban JI, Gonzalez A, Guardia J. Severe hepatic failure after ARA-A-prednisolone for chronic type B hepatitis. Gastroenterology. 1987 Jan;92(1):274-5.
10. Nair PV, Tong MJ, Stevenson D, Roskamp D, Boone C. A pilot study on the effects of prednisone withdrawal on serum hepatitis B virus DNA and HBeAg in chronic active hepatitis B. Hepatology. 1986 Nov-Dec;6(6):1319-24.
11. Fachinformation. MabThera Fachinformation; 2011 Contract No.: Document Number|.
12. Evens AM, Jovanovic BD, Su YC, Raisch DW, Ganger D, Belknap SM, et al. Rituximab-associated hepatitis B virus (HBV) reactivation in lymphoproliferative diseases: meta-analysis and examination of FDA safety reports. Ann Oncol. 2011 May;22(5):1170-80.
13. Stange MA, Tutarel O, Pischke S, Schneider A, Strassburg CP, Becker T, et al. Fulminant hepatic failure due to chemotherapy-induced hepatitis B reactivation: role of rituximab. Z Gastroenterol. 2010 Feb;48(2):258-63.
14. Metzler F, Mederacke I, Manns MP, Wedemeyer H, Wursthorn K. Rituximab leads to reactivation of hepatitis B in individuals with resolved infection. Hepatology. 2008;48(4 (suppl)):685A.
15. Cornberg M, Protzer U, Petersen J, Wedemeyer H, Berg T, Jilg W, et al. [Prophylaxis, Diagnosis and Therapy of Hepatitis B Virus Infection - The German Guideline.]. Z Gastroenterol. 2011 Jul 11.
16. European Association For The Study Of The L. EASL Clinical Practice Guidelines: Management of chronic hepatitis B virus infection. J Hepatol. 2012 Mar 20.
17. Hsu C, Hsiung CA, Su IJ, Hwang WS, Wang MC, Lin SF, et al. A revisit of prophylactic lamivudine for chemotherapy-associated hepatitis B reactivation in non-Hodgkin‘s lymphoma: a randomized trial. Hepatology. 2008 Mar;47(3):844-53.
18. Loomba R, Rowley A, Wesley R, Liang TJ, Hoofnagle JH, Pucino F, et al. Systematic review: the effect of preventive lamivudine on hepatitis B reactivation during chemotherapy. Ann Intern Med. 2008 Apr 1;148(7):519-28.





