Imke Friedrichs, Annemarie Berger, Holger F. Rabenau, Martin Stürmer, Frankfurt
Infektiosität des Hepatitis C Virus
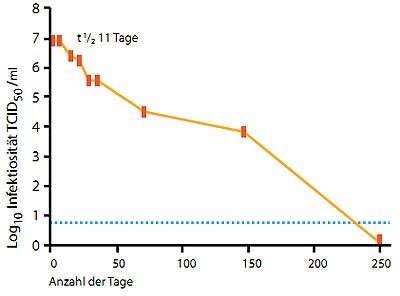
Abbildung
1: Zeitliche Abhängigkeit der Infektiosität von HCV bei 4° C in
flüssigem Medium (modifiziert nach Ciesek et al., 2010). t ½:
Halbwertszeit, TCID50: Tissue Culture Infection Dose 50 (quantitativer
Wert für die Infektiosität)
Das Hepatitis C Virus (HCV) ist ein RNA-Virus mit einer
stark lipidhaltigen Hülle und gehört zur Familie der Flaviviridae. Die
weltweite Prävalenz beträgt ca. 3 %
– wobei regional deutliche Unterschiede auftreten. Die höchste Durchseuchung
wird mit ca. 20 % aus Ägypten
berichtet. In Europa liegt die mittlere Durchseuchung bei ca. 1 %, allerdings mit einem
Nord-Süd-Gefälle: ca. 0,1 % in
skandinavischen Ländern bis hin zu ca. 6 %
in südlichen Ländern wie Bulgarien, Griechenland, Italien und Rumänien.
Empfänger von Blut und Blutprodukten waren bis zur Einführung des
HCV-Antikörper-Screenings im Blutspendewesen Anfang der 90iger Jahre eine der
Hauptrisikogruppen einer HCV-Infektion. Seitdem sind die Übertragungsraten in
diesem Bereich drastisch zurückgegangen und das Risiko u. a. durch die
Einführung der PCR-Testung im Blutspendewesen zumindest in den
industrialisierten Ländern minimiert worden. Daten für Deutschland zeigen, dass
die meisten HCV-positiven Blutspender zwar durch den Nachweis von spezifischen
Antikörpern erkannt, dass jedoch jede 444.000-ste Blutspende seronegativ war
und nur durch die PCR-Testung identifiziert und aussortiert werden konnte
(Zeitraum 1999-2007; > 40
Millionen HCV-PCR getestete Blutspenden, Nübling 2012 – personl. communication). Neuinfektionen in Industrieländern sind nun hauptsächlich durch i.v.
Drogenabusus („Needlesharing“) verursacht. Aber auch Piercing und Tätowierung
unter schlechten hygienischen Bedingungen können ein Risiko darstellen. Dagegen
sind die sexuelle Übertragung und die Mutter-Kind-Transmission mit einem
vergleichsweise geringen Infektionsrisiko behaftet. Entsprechend ist die
potenzielle Infektiosität verschiedener Körperflüssigkeiten durchaus
unterschiedlich; während im Blut chronisch HCV-infizierter Patienten bis zu 108
Viruspartikel/ml nachweisbar sind, finden sich weder im Speichel noch im Urin
nennenswerte Virusmengen (von Rheinbaben & Wolff, 2002).
Transmissionsrisiko Nadelstich
Da offensichtlich Nadeln bzw. Nadelstichverletzungen (NSV)
eines der Hauptübertragungsrisiken für HCV darstellen, ist medizinisches
Personal von Berufs wegen eine gefährdete Personengruppe. Zusätzlich können
weggeworfene Kanülen ein potenzielles Risiko darstellen. Eine HCV-Infektion
durch NSV ist seltener als die einer Hepatitis B, jedoch häufiger als die einer HIV-Übertragung (Berger et al., 2012), was primär
durch die unterschiedlich hohen Virusmengen im Blut bedingt ist (von Rheinbaben
& Wolff, 2002). Das mittlere HCV-Übertragungsrisiko durch eine NSV
beträgt ca. 0,3-1 % (Henderson
et al., 2010, Wicker & Rabenau, 2012, Sarrazin et al., 2010).
HCV-Infektiosität in Flüssigkeiten und auf getrockneten Oberflächen
HCV weist abhängig vom umgebenden Medium (flüssig oder angetrocknet) unterschiedliche Stabilitäten auf. In flüssigen Medien ist HCV bis zu 5 Monate (bei 4° C) stabil (Abb 1). Bei Flüssigkeiten hat zudem das Volumen einen signifikanten Einfluss darauf, wie lange das HC-Virus stabil ist. In kleinen Volumina (ca. 2 µl), wie sie z. B. in Insulinspritzen oder 22-er Kanülen auftreten, ist bei Lagerung bei Raumtemperatur (RT) nach einem Tag noch infektiöses Virus nachweisbar, nach 3 Tagen jedoch nicht mehr. Hingegen ist bei größeren Volumina (ca. 32 µl), wie sie in Tuberkulin-Spritzen vorhanden sind, auch nach über 60 Tagen noch Infektiosität nachweisbar (Paintsil et al., 2010). Auch in getrocknetem Zustand ist HCV relativ lange stabil. Bei Virus-haltigen Serumproben, die auf einer Metalloberfläche eingetrocknet waren, konnte auch nach 5 Tagen noch infektiöses Virus nachgewiesen werden (Doerrbecker et al., 2011).
Stabilität bei unterschiedlichen Temperaturen
Wie bereits erwähnt, wird die Stabilität von HCV auch durch die Umgebungstemperatur beeinflusst. Dabei gilt: je höher die Temperatur desto stärker sinkt die HCV-Infektiosität. Während bei einer Temperatur von 4° C auch nach ca. einer Woche die Infektionsfähigkeit des Virus in flüssigem Medium kaum abnimmt, reduziert sie sich bei RT etwa um Faktor 10, und bei 37° C bereits nach 2 Tagen um mehr als 99 % (Ciesek et al., 2010). Im Gegensatz dazu ist virale RNA - unabhängig von der Infektiosität - bei RT über fast 5 Wochen in nahezu konstanter Menge nachweisbar (Ciesek et al., 2010). Im Zusammenhang zu dem Problem der hohen Übertragungsrate durch intravenösen Drogengebrauch konnten Doerrbecker und Kollegen zeigen, dass bei einer Hitze-Einwirkzeit von ungefähr 95 Sekunden die Infektiosität von HCV auf einem Löffel erst ab einer Temperatur von 65°-70° C signifikant reduziert wird (Doerrbecker et al., 2011).
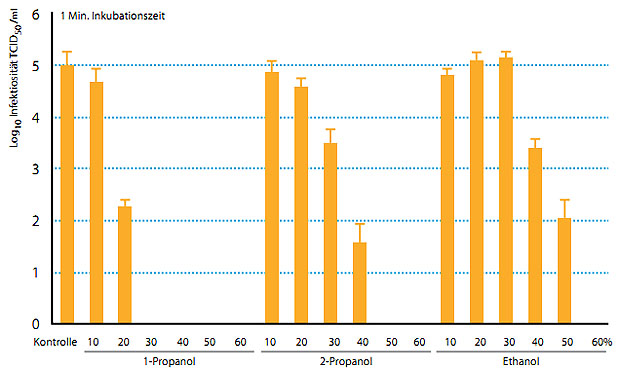
Abbildung 2: Effekt von verschiedenen Alkoholen auf HCV im sogenannten Carrier-Versuch mit einer Einwirkzeit von einer Minute (modifiziert nach Doerrbecker et al., 2011). TCID50: Tissue Culture Infection Dose 50 (quantitativer Wert für die Infektiosität)
Desinfektion
Als RNA-Virus mit einer Hülle mit hohem Lipidgehalt ist HCV sehr empfindlich gegenüber Lösungsmitteln. Desinfektionsmittelwirkstoffe mit Lipidlösungsvermögen sind z. B. Alkohole (u. a. Ethanol und Propanol), Aldehyde (z. B. Formaldehyd und Glutardialdehyd) sowie Iod- und Chlorverbindungen. Die Substanzen lösen die Lipidhülle auf und verhindern dadurch die Fähigkeit des Virus zur Absorption und Penetration in die Körperzelle (von Rheinbaben & Wolff, 2002). Säuren und Basen sind weniger effektiv, da das Virus eine hohe Stabilität zwischen pH 4 und 9 aufweist (Ciesek et al., 2010).
Im Vergleich der alkoholbasierten Antiseptika Ethanol, 2-Propanol und 1-Propanol erwies sich 1-Propanol am wirksamsten gegenüber dem HCV. In sogenannten Suspensionsversuchen, bei denen 1 Volumenteil Virus mit 9 Volumenteilen Desinfektionsmittel vermischt und nach einer definierten Einwirkzeit die Restinfektiosität ermittelt wird, reduzierte bereits eine 1-minütige Inkubation mit 20 %igem 1-Propanol die Infektiosität um mehr als 99,99 % (Ciesek et al., 2010), während 30 %- bzw. 40 %-iger Ethanol auch nach 5-minütiger Inkubation nur eine unvollständige Reduktion (ca. 99 % bzw. 99,9 %) bewirkte. Etwas andere Ergebnisse zeigen sich auf der Basis praxisrelevanter Testansätze – sogenannter Carrier-Versuche. Hierbei trocknet eine definierte Virusmenge auf einer Stahloberfläche, zu der anschließend für eine festgelegte Zeit Desinfektionsmittel zugesetzt wird. Nachfolgend wird das so behandelte Virus resuspendiert und die Menge an infektiösem Restvirus bestimmt. Diese Vorgehensweise spiegelt wesentlich besser die im Klinikalltag vorgefundenen Verhältnisse wieder, als der bereits erwähnte Suspensionsversuch. Mit 1-Propanol wurde die Menge an infektiösem HCV schon nach 1 Minute Inkubationszeit um mehr als 4 Log10-Stufen reduziert, während hierzu 2-Propanol bzw. Ethanol-Konzentrationen von 50 % bzw. 60 % erforderlich waren (Abbildung 2, Doerbecker et al., 2011).
Kommerzielle Desinfektionsmittel
Bei der viruswirksamen Desinfektion unterscheidet man grundsätzlich solche Desinfektionsmittel, die gegen behüllte Viren (wie z. B. HCV, HBV, HIV) wirksam sind (und damit eine sogenannte „begrenzte Viruzidie“ aufweisen) und solche, die zusätzlich auch gegen unbehüllte Viren (wie z. B. Rhinoviren und HAV) wirken (sogenannte „viruzid wirksame Desinfektionsmittel“). Hierfür kommen in kommerziell erhältlichen Desinfektionsmitteln unterschiedliche Substanzen zur Desinfektion zum Einsatz. Gegenüber HCV wiesen alle getesteten Produkte eine komplette HCV-Inaktivierung auf, sofern sie unverdünnt eingesetzt wurden. Eine Verdünnung von 1:10 bewirkte dagegen, dass nur noch drei von sieben Mitteln das HCV inaktivierten. Diese drei Mittel enthielten als Wirksubstanzen Povidon-Iod, Chlorhexidin-Digluconat bzw. Triclosan (Ciesek et al., 2010).
Literatur beim Verfasser





