Dr. Ramona Pauli, München
Neue Leitlinie Hepatitis B
Diagnostik
Neu bei der Diagnostik ist die Aufnahme der HBsAg-Quantifizierung. Eine Empfehlung zur routinemäßigen quantitativen Messung von HBsAg wurde nicht gegeben, sondern als möglicherweise „hilfreich“ bezeichnet.
Zum HCC-Screening werden wie bisher
regelmäßige Ultraschallkontrollen und
ggf. eine Bestimmung von Alpha-Fetoprotein (AFP) empfohlen, wobei das
Intervall bei sehr hohem Risiko von vorher 6-12 Monaten ggf. auf drei Monate
verkürzt werden kann.
Indikation
Im Hinblick auf die Indikation zur Therapie
wurde bereits 2007 die Bedeutung der HBV-Viruslast in den Vordergrund gestellt.
Allerdings ist Höhe der Viruslast bei Patienten ohne Fibrose/Zirrhose nicht
entscheidend. Erst wenn Entzündungszeichen vorliegen, ist die Indika-tion zur
Behandlung bei einer HBV-DNA von > 2000 IU/ml gegeben. Anders als in der
früheren Version, in der eine Erhöhung der Transaminasen um mindestens das
Zweifache gefordert wurde, reicht in den aktualisierten Leitlinien genauso wie
in den europäischen Leitlinien jede
wiederholt nachgewiesene Erhöhung aus (Abb. 1).
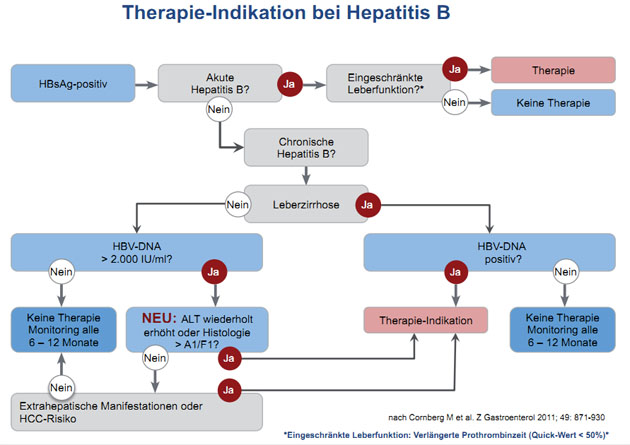
Abbildung 1:
Antivirale Medikamente
Bei der Auswahl von Nukleos(t)id-Analoga
sollte man das Stadium der Leber-erkrankung, Begleiterkrankungen, die Höhe der
HBV-Virämie und ggf. Vor-therapien berücksichtigen. Bei Zirrhose und/oder hoher
Viruslast (> 106 IU/ml)sollte primär eine Substanz mit hoher
Resistenzbarriere eingesetzt werden,
d.h. Entecavir oder Tenofovir. Eine Kombinationstherapie in dieser Situation
wird nicht mehr empfohlen. Adefovir gehört nicht mehr zu den Mitteln der ersten
Wahl.
Der Therapieerfolg sollte durch Messung der
HBV-DNA zunächst alle drei bis sechs Monate, bei nicht mehr nachweisbarer
HBV-DNA alle sechs Monate kontrolliert werden. Anders als früher wird ein
Add-on bei einer Viruslast über der Nachweisgrenze nach 12 Monaten Therapie
nicht mehr empfohlen. Vielmehr sollte man, insbesondere wenn die HBV-DNA
kontinuierlich abfällt, zuwarten und erst wenn sich kein weiterer Abfall zeigt,
die Medikation umstellen (Abb. 2).
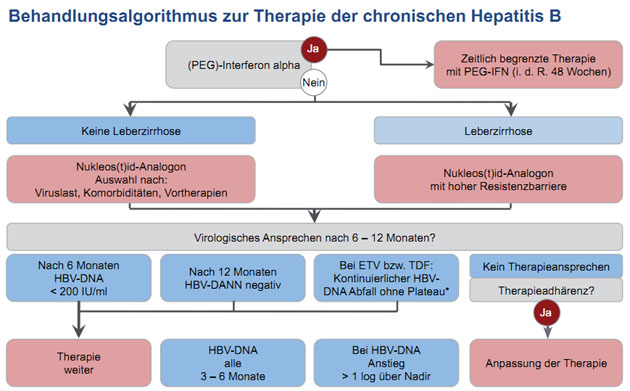
Abbildung 2:
Ein Switch bei unzureichendem Therapieerfolg wird empfohlen:
- von Nukleosid (Lamivudin, Entecavir, Telbivudin) auf Tenofovir
- von Adefovir auf Entecavir oder
Tenofovir - von Tenofovir auf Entecavir oder Add-on Nukleosid
Neu ist ebenfalls die Empfehlung, Serum-Kreatinin zur Abschätzung der glomerulären Filtrationsrate bei Therapiebeginn und dann alle sechs Monate zu kontrollieren.
Bei HBeAg-positiven Patienten sollte man nach
HBeAg-Serokonversion vor dem Absetzen der Medikation mindes-tens 12 Monate
(früher 6-12 Monate) weiterbehandeln (Abb. 3).
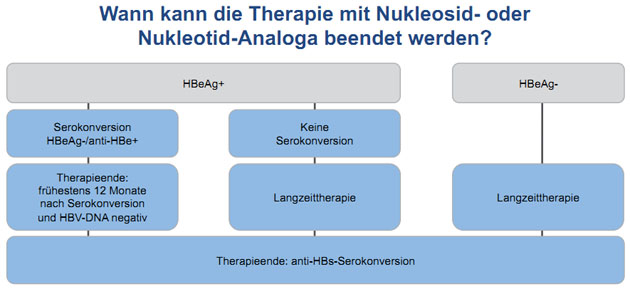
Abbildung 3:
Therapie in der Schwangerschaft
Grundsätzlich ist die Schwangerschaft keine
Kontraindikation für eine antivirale Therapie. Andererseits ist keines der
antiviralen Medikamente für die Therapie in der Schwangerschaft zugelassen.
Aufgrund der Daten großer Schwangerschaftsregister aus dem HIV-Bereich kann nun
eine Behandlung mit Lami-vudin oder Tenofovir in der Schwangerschaft
weitergeführt werden, eine Therapie mit Entecavir oder Adefovir sollte
umgestellt werden. Neu ist zudem die Empfehlung, bei Frauen mit hoher Vi-rämie
(HBV-DNA > 107 IU/ml) im letzten Trimenon eine antivirale Therapie mit einem
hochpotenten Medikament einzuleiten, um das Risiko der vertikalen Transmission
zu vermindern. Die Behandlung sollte mindestens sechs
Monate nach Entbindung fortgeführt werden.
Prävention der Reaktivierung
Bei jedem Patienten sollte vor einer immunsupprimierenden Therapie, z.B. mit Chemotherapeutika oder Biologicals, eine Hepatitis-B-Diagnostik durchgeführt werden. HBsAg-positive Patienten oder HBV-DNA-positive Patienten („Okkulte Hepatitis“) sollten präemptiv Nukeosid(t)en erhalten. Anti-HBc-positive Patienten mit negativem HBsAg sollten bei Stammzell- und Knochenmarkstransplantation sowie neuerdings auch bei Gabe von Rituximab präemptiv behandelt werden (Abb. 4).
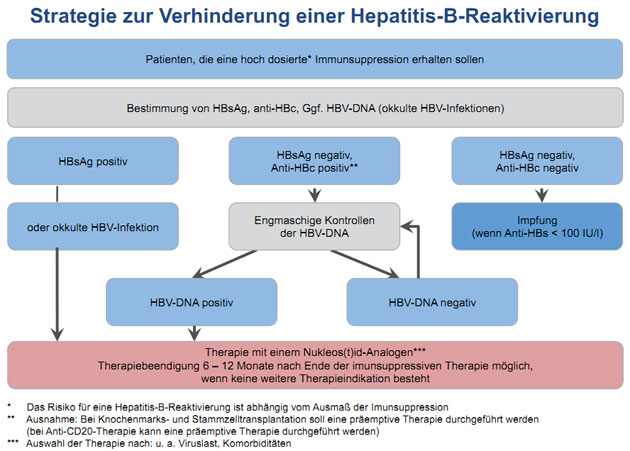
Abbildung 4:





