Holger Hinrichsen, Kiel
Nebenwirkungsmanagement bei HCV-Tripletherapie
Ein Prinzip des Nebenwirkungsmana-gements bei der konventionellen Therapie der Hepatitis C mit pegyliertem Interferon und Ribavirin allein ist die Reduktion der Dosis dieser Medikamente. Für beide Proteaseinhibitoren gilt dagegen das „Ganz oder gar Nicht“-Prinzip. Eine Dosisreduktion zur Beherrschung von Nebenwirkungen ist unter keinen Umstanden erlaubt, da ansonsten die große Gefahr besteht, Resistenzen hervorzurufen.
Vortherapie beachten
Boceprevir und Telaprevir haben ein unterschiedliches Nebenwirkungsprofil. Dies sollte man bereits bei der Auswahl des HCV-Proteasehemmers berücksichtigen. So sollte beispielsweise ein Patient mit Relapse nach antiviraler Therapie mit PEG-Interferon und Ribavirin, bei dem unter der Ersttherapie Ribavirin wegen ausgeprägter Anämie (< 8g/dl) reduziert werden musste, bei einer Re-Therapie eher mit Telaprevir als mit Boceprevir behandelt werden. Zudem werden beide Proteaseinhibitoren für eine unterschiedliche Therapiedauer angewendet. Telaprevir wird grundsätzlich nur für die ersten 12 Wochen der anti-viralen Therapie eingesetzt, Boceprevir hingegen mindestens 24 Wochen bei verkürzter Therapiedauer von 28 Wochen, was für ca. 55 % der behandelten Patienten zutrifft und für 32 Wochen (Fibrosestadium < 4) bzw. 44 Wochen bei Patienten mit Zirrhose.
Anämie
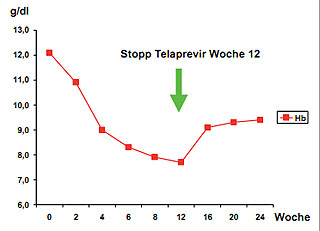
Abbildung 1: Beispielhafter Verlauf der Anämie unter antiviraler Therapie mit PEG-Interferon alfa-2a, Ribavirin und Telaprevir
Für beide Proteaseinhibitoren gilt, dass sie die durch Ribavirin-induzierte Anämie weiter verstärken. Bereits die duale Therapie mit Interferon und Ribavirin führt bei einigen Patienten zu einem starken Abfall des Hämoglobin (HB)-Wertes. Die zusätzliche Gabe des Pro-teaseinhibitors verstärkt diesen Effekt um ca. 1 g/dl. So wiesen 50 % der Patienten in der relevanten Zulassungsstudie (Sprint 2-Studie) von Boceprevir einen Hb-Abfall auf < 10g/dl auf, während dies nur bei 30 % in dem Behandlungsarm ohne Boceprevir beobachtet wurde (Poordad et al. NEJM 2011). Dabei war sogar die Gabe von Erythropoetin erlaubt und wurde bei 43 % im Behandlungsarm mit Boceprevir und bei 24 % im Placeboarm angewendet. Auch für Telaprevir wird eine Anämie häufig beobachtet. In der relevanten Zulassungsstudie bei unvorbehandelten Patienten (ADAVANCE-Studie) wiesen 45 % der Patienten, die mit Telaprevir behandelt wurden, einen Hb < 10 g/dl auf, während dies im Placeboarm bei 16 % beobachtet wurde (Jacobson et al. NEJM 21011). Hier ist jedoch erwähnenswert, dass ein HB-Abfall während der antiviralen Therapie in der Regel erst nach der 4. Therapiewoche eintritt und in der Regel nach 8 Wochen Behandlung sein Maximum erreicht. Telaprevir muss nur 12 Wochen verabreicht werden und die Telaprevir-assozierte Abnahme des HB-Wertes ist rasch nach Absetzen des Proteasehemmers reversibel, so dass der zusätzliche Effekt der Anämie nur für kurze Zeit der antiviralen Therapie relevant ist (Abb. 1). Bei Gabe von Boceprevir, welches für 24-44 Wochen mit der Interferon- und Ribaviringabe kombiniert werden muss, spielt die Anämie eine entsprechend größere Rolle.
Die Gabe von Erythropoetin zur Behandlung der
Anämie durch die antivirale Therapie ist in Deutschland nicht zugelassen und eine Dosisreduktion des
Proteaseinhibitors ist wegen der Resistenzgefahr nicht möglich. Es bleiben aktuell somit nur zwei Optionen, die Anämie zu beherrschen: Zum einen die Reduktion der Ribavirindosierung, zum
anderen die Gabe von Erythrozyten-konzentraten.
Die Bluttransfusion kommt nur in Einzelfällen
bei ausgeprägter Anämie und klinischer Symptomatik in Betracht, insbesondere
wenn eine rasche Anhebung des HB-Wertes notwendig ist. Für alle anderen Fälle
gilt, dass eine großzügige Dosisreduktion des Ribavirins bei der Tripletherapie
– anders als bei konven-tioneller Therapie – die Chance auf eine Ausheilung der
HCV-Infektion nicht mindert (Abb. 2 und 3) Bei Patienten, deren HB bereits nach
zwei Wochen Tripletherapie deutlich abgefallen ist,
sollte die Ribavirindosis gegebenenfalls frühzeitig reduziert werden.
Ein „Switch“ des Proteaseinhibitors ist in diesem Zusammenhang zum einen nicht untersucht, zum anderen auch nicht sinnvoll, da
beide Substanzen eine Anämie hervorrufen.
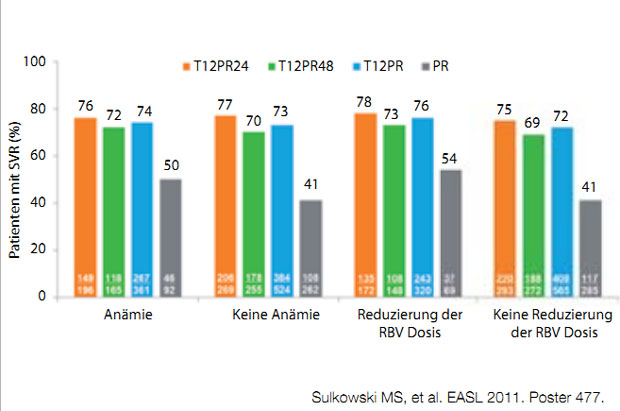
Abbildung 2: Einfluss der Ribavirindosisreduktion auf die SVR bei Telaprevir-basierter Tripletherapie.
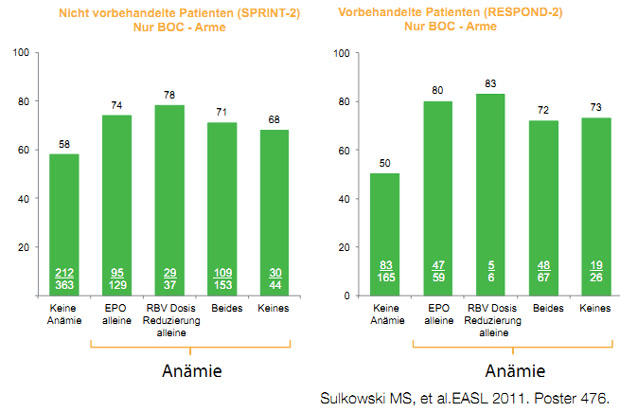
Abbildung 3: Einfluss der Ribavirindosisreduktion oder der EPO-Gabe auf die SVR bei Boceprevir-basierter Tripletherapie.
Hautreaktionen (RASH)
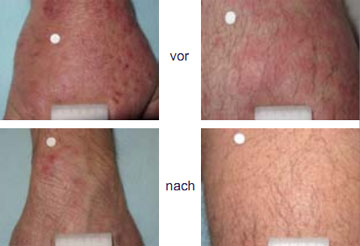
Abbildung 4: Hautreaktion bei einem Patienten 6 Wochen nach Beginn einer Tripletherapie mit Telaprevir.
Hautreaktionen als Nebenwirkung der Proteaseinhibitortherapie sind spezifisch für Telaprevir. Der Mechanismus ist bis heute noch nicht vollständig geklärt. Die Hautreaktion beginnt häufig nach 3-4 Wochen Telaprevirgabe mit einem generalisiertem Pruritus und wird von einem Exanthem gefolgt, welches nur wenige Hautareale betreffen kann oder aber über wenige Tage bis zu einem generalisiertem Exanthem mit oder ohne Schleimhautbeteiligung fortschreiten kann (Abb. 4).
Pruritus ist mit 45-50% eine der häufigsten Nebenwirkungen von Telaprevir. Bei quälendem Juckreiz können ggf Antihistaminika helfen. Hier sollte z. B. Cetirizin verordnet werden, während hingegen Desloratidin aufgrund seiner Interaktionen nicht verabreicht werden darf. Genaue Informationen sind jederzeit über die Website http://www.hep-druginteractions.org/ erhältlich. Ein Exanthem wurde in den Studien bei 37% der Patienten beobachtet.
Beim Auftreten eines Exanthems ist die Bestimmung der Qualität und des Ausmaßes der betroffenen Körperoberfläche entscheidend. Bei Blasenbildung und/oder Schleimhautbeteiligung ist Telaprevir sofort abzusetzen. Eine Ausbreitung des Exanthems > 50% der Körperoberfläche (entsprechend der bekannten Verbrennungsschemata) bedeutet ebenfalls ein schwerwiegendes Ereignis und die Behandlung mit Telaprevir muss sofort beendet werden. Schwere Verlaufsformen, die einen Abbruch der Behandlung erfordern, waren in den Studien jedoch mit < 5 % zum Glück selten.
Wichtig ist in diesem Zusammenhang die richtige Einschätzung des Ausmaßes des Exanthems, da aus klinischer Erfahrung diese von Hepatologen im Vergleich zu Dermatologen häufig eher überschätzt wird und somit eine potentiell erfolgreiche Therapie fälschlicherweise abgebrochen wird. Die erfolgreiche Behandlung der Hautreaktion hängt im Wesentlichen von der frühzeitigen Behandlung nach dem Auftreten des Ausschlags ab. Patienten sollten auf die Nebenwirkung hingewiesen werden und sich umgehend bei Auftreten eines Hautausschlags vorstellen. Bestätigt sich hierbei ein Exanthem sollte sofort eine topische Therapie mit hochpotenten Steroiden (z. B. Betametason 17 + Valerat 2g ad 200g oder Betnesol V Creme®) erfolgen und die Hautreaktion engmaschig überwacht werden. Der Einsatz von Antihistaminika hilft weniger beim Exanthem als in einigen Fällen zur Therapie des Pruritus. Systemische Steroide sind der hochpotenten topischen Therapie in der Regel nicht überlegen.
Eine Besonderheit stellt der anale Pruritus bei Telaprevir dar, der nicht als Hautreaktion zu werten ist, sondern durch Metabolite des Telaprevirs, die über den Stuhl ausgeschieden werden, hervorgerufen wird. In den klinischen Studien klagten >25% über „anales Unwohlsein“. Bei klinisch relevanter Symptomatik kann hier auch der lokale Einsatz von Xylocaingel (Xylocain 2% Gel®) erwogen werden (keine Kassenleistung!), oder ebenfalls der Einsatz o g. topischer Steroide gerechtfertigt sein.
Da Telaprevir insgesamt nur 12 Wochen verabreicht werden muss, sollte bei Auftreten eines RASH auch immer die noch verbleibende Therapiedauer mit Telaprevir berücksichtigt werden. In den Zulassungsstudien führte bereits eine achtwöchige Tripletherapie mit Telaprevir zu hohen Heilungsraten von 69% in der ADVANCE-Studie im Vergleich zu 75% im 12-wöchigen Tripletherapiearm.
Ein Switch von Telaprevir zu Boceprevir bei Auftreten eines RASH ist ebenfalls bisher nicht untersucht worden. Bei einem milden RASH Grad I oder II ist sicher noch kein Wechsel notwendig, bei schwerem RASH sollte die gesamte Therapie abgebrochen werden.
Nicht vergessen werden darf aber die Tatsache, dass auch unter Ribavirin/Interferongabe Hautveränderungen bei bis zu 25% der Patienten beobachtet werden.
Eine große Bedeutung hat die Prophylaxe von Hautveränderungen, d h. Meiden von Sonnenexposition bzw. Benutzung von Sonnencremes mit hohem Lichtschutzfaktor (>30) bzw. die prophylaktische Verabreichung von rückfettenden Cremes.
Unter Umständen kann auch bei dem RASH die Auswahl des Proteaseinhibitors aufgrund drohender Nebenwirkungen eine Rolle spielen. Zum Beispiel sollte bei einem Patienten mit klinisch relevanten Hautveränderungen unter antiviraler Therapie mit PEG-Interferon und Ribavirin bei einer Re-Therapie eher mit Boceprevir als mit Telaprevir behandelt werden, da erneut mit Hautveränderungen gerechnet werden muss, die schwer zwischen der Gabe von Ribavirin und Telaprevir unterschieden werden können.
Geschmacksstörung
Geschmacksstörungen, vor allem der Verlust, etwas zu schmecken, ist spezifisch für die Gabe von Boceprevir. In den klinischen Studien wurden Geschmacksstörungen bei 37-43% der Patienten beobachtet. Die Nebenwirkung tritt meist bereits früh in Erscheinung, kann in der Ausprägung schwanken und ist reversibel. Boceprevir muss mindestens für 24 Wochen verabreicht werden. Sollte diese Nebenwirkung während der ersten 4 Wochen der antiviralen Therapie auftreten und den Patienten/in sehr stören, ist ein Wechsel auf Telaprevir denkbar, wenn auch nicht in Studien untersucht. Nach bereits länger bestehender antiviraler Therapie (>12 Wochen) stellt dies keine Option mehr dar.
Übelkeit (Nausea)
| Boceprevir (SPRINT-2) | ||
|---|---|---|
| BOC RGT | SOC/PBO | |
| Schwere Nebenwirkungen | 11% | 9% |
| Abbruch wg Nebenwirkungen | 12% | 16% |
| Dosisreduktionen | 40% | 26% |
| Anämie <10g/dl | 49% | 29% |
| Gabe von Epo | 43% | 24% |
| Geschmacksstörung | 37% | 18% |
| Poordad et al. NEJM 2 011; 364: 1195-1206 | ||
| Telaprevir (ADVANCE) | ||
| TVR 12 | SOC/PBO | |
| Abbruch Protease-Inhibitor | 11% | 1% |
| Abbruch gesamte Therapie | 7% | 4% |
| Hautausschläge (Rash) | 37% | 24% |
| Anämie <10g/dl Kein Einsatz von Epo! | 45% | 16% |
| Jacobson et al. AASLD 201 0. Abstract 211 | ||
Tabelle 1: Vergleich der Nebenwirkungsprofile und ihrer Häufigkeit inden Zulassungsstudien mit Telaprevir und Boceprevir.
Die Gabe von Ribavirin führt häufig zu gastrointestinaler Unverträglichkeit mit führender Übelkeit. Diese kann durch beide Proteaseinhibitoren verstärkt werden. In Studien litten 43-48% der Patienten bei Boceprevir-Tripletherapie und 40-43% bei Telaprevir-Tripletherapie unter dieser Nebenwirkung. Die Gabe von Metoclopramid war bereits bei der Ribavirin-induzierten Nausea wenig wirksam. Der Einsatz von Protonenpumpeninhibitoren sollte hier großzügig erwogen werden. Bei Wirksamkeit stellt sich ein Erfolg bereits wenige Tage nach Beginn der PPI-Therapie ein. Interaktionen mit den Proteaseinhibitoren sind nicht klinisch relevant. Der Patient sollte jedoch unbedingt auf die Einnahme von Ribavirin nach Einnahme einer Mahlzeit hingewiesen werden, weil dies die häufigste Ursache der Übelkeit darstellt (Tab. 1).





