Kai-Henrik Peiffer und Christoph Sarrazin, Frankfurt
HCV-Resistenz unter Proteaseinhibitoren
In den letzten Jahren wurden zahlreiche neuartige Medikamente zur Therapie der Hepatitis C entwickelt, von denen die überwiegende Mehrzahl direkt im Vermehrungszyklus des Virus angreifen und deshalb auch direkt antivirale Agenzien (DAA) genannt werden. Zwei dieser Medikamente, die NS3-Proteaseinhibitoren Boceprevir und Telaprevir, stehen jetzt zur Verfügung. Allein gegeben selektionieren beide Medikamente trotz starkem Abfall der Viruslast innerhalb von wenigen Tagen im weiteren Verlauf rasch resistente Virusstämme.
Primäre Resistenz
HCV vermehrt sich rasch. Es entstehen rund 10 Millarden bis 1 Billion Viruspartikel pro Tag. Bei dieser hochfrequenten Replikation passieren Fehler, weshalb die Viruspopulation nicht identisch ist und gleichzeitig zahlreiche Varianten in einer Population koexistieren. Einige dieser Varianten können gegen HCV-Proteasehemmer resistent sein. Für den praktischen Einsatz der Tripletherapie stellt sich nun die Frage, ob das Vorkommen von resistenten Virusvarianten bei einem bestimmten Patienten das virologische Therapieansprechen vorhersagt und eine Resistenzuntersuchung vor Therapiebeginn sinnvoll wäre. In Phase-2-Studien mit Telaprevir wurden vor Beginn der Behandlung resistente Virusvarianten, die als dominantes Isolat (> 75 %) in der Viruspopulation vorkamen, nur bei 0,2-0,9 % der Patienten gefunden. Dieses seltene natürliche Vorkommen von dominanten resistenten Varianten gegenüber NS3-Proteaseinhibitoren wurde in weiteren Studien bestätigt. Zudem ist das virologische Ansprechen auf die Tripletherapie selbst bei Patienten mit dominanten resistenten Varianten nicht ausgeschlossen. In verschiedenen Studien konnte gezeigt werden, dass die HCV-Eradikation grundsätzlich möglich ist. Dagegen scheint in dem sehr seltenen Fall eines gleichzeitigen Vorkommens einer dominanten resistenten Variante plus fehlender Sensitivität gegenüber pegyliertem Interferon (pegIFN) und Ribavirin (RBV) ein dauerhaftes virologisches Ansprechen nicht möglich zu sein. Wegen der Seltenheit eines solchen Zusammentreffens ist eine Resistenzanalyse vor Beginn einer Behandlung mit einem Proteaseinhibitor aber nicht notwendig.
Sekundäre Resistenz
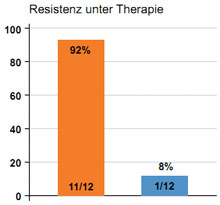
Abbildung 1: Bei Subtyp HCV 1a kommt es häufiger zur Resistenzentwicklung.
Unter der Tripletherapie mit den Proteaseinhibitoren Telaprevir oder Boceprevir in Kombination mit pegIFN und RBV kann es zur Resistenzentwicklung mit primärem Therapieversagen oder auch zum viralen Durchbruch kommen. Die Wahrscheinlichkeit einer Resistenzentwicklung steigt mit abnehmender antiviraler Aktivität der pegIFN/RBV-Therapie. Weitere Faktoren, die bei der Resistenzentwicklung eine wichtige Rolle spielen, sind die Potenz des direkt antiviralen Medikamentes sowie die Resistenzbarriere von Arzneimittel und Virus. So zeigt beispielsweise der HCV-Subtyp 1b eine höhere genetische Resistenzbarriere als der Subtyp 1a. In einer Phase-2 -Studie, in der Telaprevir zusammen mit PEG-IFN und Ribavirin als Tripletherapie gegeben wurde, waren von 12 Patienten, die einen viralen Durchbruch unter Therapie erlitten haben, 11 mit dem Subtyp 1a und nur einer mit dem Subtyp 1b infiziert. Nähere Analysen zeigten, dass die Hauptresistenzmutation durch die Veränderung einer Aminosäure an der Position 155 der NS3-Protease bedingt war (R155K), für die beim Subtyp 1a lediglich eine Nukleotid-Mutation, beim Subtyp 1b jedoch zwei Nukleotid-Mutationen notwendig waren (s. Abb.1). Auch unter Therapie mit Boceprevir konnte dieses Phänomen der häufigeren Resistenzentwicklungen beim HCV-Subtyp 1a beobachtet werden.
Resistenzbarriere
Die Proteaseinhibitoren Telaprevir und Boceprevir weisen eine niedrige genetische Resistenzbarriere auf. Unter Monotherapie mit Telaprevir und Boceprevir werden bereits nach wenigen Tagen resistente Virusstämme selektioniert gefolgt von einem viralen Durchbruch. Durch Sequenzierungsanalysen wurden bisher im Wesentlichen an sechs verschiedenen Nukleotidpositionen (V36, T54, V55, R155, A156, V170) Mutationen gefunden, die eindeutig mit einer Resistenz gegenüber den beiden Proteaseinhibitoren assoziiert waren. Diese Mutationen sind in der Nähe der Bindungsstelle des Inhibitors auf der HCV NS3-Protease lokalisiert und führen typischerweise zu einer verminderten Bindungsaffinität des Proteaseinhibitors und somit zu einem Wirkungsverlust, der bei einer niedrig resistenten Variante (V36, T54, V55, V170) geringer ausgeprägt ist als bei mittel- bis hochresistenten Varianten (R155, A156).
Virale Fitness
Als Nebeneffekt sind die resistenten Virusvarianten mit einer verminderten Replikationsfähigkeit des Virus assoziiert, so dass sie zwar zu einem „Überleben“ des Virus führen, sich aber nur auf sehr niedrigem Niveau vermehren können. Wird die Therapie nicht abgebrochen, sondern weitergeführt, können kompensatorische Mutationen dazukommen, die die Aktivität der Protease wieder erhöhen und damit eine höhere Replikationsfähigkeit generieren. Die Einhaltung von Stoppregeln ist daher bei der Tripletherapie von wesentlicher Bedeutung. Nur der Abbruch der Therapie verhindert bei nicht vollständigem virologischen Ansprechen die Selektion von kompensatorischen Mutationen und vermindert das Risiko einer möglichen Langzeitpersistenz der resistenten Varianten.
Einen nicht zu unterschätzenden Einfluss auf die Entwicklung einer Resistenz hat schließlich auch die Patientencompliance. Ein konstant und ausreichend hoher Medikamentenspiegel ist für die antivirale Wirkung entscheidend. Die Tabletten müssen daher regelmäßig und zum richtigen Zeitpunkt eingenommen werden. Die Dosis des Proteaseinhibitors darf in keinem Fall reduziert werden. Besondere Aufmerksamkeit sollte man auch der Begleitmedikation schenken. Viele Arzneimittel interagieren mit den Proteaseinhibitoren und können deren oder ihren eigenen Spiegel zum Teil drastisch verändern.
Häufigkeit
Insgesamt kommt es bei der Erstbehandlung mit Boceprevir oder Telaprevir im Rahmen einer Tripletherapie bei 8-9 % der Fälle zu einem primären Therapieversagen in Assoziation mit Resistenzentwicklungen. Bei vortherapierten Patienten nimmt die Wahrscheinlichkeit eines Therapieversagens in Abhängigkeit des virologischen Ansprechens auf die Ersttherapie zu. Bei Relapsern, partiellen Non-Respondern und Null-Respondern fand sich z.B. in 1 %, 18 % und 57 % ein primäres Therapieversagen unter einer Tripletherapie mit Telaprevir. Aufgrund der kompletten Kreuzresistenz zwischen Telaprevir und Boceprevir ist im Falle eines virologischen Therapieversagens ein Wechsel zwischen den Substanzen nicht möglich (Abbildung 2).
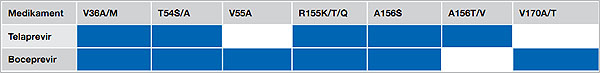
Abbildung 2: Kreuzresistenzprofil von Telaprevir und Boceprevir
Resistenz nach Therapieende?
Nach einer Monotherapie mit Telaprevir oder Boceprevir wurde ein Rückgang der resistenten Varianten bei entsprechender Zunahme von Wildtyp-Virus beobachtet. In Langzeituntersuchungen von vier bis fünf Jahren nach einer solchen Monotherapie konnten selbst mit hochsensitiven Sequenzierungsassays bei der überwiegenden Mehrzahl der Patienten keine resistenten Virusvarianten mehr nachgewiesen werden (Abbildung 3).
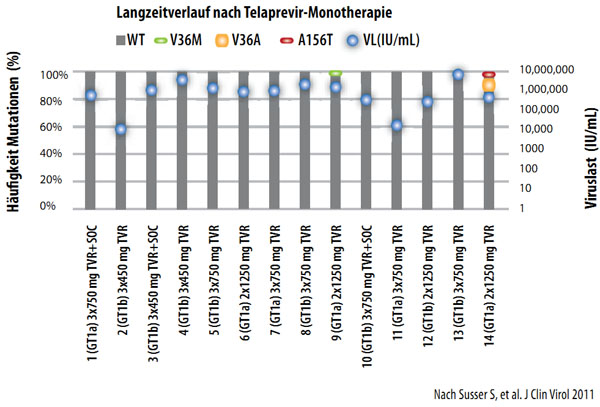
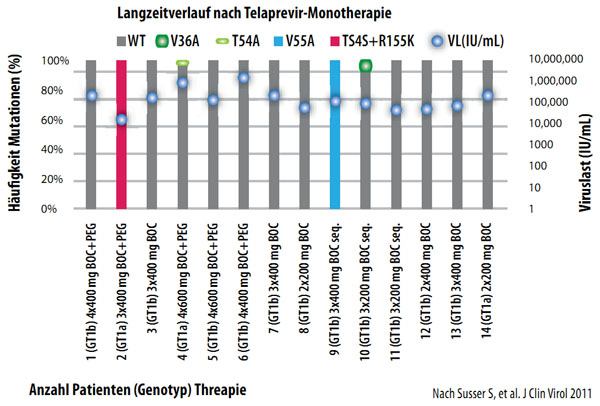
Abbildung 3: Langzeitverlauf 4,5 Jahre nach Telaprevir- bzw.Boceprevirtherapie BOC in Phase I (n=28)
Auch nach einem virologischen Versagen der Tripletherapie, bei dem grundsätzlich von einer Selektion resistenter Virusvarianten auszugehen ist, kommt es im weiteren Verlauf zu einer Abnahme von resistenten Varianten in der HCV-Population. Durchschnittlich zwei Jahre nach Ende einer Tripletherapie mit Boceprevir bzw. Telaprevir fanden sich bei 41 % bzw. 11 % der Patienten noch resistente Virusvarianten. Dabei scheint die Halbwertszeit der resistenten Varianten bei HCV-Subtyp 1b mit durchschnittlich 0,8 Monaten kürzer zu sein als bei Subtyp 1a mit 10 Monaten. Allerdings wurden hier bisher nur populationsbasierte Sequenz-untersuchungen durchgeführt, die residuale Häufigkeiten (< 25 %) nicht erfassen.
Re-Therapie
Die Bedeutung von einstmals selektionierten Resistenzen kann letztlich nur durch eine Re-Therapie mit der gleichen direkt antiviralen Substanz bzw. der gleichen Substanzklasse abschließend geklärt werden. Hierzu liegen bisher nur vorläufige Daten zu einer Kurzzeitexposition vor, bei der es nicht regelmäßig zu einer sofortigen Re-Selektion der Resistenzen kommt.
In einer ersten Studie zur Re-Therapie mit Telaprevir (Roll-over Protokoll C219) erhielten neun Patienten aus einer Phase-1-Studie, die unter Tripletherapie mit Telaprevir keine SVR erreicht hatten, erneut eine Telaprevir-Tripletherapie. Bei 8/9 Patienten waren nach der ersten Behandlung Resistenzmutationen nachweisbar. Beim erneuten Therapiebeginn, im Schnitt 5,7 Jahre nach der ersten Tela-previr-Exposition, waren die Resistenzmutationen verschwunden. Die Ergebnisse zu Woche 8 wurden kürzlich auf dem 62. AASLD vorgestellt. Bei 6/9 der früheren Telaprevir-Versager war keine HCV-RNA mehr nachweisbar. Bei 2/3 Patienten war die HCV-RNA < 25 IU/ml, aber positiv und bei 1/3 Patienten war es zum Rebound mit 885 IU/ml gekommen.
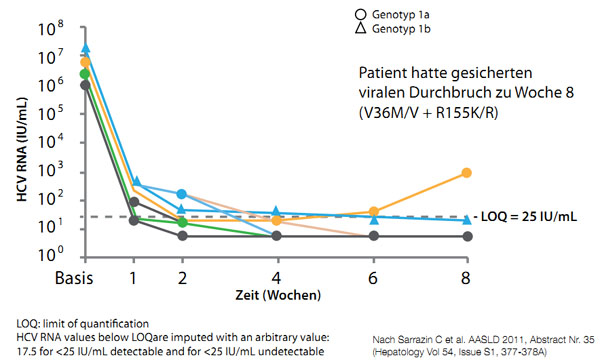
Abbildung 4: C219: Verlauf der HCV-RNA in den ersten acht Wochen einer Re-Tripletherapie mit Telaprevir.
Fazit
Ein Resistenztest vor Therapiebeginn ist nicht indiziert, da es nur beim Zusammentreffen einer relevanten primären Resistenz und einer verminderter Empfindlichkeit auf PegIFN/RBV zum primären Therapieversagen kommt. Die Wahrscheinlichkeit einer Resistenzentwicklung unter Tripletherapie ist abhängig von der antiviralen Potenz und Resistenzbarriere des Medikamentes, von Resistenzbarriere und Subtyp des Virus, der individuellen Sensitivität gegenüber der Interferontherapie sowie von Patientencompliance und Arzneimittelinteraktionen, welche den Medikamentenspiegel beeinflussen. Kommt es unter Tripletherapie zum Durchbruch oder unzureichenden Therapieansprechen, muss die Therapie abgebrochen werden. Andernfalls kann es zu kompensatorischen Mutationen kommen, die die Fitness des selektierten resistenten Virus steigern. Nach Therapieabbruch kommt es den bisherigen Erkenntnissen zufolge im Lauf von ein bis zwei Jahren zur Reversion zum Wildtyp-Virus.





