 The International Liver
Congress 2010 – 14.-18. April 2010, Wien
The International Liver
Congress 2010 – 14.-18. April 2010, Wien
Die Pipeline ist übervoll
Vulkanwolke über Wien

Der EASL 2010 wird vielen der 7.600 Teilnehmer aus aller Welt in Erinnerung bleiben. Zunächst wurde der Kongress
kurzfristig wegen zu kleiner Räumlichkeiten von Nizza nach Wien verlegt. Das war für die meisten kein Problem, abgesehen
vielleicht von einigen französischen Akteuren. Schwierig gestaltete sich jedoch für nahezu alle die Heimreise. Bereits
zwei Tage vor Ende der Tagung wurde der Wiener Flughafen wegen der Aschewolke des Vulkanausbruchs in Island geschlossen.
Und er blieb auch geschlossen, viele Tage über den Kongress hinaus. Zudem fand am letzten Kongresstag noch der Wiener Stadtmarathon statt, der den Nahverkehr in der Innenstadt lahmlegte. Die am häufigsten gestellte Frage auf dem EASL 2010 war daher: „Und wie kommen Sie nach Hause?“ Teilnehmer aus den Nachbarländern wie Deutschland und Italien hatten zumindest die Chance, in überfüllten Zügen oder Bussen nach Hause zu kommen. Die Teilnehmer aus Übersee mussten dagegen teils große Umwege in Kauf nahmen und erreichten ihre Heimat erst viele Tage später als geplant.
Der International Liver Congress ist im Aufwind. Es wurden 10% mehr Arbeiten eingesandt als letztes Jahr. Von den 2.377 eingereichten Abstracts wurde rund die Hälfte angenommen und 128 davon in Symposien mündlich präsentiert. Von den 74 eingeschickten Late Breakern wurden 24 vorgestellt. Besonders groß war die Zahl der Arbeiten zum Thema IL28B. „Wir waren überwältigt und haben deshalb eine eigene Poster-Session zu IL28B eingerichtet“, erklärte Heiner Wedemeyer, der Sekretär der Gesellschaft. Er, seit letztem Jahr Sekretär der EASL, stellte gleich weitere Neuerungen vor, u.a. den Umzug der Geschäftsstelle nach Genf, das neue Layout des Journal of Hepatology, den neuen Webauftritt usw. Eine weitere interessante Neuerung auf dem Kongress war die Möglichkeit, Fragen an die Referenten per SMS zu stellen. Der Chairman gab einige davon gleich weiter, die anderen sollte der Referent dann nach dem Kongress aufarbeiten. Inhaltlich bot die Tagung keine Sensationen. Es gab eine Flut von Arbeiten zu neuen Substanzen gegen Hepatitis C, die meisten davon sind allerdings in frühen Phasen der Entwicklung. Gegen Hepatitis B gibt es momentan keine Neuentwicklung.
Therapiedauer individualisieren!
Der Trend zur Individualisierung der Therapiedauer geht weiter. „Dadurch kann man die SVR-Rate steigern und
Nebenwirkungen vermeiden“, meinte Prof. Christoph Sarrazin, Frankfurt, der die Studie INDIV-2 vorstellte. In dieser
Studie wurden 600 therapienaive Patienten mit Genotyp 1 je nach RVR und HCV-RNA bei Therapiebeginn zwischen 24 und 72
Wochen lang behandelt. Die Therapiedauer wurde verkürzt/verlängert je nachdem, wann eine negative HCV-RNA erreicht wurde
(Abb. 1).
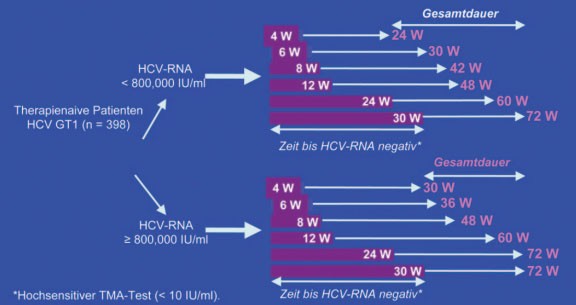
Abb. 1: INDIV-2: Individuelle Therapiedauer je nachdem in welcher
Woche HCV-RNA negativ wurde
Nur 14% der Patienten wurden wie bisher üblich 48 Wochen lang behandelt. Rund ein Drittel der Patienten wurde kürzer (24-42 Wochen), ein weiteres Drittel länger (60-72 Wochen) behandelt. Bei der Auswertung der Ergebnisse dienten historische Kontrollen aus der INDIV-1-Studie als Vergleichsgruppe. Die SVR-Raten in beiden Gruppen, d.h. mit und ohne individualisierte Therapiedauer, waren gleich (48% vs. 53%). Von der Therapieverlängerung profitierten zudem insbesondere die Patienten mit langsamem Ansprechen, und zwar bei hoher und niedriger Ausgangsviruslast (Abb. 2 und 3) (#54 Sarrazin C et al.).
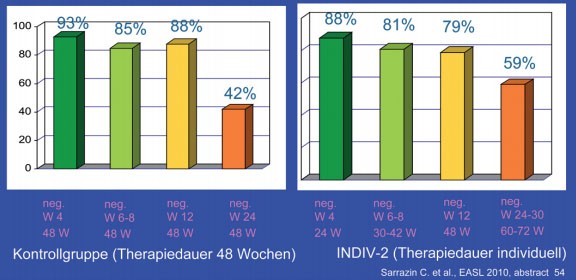
Abb. 2: INDIV-2: Patienten mit niedriger
Viruslast bei Therapiebeginn (<800.000 IU/ml). SVR-Raten INDIV-2 vs. Kontrollen
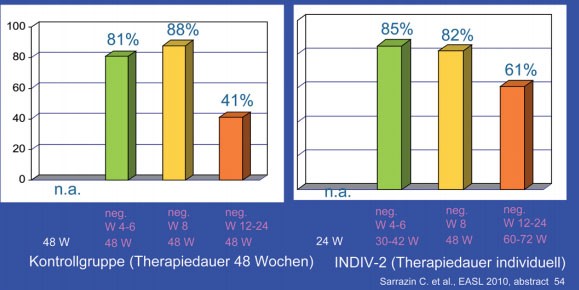
Abb. 3: INDIV-2: Patienten mit hoher Viruslast
bei Therapiebeginn (≥800.000 IU/ml). SVR-Raten INDIV-2 vs. Kontrollen
Prädiktor Metabolisches Syndrom
Die Insulinresistenz ist ein negativer Prädiktor für das Ansprechen der HCV-Therapie. Doch die Insulinresistenz selbst scheint auch ursächlich mit HCV Genotyp 1 assoziiert zu sein. In einer Auswertung der Patienten der ACHIEVE-Studien ohne Diabetes (n=1.038) war der HOMA-IR als Marker der Insulinresistenz bei Genotyp 1 höher als bei Genotyp 2/3. Bei Genotyp 1 war zudem in der Gruppe mit SVR die Häufigkeit von Insulinresistenz und HOMA-IR rückläufig, nicht jedoch bei Genotyp 2/3 (#53 Thompson A et al.).
Neben der Insulinresistenz gilt auch die Adipositas als negativer Prädiktor. Das Übergewicht verliert jedoch im „Gesamtpaket“ des metabolischen Syndroms an Bedeutung. In der IDEAL-Studie (n=3.070) hatten rund ein Drittel der Patienten ein metabolisches Syndrom. Diese erreichten seltener eine SVR (35% vs. 42%), in allen Untergruppen, wobei die Differenz bei Frauen stärker ausgeprägt war (Abb. 4). Aufgeschlüsselt nach den einzelnen Komponenten des metabolischen Syndroms erwiesen sich insbesondere erhöhter Nüchternblutzucker, Bluthochdruck und hohe Triglyceride als starker negativer Prädiktor. Ein niedriges HDL-Cholesterin war dagegen ein starker positiver Prädiktor. Die Adipositas hatte im Vergleich zu diesen Parametern einen deutlich geringeren Stellenwert (#304 Sulkowski MS et al.).
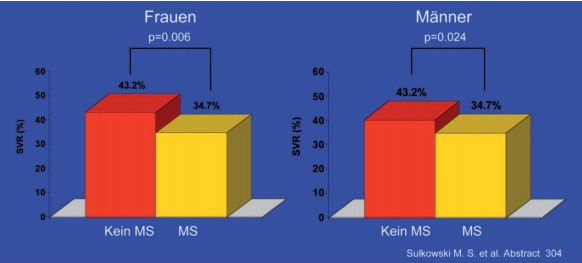
Abb. 4: IDEAL-Studie. SVR in Abhängigkeit von Metabolischem
Syndrom (MS) und Geschlecht
IL28B-Kontroverse
Ein Polymorphismus am IL28B-Gen hat großen Einfluss auf den Ausgang einer HCV-Therapie mit pegIFN/RBV. Dieses Ergebnis, das auf eine Analyse der IDEAL-Studie zurückgeht, wurde Ende letzten Jahres publiziert. Der günstige Effekt des CC-Genotyps bei HCV 1 wurde mittlerweile von vielen Arbeitsgruppen bestätigt. Beim HCV-Genotyp 2/3 scheint das Gen ebenfalls Einfluss zu nehmen, es spielt allerdings eine deutlich geringere Rolle. In einer Untersuchung an 217 Weißen mit GT 2/3 war die CC-Konstellation insbesondere beim Genotyp 3 signifikant häufiger mit einer RVR assoziiert (60% vs. 45%), wobei aber die RVR der stärkste Prädiktor für eine SVR war, unabhängig vom Genotyp (#126 Mangia A et al.). Zur Rolle der IL28B-Ausprägung bei der Therapie mit direkt antiviralen Substanzen gab es leider noch keine Auswertung.
Auf welche Weise die genetische IL28B-Konstellation das Therapieansprechen beeinflusst, wurde auf dem Kongress kontrovers diskutiert. Die Arbeitsgruppe um John McHutchinson von der Duke Universität in Durham untersuchte die Genexpression im Lebergewebe von 61 Patienten mit chronischer Hepatitis C (90% Genotyp 1, 60% Weiße, 20% Schwarze, 67% Männer). Dabei zeigte sich, dass der CC-Genotyp für IL28B mit einer deutlichen Verminderung von intrahepatischen Interferon-stimulierenden Genen (ISGs) einhergeht und dies wiederum mit einer geringeren SVR-Rate nach pegInterferon/Ribavirin korreliert. Das Ergebnis unterstützt die Vorstellung, dass bei Patienten mit TT-Genotyp die Interferon-Produktion schon maximal hochreguliert ist und die zusätzliche Gabe von Interferon deshalb kaum noch Wirkung hat (#3 Thompson A et al.). Dem steht eine Studie der Arbeitsgruppe um Markus Heim aus Basel gegenüber. Heim und Mitarbeiter fanden bei der Untersuchung von 93 Patienten, dass der IL28B-Polymorphismus und die ISG-Expression voneinander unabhängige Prädiktoren für das Therapieansprechen sind. Sie postulieren, dass es keine Verbindung zwischen einer veränderten Aktivierung des endogenen Interferon-Systems in der Leber und einem Therapieerfolg gibt. Drei ISG-Marker (IFI27, RSAD2, HTATIP2) zusammen hatten in ihrer Berechnung einen deutlich höheren prädiktiven Wert als der IL28B-Genotyp (#1187 Dill TM et al).
Telaprevir bei Therapieversagern
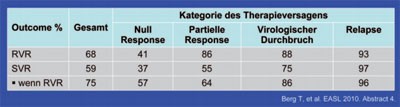
Tab. 1: Telaprevir bei Therapieversagern unter pegIFN/RBV
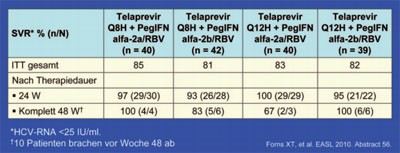
Tab. 2:
C208: Telaprevir + PegIFN/RBV
Zu Telaprevir wurden einige finale Auswertungen bekannter Phase-2-Studien präsentiert. In der Studie 107 wurden Therapieversager auf Standardtherapie der Studien PROVE 1, 2 und 3 eingeschlossen. Von den insgesamt 117 Patienten waren 51 Nullresponder (<1 log Abfall zu Woche 4 bzw. <2 log Anfall zu Woche 12). 29 Patienten hatten partiell angesprochen (nachweisbare HCV-RNA zu Woche 24), acht einen viralen Durchbruch (HCV-RNA nachweisbar nach Negativität) und 29 einen Relapse nach Therapieende. Die Patienten erhielten 12 Wochen Tripletherapie und dann je nach Ansprechen 24 bzw. 48 Wochen Standardtherapie. Mehr als die Hälfte der Studienteilnehmer (59%) erreichten eine SVR. Das rasche Ansprechen (RVR) war ein zuverlässiger Prädiktor und Patienten, die langsamer auf die Tripletherapie ansprachen, profitierten deutlich von der Therapieverlängerung (Tab. 1). Zum viralen Durchbruch kam es in beiden Gruppen gleich häufig (4 vs. 5 Patienten). Im Hinblick auf die Verträglichkeit gab es keine Überraschungen. Die häufigste Nebenwirkung war Hautausschlag. Fast jeder zweite Patient entwickelte ein Exanthem, aber nur 5 Patienten mussten die Therapie deswegen abbrechen. Weitere Gründe für einen Abbruch waren Juckreiz (n=2), Anämie (n=2) und Fieber (n=2). Die Abbruchrate wegen Nebenwirkungen betrug insgesamt 9% (#4 Berg T et al.).
Therapieverlängerung bei Telaprevir
Die Studie C208 beantwortet gleich mehrere Fragen. Zum einen erwiesen sich Telaprevir 750 mg dreimal täglich und 1.125 mg zweimal täglich sowie die Kombination von Telaprevir mit pegIFN alfa-2a und -2b als gleich wirksam. Bei der dritten Frage ging es um die optimale Therapiedauer. Hier zeigte sich, dass 12 Wochen Dreifachkombination und 12 Wochen pegIFN/RBV ausreichen, wenn die HCV-RNA zu Woche 24 negativ ist. Von den 68% der Patienten, die in C208 dieses Ziel erreichten, hatten insgesamt 96% eine SVR. Patienten, deren HCV-RNA zu Woche 24 noch positiv (<1.000 IU/ml) war, brauchen eine längere Therapiedauer von insgesamt 48 Wochen. 18% der Studienteilnehmer mussten so behandelt werden und insgesamt 79% von ihnen erreichten eine EVR (Tab. 2). Die Abbruchrate wegen Nebenwirkungen lag in C208 bei 8% (#56 Forns X et al.).
Telaprevir bei HCV GT 2 und 3
In der Studie C209 an 49 therapienaiven Patienten hatte Telaprevir bei Genotyp 2 einen günstigen, bei Genotyp 3 keinen Effekt. Die SVR-Rate bei Genotyp 2, der ohnehin gut zu behandeln ist, ließ sich allerdings nicht wesentlich steigern, so dass der Proteasehemmer bei diesem Genotyp vermutlich keine große Rolle spielen wird. Interessanter Nebenaspekt dieser Untersuchung ist aber die Resistenzanalyse. Alle Patienten erhielten initial eine 14-tägige Telaprevir-Monotherapie. Die entstehenden Mutationen waren bei allen drei Genotypen 1, 2 und drei vergleichbar (#57 Foster GR et al.).
Problem Resistenz
Die neuen direkt antiviral wirksamen Substanzen bergen die Gefahr einer Resistenzentwicklung. Das Hepatitis C-Virus als RNA-Virus vermehrt sich schnell und „ungenau“, d.h. es entstehen Mutationen, die von Medikamenten selektiert werden. Die bisher bekannten Proteasehemmer haben eine geringe Resistenzbarriere. Bei Monotherapie kommt es innerhalb von wenigen Tagen zur Resistenz. Eine Mutation im aktiven Zentrum der Protease reicht aus, um eine moderate bis ausgeprägte Resistenz hervorzurufen, die zur Kreuzresistenz innerhalb der Klasse führt. Die gleichzeitige Gabe von pegyliertem Interferon und Ribavirin reduziert das Risiko der Resistenzentwicklung deutlich. Dennoch wurden in den klinischen Studien PROVE 1 und 2 bei 3-7% der therapienaiven Patienten ein virologischer Durchbruch beobachtet. Die resistenten Varianten können Monate bis Jahre persistieren – und damit möglicherweise weitergegeben werden. Die Langzeitbeobachtung von Patienten aus den Boceprevir-Studien SPRINT-1, PO3659 sowie PO4887 zeigte Unterschiede in der viralen Fitness der resistenten Stämme. Bei der Mutation V36M kam es rascher zur Reversion zum Wildtyp-Virus als bei den Mutationen T54S und R155K, was für eine bessere Fitness der beiden letzter Varianten spricht (#2016 Vierling JM et al.).
Es gibt viele Überlegungen, wie man die Resistenzentwicklungen verhindern könnte.
Eine Möglichkeit ist eine Lead-in Phase mit Interferon/Ribavirin. Theoretisch könnten auch hochpotente Substanzen, die die HCV-RNA stark und lang anhaltend senken, die Wahrscheinlichkeit der Resistenzentwicklung senken. Unter der Substanz BMS-790052 beispielsweise, die nach Einmalgabe die HCV-RNA eine Woche lang supprimierte, wurden jedenfalls bislang keine Resistenz beobachtet.
Die Nukleosid(t)e in der Entwicklung sind im Gegensatz zu den Proteasehemmern hochwirksam gegen alle Genotypen und haben eine hohe Resistenzbarriere. Obwohl in vitro eine Insertion zur Vermittlung der Resistenz ausreicht, wurde in klinischen Studien bei Monotherapie über 15 Tagen unter R7128 keine Resistenz beobachtet. Dagegen haben die Nicht-Nukleosidischen Reverse Transkriptasehemmer, die nur gegen Genotyp 1b gut wirken, eine geringe Resistenzbarriere. Die Mutationen, die auch als Polymorphismen vorkommen, führen zudem zur Kreuzresistenz innerhalb der Klasse und können über Jahre persistieren.
Neue Substanzen gegen HCV
Die Anzahl der direkt antiviralen Substanzen gegen HCV ist kaum noch zu überschauen. Die meisten sind in einer frühen Phase der Entwicklung, einige davon wurden auch bereits wieder eingestellt. Der folgende Überblick erhebt daher keinen Anspruch auf Vollständigkeit.
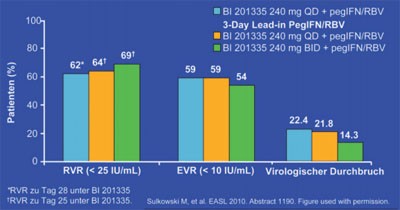
Abb. 5: SILEN-C2: RVR and EVR unter BI 201335 + pegIFV/RBV bei HCV
GT1 Nonrespondern
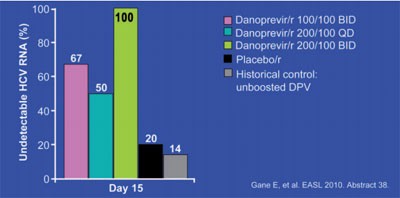
Abb. 6: Danoprevir/Ritonavir plus pegIFN/RBV bei therapienaiven
Patienten mit HCV GT1
Zum neuen Proteasehemmer BI201355 wurde eine Zwischenauswertung der Phase-2-Studie SILEN-C2 an 280 Nonresponder mit
Genotyp 1 vorgestellt. Die Patienten erhalten 24 Wochen eine Tripletherapie (unterschiedliche Dosierungen von BI201355)
und dann weitere 24 Wochen pegIFN/RBV. Nach 4 Wochen hatten 62-69% der Patienten eine RVR (HCV-RNA <25 IU/ml) und
nach 12 Wochen hatten 54-59% der Patienten eine EVR (HCV-RNA <10 IU/ml) erreicht (Abb. 5). Zum viralen Durchbruch kam
es bei 14-22% der Teilnehmer, bei mehr als der Hälfte davon in den ersten vier Wochen. Häufigste Nebenwirkungen waren
ein Ikterus aufgrund des Anstiegs des isolierten unkonjungierten Bilirubins, Hautausschläge sowie eine erhöhte
Photosensitivität. Die Nebenwirkungen scheinen stark dosisabhängig zu sein, denn in der Gruppe mit 240 mg BI201355 OD
brachen nur 4%, unter der doppelten Dosis 24% die Behandlung wegen der unerwünschten Wirkungen ab (#1190 Sulkowski M et
al.).
Die Substanz BMS-790052 ist ein hochpotenter NS5A-Inhibitor. In der vorgestellten kleinen Phase-2-Studie erreichten unter Tripletherapie 92% der Patienten eine RVR und 83% eine cEVR. Spezifische Nebenwirkungen sind nicht beschrieben (#1189 Pol S et al., #LB12 Nettles R et al.).
Danoprevir (früher RG7227 und ITMN-191) ist ein NS3/4A-Proteasehemmer, der mit 100 mg Ritonavir geboostert wird. In einer Phase-1b-Studie an 30 Patienten mit GT1 senkte die Substanz die HCV-TNA nach 15tägiger Gabe in Kombination mit IFN/RBV um maximal -5,3 log (Placebo -2,7 log). In einer Dosierung von 200/100 mg BID senkte Danoprevir/r die HCV-RNA bei allen Patienten unter die Nachweisgrenze (Abb. 6). Zu den Nebenwirkungen scheinen auch Exantheme zu gehören (#38 Gane E et al., #753 Haznedar JO et al.).
Die Entwicklung des Capsase-Inhibitor GS 9450, zu dem drei erste günstige Arbeiten präsentiert wurden, wurde laut einer Pressemitteilung des Unternehmen Gilead wegen „signifikanten Laborabweichungen und Nebenwirkungen“ eingestellt. Um welche es sich dabei handelte, wurde nicht erwähnt (#273 Manns MP et al., #745 Cornpropst MT et al., #84 Ratziu V et al., Pressemitteilung Gilead 19. April 2010).
VX-222 ist ein Nicht-Nukleosidischer Inhibitor der HCV NS5B-Polymerase. Drei Tage Monotherapie führten zu einer Reduktion der HCV-RNA >3 log. Nebenwirkungen waren leichte Diarrhoen bei rund 50% der Patienten (#31 Rodriguez-Torres et al.).
Der Polymerasehemmer RG128 war in einer kleinen Pilotstudie an Therapieversagern (n=25) sowohl bei Genotyp 2 als auch bei 3 wirksam (#37 Gane EJ et al.). Vorgestellt wurde ferner der erste Proteaseinhibitor, der auch gegen bisher bekannte resistente Stämme wirkt (#39 Carroll S et al.).
Neue Interferone
Neben Albinterferon alfa-2b, einer Kombination als Albumin und pegyliertem Interferon alfa-2b, wird der auch ein „verzögertes“ pegyliertes Interferon alpha-2b entwickelt. Dieses „controlled-release recombinant interferon“ (CRR) muss wie Albinterferon nur einmal alle zwei Wochen gespritzt werden. Es wurde in einer ersten Studie in Bulgarien und Rumänien an 74 Patienten geprüft und hatte eine mit peg IFN alpha-2b (1,5 µg/kg) vergleichbare Wirkung (#58 Krastev Z et al.).
Therapeutische Vakzine
Die therapeutische Vakzine GI-5005 erhöhte die SVR-Raten in Phase-2-Studien bei Therapienaiven und Nonrespondern mit HCV GT1 im Vergleich zu Standardtherapie um rund 10%. Von der adjuvanten Gabe nach einer intensiveren Initialtherapie einmal alle vier Wochen profitierten alle Patienten unabhängig von IL28B, der Effekt schien jedoch bei Patienten mit ungünstigem Genotyp am größten zu sein (#2006 Jacobsen IM et al., #277 McHutchinson JG et al., #181 McHutchinson JG et al.).
Nitaxozanid bei HCV-Genotyp 1
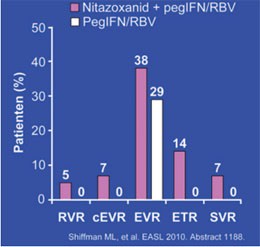
Abb. 7: STEALTH C-2: Virologisches Ansprechen auf Nitazoxanid + pegIFN/RBV
Nitaxozanid, ein Arzneimittel gegen Protozoen, hatte in ägyptischen Studien einen additiven Effekt zur Standardtherapie bei HCV Gentoyp 4. Nun wurde die Substanz in drei amerikanischen Studien bei Genotyp 1 untersucht. Das Ergebnis war enttäuschend. Bei Nonrespondern (n=66) hatte Nitaxozanid in der Studie STEALTH C-2 überhaupt keinen Effekt. Eine SVR erreichten lediglich drei Patienten (7%) (Abb. 7) (#1188 Shiffman ML et al.). Bei Therapienaiven erhöhte Nitaxozanid die SVR-Rate von (n=112) 32% vs. 44% bzw. von (n=23) 46% auf 57% (#2001 Bacon BR et al., #242 Basu P et al.). Angesichts dieses eher schwachen Effektes – insbesondere im Vergleich mit den neuen Proteasehemmer – stellt sich die Frage, welchen Stellenwert Nitaxozanid in Zukunft haben könnte. Der Hersteller scheint die Substanz dennoch bei der Hepatitis C weiterentwickeln zu wollen. Mit der Verträglichkeit jedenfalls gibt es keine Probleme. Außer milden Diarrhoen wurden keine Nebenwirkungen beobachtet.
Silibinin als Rescue
Das Flavanoid Silibinin senkt in hoher Dosierung die HCV-RNA. In einer kleinen deutschen Pilotstudie wurde die Substanz bei 16 Patienten mit niedriger HCV-RNA unter pegyliertem Interferon/Ribavirin während einer Standardtherapie bzw. als Anstieg nach Beendigung der Tripletherapie mit einem Proteasehemmer eingesetzt. Die Infusion von 1.400 mg Silibinin an zwei aufeinander folgenden Tagen führte bei 13/16 Patienten zur Reduktion der HCV-RNA und bei 10/16 Patienten zum kompletten virologischen Ansprechen. Die SVR-Raten sind noch offen (#36 Biermer M et al.).
Hepatitis B
Zur Hepatitis B wurden im Vergleich zur Hepatitis C deutlich weniger Arbeiten präsentiert. In den Übersichtsvorträgen von Jörg Petersen, Hamburg, und Pietro Lampertico, Rom, wurde als Ziel der Therapie der Hepatitis B erneut der HBsAg-Verlust bzw. die HbsAg-Serokonversion genannt. Dies ist ein ehrgeiziges Ziel, denn mit den aktuellen Medikamenten und Strategien erreichen nur wenige Patienten die immunologische Kontrolle über die chronische Virusinfektion. Unter Nukleosid(t)en kommt es bei HBeAg-positiven Patienten nach einem Jahr bei 0-3% zum HBsAg-Verlust. Nach zwei Jahren Therapie steigt die Rate auf 5-6%, wobei Tenofovir und Entecavir hier einen vergleichbaren Effekt haben. „Möglicherweise lässt sich diese Rate durch eine längere Therapie oder die Kombination mit Interferon steigern“, meinte Prof. Jörg Petersen, Hamburg. Die Behandlung mit pegyliertem Interferon ist nach Meinung von Prof. Pietro Lampertico, Rom, durchaus sinnvoll, allerdings nur bei ausgewählten Patienten. In Frage kommen insbesondere HBsAg-positive Patienten mit Genotyp A, B und C, erhöhten Transaminasen und niedriger HBV-DNA. Hier beträgt die Chance eines HBsAg-Verlustes 30-50%. Ein günstiger Prädiktor unter der Therapie ist der Abfall der HBV-DNA <5 log sowie ein Abfall des quantitativen HBsAg <1.500 IU/ml.
Bei HBeAg-Negativen gibt es weniger Daten. Unter der Therapie scheinen ein Abfall des quantitativen HBsAg um <10% zu Woche 12 bei Non-D-Genotyp und zu Woche 24 bei Genotyp D ein gutes Zeichen zu sein. Besser als die Abnahme des HBsAg-Spiegels allein ist möglicherweise die Kombination von Rückgang von HBV-DNA und HBsAg. In einer Studie an 107 Patienten erreichte kein Patient mit einem Abfall der HBV-DNA <2 log und fehlendem Abfall des HBsAg ein dauerhaftes Ansprechen (#8 Rijckborst V et al.). Eine weitere Strategie zur Verbesserung ist eine längere Therapiedauer. Die Verlängerung von 48 auf 96 Wochen erhöhte bei 128 HBeAg-negativen Patienten (90% Genotyp D) die Ansprechraten (<10.000 Kopien/ml 12 Monat nach Therapieende 12% vs. 29%) sowie den HBsAg-Verlust (0% vs. 2%) (#98 Lampertico P et al.). Neuere Strategien, die aktuell untersucht werden, sind eine noch längere Therapiedauer und die Kombination mit Nukleosid(t)en. Neue Medikamente gegen Hepatitis B sind jedenfalls nicht in der Pipeline.
Fortgeschrittene Lebererkrankung
Der Einsatz von Tenofovir/Emtricitabin nach Lebertransplantation wegen Hepatitis B macht möglicherweise HBIg (Hepatitis B-Immunglobulin) überflüssig. In der Studie 107 erhielten 40 Patienten 24 Wochen lang HBIg plus TDF/FTC und wurden anschließend entweder so weiterbehandelt oder allein mit TDF/FTC. In der Interimanalyse nach 72 Wochen war kein Rezidiv beobachtet worden. Die HBV-DNA war in beiden Gruppen unter der Nachweisgrenze und HBsAg negativ. Die Nierenfunktion unter Tenofovir blieb bei entsprechender Dosisanpassung stabil (#28 Teperman L et al.).
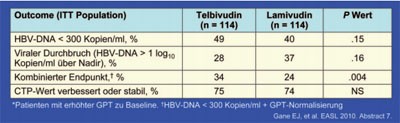
Tab. 3: Dekompensierte Leberzirrhose. Zwei Jahre Telbivudin vs.
Lamivudin
Das Nukleosid Telbivudin war in einer großen Studie bei Patienten mit dekompensierter Leberzirrhose bei Hepatitis B Lamivudin signifikant überlegen. An der Studie nahmen 195 Patienten mit dekompensierter Leberzirrhose (CTP >7 und Zirrhose oder portale Hypertension) teil. Der CTP lag im Schnitt bei 8 und der MELD bei 15. 20% der Patienten hatten eine geschränkte GFR <80 ml/Min. Nach zwei Jahren hatte sich die Leberfunktion in beiden Gruppen gleichermaßen stabilisiert. Unter Telbivudin kam es allerdings häufiger zum Abfall der HBV-DNA <300 Kopien/ml (47% vs. 36%), zur Normalisierung der GPT (34% vs. 24%, p=0,004) sowie seltener zum viralen Durchbruch (29% vs. 39%) (Tab. 3). Zudem hatte sich die Nierenfunktion unter Telbivudin im Vergleich zu Lamivudin stärker gebessert und es zeichnete sich ein Trend zu einer besseren 2-Jahres-Überlebensrate ab (#7 Gane JE et al.).
HIV/HCV Koinfektion
Bei HIV/HCV-Koinfektion kommt es zu einer rascheren Progredienz der Lebererkrankung als bei HCV-Monoinfektion. Deshalb sollte die Hepatitis bei Koinfizierten nach Möglichkeit behandelt werden. Doch hierzulande werden offenbar weniger als die Hälfte der Patienten therapiert. In einer deutsch-österreichischen Analyse der Daten von 14 Zentren waren seit 2001 nur rund 40% der HIV/HCV-Koinfizierten behandelt worden. Als Gründe dafür wurden genannt:
• Patientenwunsch (20%)
• Adhärenz (19%)
• Aktiver IDU (14%)
• Komorbidität (9%)
• Psychiatrische Erkrankung (9%)
• Fortgeschrittene HIV-Infektion/AIDS (9%)
• Unbekannt (22%)
85% der über 1.000 Patienten waren Deutsche/Österreicher, 15% Immigranten. 62% hatten GT1, 24% GT3, 9% GT4 und 5% GT2. Bei den behandelten Patienten betrugen die SVR-Raten 51% bei GT1/3 und 38% bei GT2 (#1070 Reiberger T et al.).
Der günstige Effekt einer erfolgreichen HCV-Therapie bei Koinfizierten scheint sich rasch einzustellen.
Bereits am Ende der HCV-Therapie hatte sich in einer Untersuchung an 115 HIV/HCV-Koinfizierten die Leberstruktur im Fibroscan deutlich gebessert (SVR -1,6 kPa vs. Non-SVR -0,3 kPa). Sechs Monate nach Therapieende hatten die Patienten mit SVR eine Lebersteifigkeit von 10,2-6,9 kPa, ohne SVR 12,0-12,6 kPa und nicht behandelte Kontrollen von 16,6-17,1 (#401 Hezode C et al.).
Bei Patienten mit Leberzirrhose besteht unter der HCV-Therapie die Gefahr einer Dekompensation. Bei Koinfizierten scheint eine Verschlechterung des Child-Pugh Score kein zuverlässiger Prädiktor für diese Komplikation zu sein. In der PARADIGM-Studie an 46 HIV/HCV-Koinfizierten mit kompensierter Leberzirrhose kam bei der Hälfte der Patienten zur Verschlechterung des Child-Pugh Scores. Die Verschlechterung war in der Regel Folge einer Veränderung von Albumin und/oder Bilirubin. Doch lediglich in einem Fall wurde drei Monate nach Absetzen der HCV-Therapie wegen Nichtansprechen eine Varizenblutung beobachtet (#303 Sulkowski M et al.).

Politischer Konflikt

Politische Konflikte machen auch nicht vor wissenschaftlichen Kongressen Halt. Auf dem Internationalen Leberkongress in Wien löste der Iraner S. M. Alavian einen kleinen Eklat aus. Alavian präsentiert in kaum verständlichem Englisch eine Studie von sehr fraglicher Qualität zur Wirksamkeit und Sicherheit von Ribavirin bei Thalassämie (#59). Doch nicht die wissenschaftlichen Mängel waren der Stein des Anstoßes. Die Teilnehmer akzeptierten offenbar die Entscheidung des EASL-Kommittees, Arbeiten aus Gründen politischer Korrektheit mit ins Hauptprogramm zu nehmen. Der Iraner erwiderte die Geste jedoch nicht und zeigte eine geographische Karte der Verbreitung der Thalassämie im nahen Osten auf der Israel fehlte, woraufhin viele israelische Teilnehmer den Raum verließen.
S.-M. Alavian, Iran, bei seinem Vortrag





