 Viola Weich1, Christoph Sarrazin1 und Thomas Berg2
Viola Weich1, Christoph Sarrazin1 und Thomas Berg2
Individualisierte Therapiestrategie mit Peginterferon alfa-2b plus Ribavirin in Abhängigkeit von der frühen Viruskinetik bei Hepatitis C Virus (HCV) Typ 1-infizierten Patienten (INDIV-1 Studie)
In den vergangenen Jahren konnten mehrere Studien belegen, dass die Wahrscheinlichkeit eines anhaltenden virologischen Ansprechens und damit einer Heilung der chronischen Hepatitis C ganz wesentlich von bestimmten viralen Faktoren und Wirts-Faktoren abhängig ist. Die HCV RNA-Kinetik unter Therapie reflektiert dabei am besten die individuelle Prognose des Patienten, da sich in ihr alle Prognosefaktoren subsummieren. Eine sich ausschließlich am HCV-Genotyp orientierende Behandlungsdauer von 24 (Genotyp 2 und 3) bzw. 48 Wochen (Genotyp 1, 4 und 6) stellt somit aus heutiger Sicht kein optimales therapeutisches Vorgehen mehr dar. Vielmehr sollte sich die Festlegung der Therapiedauer nach den individuellen Erfordernissen des einzelnen Patienten richten. Wesentliche Voraussetzung für dieses individualisierte Therapiekonzept ist die Bestimmung des frühen virologischen Ansprechens. Bisher existieren jedoch nur wenige prospektive Daten zur Geschwindigkeit und Frequenz der HCV RNA-„Negativierung“ unter Therapie sowie der Bedeutung der HCV RNA-Testsensitivität für die Definition der virologischen Response.
Individualisierte Therapie vs. Standard
Ziel der INDIV 1-Studie war zu untersuchen, ob eine individuell-adaptierte Therapiedauer bei HCV Typ 1-infizierten Patienten ebenso effektiv ist wie die Standard-Kombinationsbehandlung über 48 Wochen.
Studiendesign
433 Patienten aus 19 deutschen Studienzentren wurden zwischen 1/2002-1/2004 randomisiert und erhielten entweder 1,5 µg/kg KG Peg-interferon-alfa-2b/Woche plus 800-1.400 mg Ribavirin/Tag für 48 Wochen (n=225, Gruppe A) oder eine individuell adaptierte Behandlungsdauer (n=208, Gruppe B). In Gruppe B wurde die Therapiedauer anhand der Zeitdauer ermittelt, die ein Patient benötigte, um zum ersten Mal HCV-RNA negativ zu werden (definiert mittels bDNA Test, Nachweisgrenze 615 IU/ml) multipliziert mit dem Faktor 6 (Abb. 1). Entsprechend lag die Therapiedauer bei HCV RNA- Negativität zu Woche 3, 4, 5, 6, 7 oder 8 bei 18, 24, 32, 36, 42 oder 48 Wochen. Eine Therapieverlängerung über 48 Wochen hinaus war im Rahmen dieser Studie nicht vorgesehen. HCV RNA wurde zu Baseline und wöchentlich bis Woche 8 sowie zu Woche 12, 24 und 48 mittels bDNA-Test gemessen. Der sensitivere TMA-Test (Nachweisgrenze 5,3 IU/ml) wurde nur bei Patienten mit bereits negativem bDNA-Test eingesetzt. Die anhaltende virologische Remission (SVR) war definiert als negativer qualitativer TMA-Test 24 Wochen nach Therapieende.
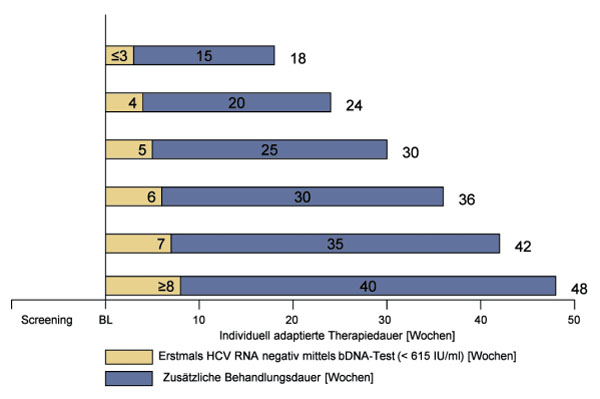
Abb. 1: Patienten im Behandlungsarm B (n=208) erhielten eine individuell adaptierte Therapie von mindestens 18 und maximal 48 Wochen. Die entsprechende Therapiedauer wurde anhand der Zeitdauer kalkuliert, die ein Patient benötigte, um zum ersten Mal HCV RNA negativ mittels bDNA-Test (Nachweisgrenze 615 IU/ml) zu werden multipliziert mit dem Faktor 6.
Erhöhte Relapseraten
Die individualisierte Therapie (Gruppe B) zeigte im Vergleich zur Standardbehandlung (Gruppe A) zwar vergleichbare virologische Ansprechraten unter der Therapie jedoch signifikant niedrige dauerhafte Ansprechraten. Die SVR Raten lagen bei 34,6% in Gruppe B im Vergleich zu 48% in Gruppe A (p=0,005) als Folge höherer Relapseraten (32,7% vs. 14,2%; p < 0,0005). Eine multivariate Regressionsanalyse zeigte, dass eine Randomisierung in Gruppe A, eine niedrige GGT, fehlende Thrombozytopenie sowie eine niedrige Ausgangsviruslast das Erreichen einer SVR begünstigen.
SVR Raten bei RVR im bDNA-Test
Abbildung 2 zeigt eine Korrelation zwischen frühem virologischen Ansprechen mittels bDNA-Test (erstmals HCV RNA < 615 IU/ml) und dem Erreichen einer kompletten virologischen Response. Die Standardtherapie war auch in der Subgruppenanalyse dem individualisierten Therapieregime grundsätzlich überlegen. Bei Patienten, die erst zur Woche 12 oder später eine virologische Response zeigten (HCV RNA < 615 IU/ml), war die Wahrscheinlichkeit, eine SVR nach 12 Behandlungsmonaten zu erreichen, gering (ca. 25%).
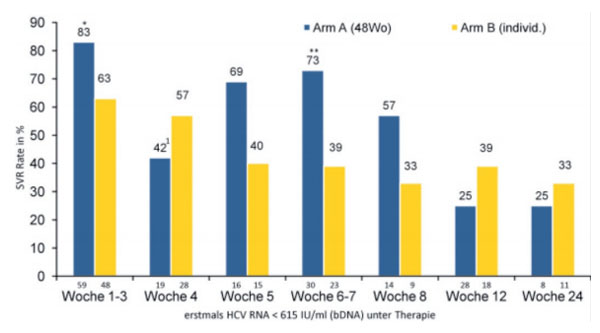
Abb. 2: SVR-Raten (in %) in Arm A (48 Wochen)und B (individualisiert) in Abhängigkeit von der frühen virologischen Response. Die absoluten Patientenzahlen der jeweiligen Subgruppe sind jeweils unterhalb der einzelnen Säulen angegeben. *p = 0,026, **p = 0,013 (Chi-Quadrat Test). 1 erfasst 6 Patienten, die zu einem frühen Zeitpunkt die Studie abgebrochen haben.
Verkürzung bei „Super-Respondern“
48 Patienten aus Therapiearm B wurden gemäß Studienprotokoll nur über 18 Wochen behandelt. 33 dieser 48 Patienten erreichten innerhalb der ersten 5 Therapiewochen eine komplette virologische Response gemessen mittels hochsensitivem TMA-Test (HCV RNA < 5,3 IU/ml). Abbildung 3 zeigt die SVR-Raten in Abhängigkeit von der Ausgangsviruslast für diese Patientensubgruppe im Vergleich zum Standardtherapiearm. Insgesamt betrug die SVR-Rate 79% (26 von 33 Patienten) bei 18-wöchiger und 93% bei Standard-Therapiedauer. Patienten mit einer niedrigen Ausgangs-Viruslast (≤ 800.000 IU/ml) erzielten jedoch im 18 Wochen-Therapiearm mit 92% (22 von 24 Patienten) vergleichbare SVR-Raten wie die Patienten, die über 48 Wochen behandelt wurden. Bei hoher Ausgangsviruslast (> 800.000 IU/ml) führte die Therapieverkürzung jedoch zu signifikant niedrigeren SVR-Raten (44% vs. 100%).
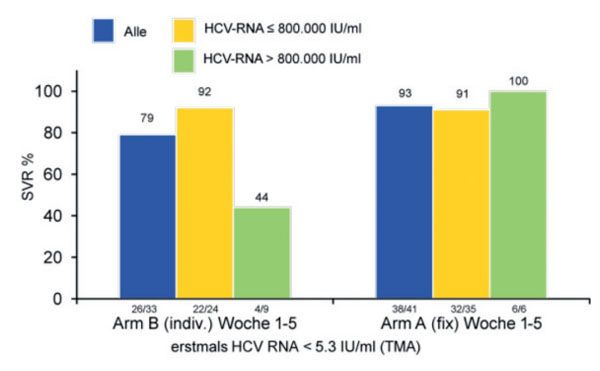
Abb. 3: 18 Wochen (Gruppe B) versus Standardtherapiedauer (Gruppe A) bei Patienten mit negativem bDNA-Test innerhalb der ersten 3 Behandlungswochen und negativem TMA-Test bis Woche 5. SVR Raten (in %) in Abhängigkeit von der Ausgangsviruslast. Die absoluten Patientenzahlen der jeweiligen Subgruppe sind jeweils unterhalb der einzelnen Säulen angegeben.
Individuelle Zeitdauer zwischen bDNA- und TMA-Response
Bei allen Patienten, die mittels bDNA-Test HCV negativ getestet wurden (Nachweisgrenze 615 IU/ml), erfolgte zusätzlich eine HCV-RNA Testung mittels hochsensitivem TMA Test (Nachweisgrenze < 5,3 IU/ml). Es zeigte sich, dass bei der Mehrzahl der bDNA negativen Proben noch eine minimale Restvirämie zu finden war. Das mediane Zeitintervall, bis ein bDNA negativer Patient auch mittels TMA HCV-RNA negativ wurde, betrug 3 Wochen (Spannweite 0-40 Wochen). Die virale Kinetik innerhalb der ersten Therapiewoche (größer oder kleiner 0,88 log Abfall) hatte mittels multivariater Analyse den größten Einfluss auf die Zeitdauer der minimalen Virämie (Abb. 4). Verschiedene Baseline-Faktoren wie niedrige Ausgangsviruslast und geringes Fibrosestadium begünstigen ferner eine rasche komplette HCV-RNA Negativierung mittels TMA-Test (Tab. 1).
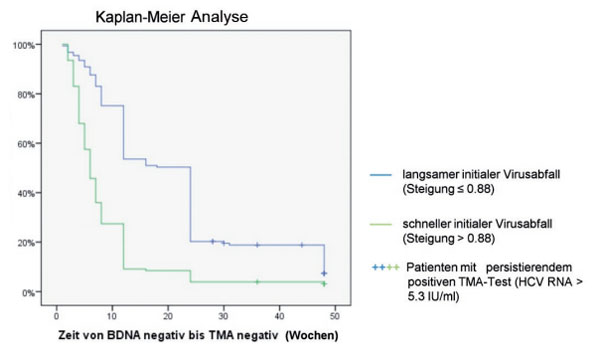
Abb. 4: Zeitspanne bis zum Erreichen einer kompletten virologischen Response mittels TMA-Test bei Patienten, die im Verlauf der Therapie HCV RNA-Konzentrationen unterhalb der Nachweisgrenze des bDNA Tests (< 615 IU/ml) erreicht haben in Abhängigkeit von der frühen Viruskinetik innerhalb der ersten Therapiewoche. Bei insgesamt 20 der 298 Patienten mit HCV RNA-Konzentrationen < 615 IU/ml konnten über den gesamten Therapiezeitraum eine minimale Restvirämie (TMA positiv) nachgewiesen werden.

Tab. 1
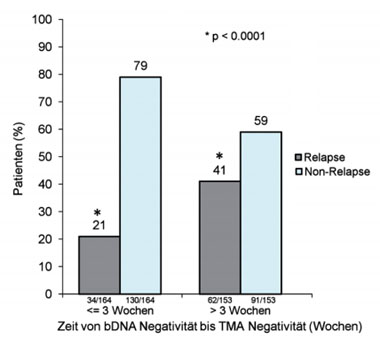
Abb. 5: Bedeutung der Dauer einer minimalen Restvirämie (bDNA negativ, jedoch noch TMA positiv) für die Vorhersage eines Relapses.
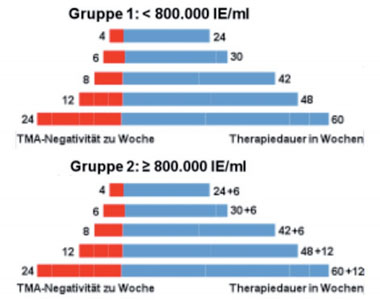
Abb. 6: Design der INDIV-2 Studie. 398 Patienten erhielten eine individuell adaptierte Therapie von mindestens 24 und maximal 72 Wochen. Die entsprechende Therapiedauer wurde anhand der Zeitdauer kalkuliert, die ein Patient benötigte, um zum ersten Mal HCV RNA negativ mittels TMA-Test (Nachweisgrenze 5,3 IU/ml) zu werden sowie unter Berücksichtigung der Ausgangsviruslast. Als historische Kontrolle dienten die Patienten, die im Rahmen der INDIV-1 Studie eine 48 wöchige Standardtherapie erhalten hatten.
Der Nachweis bzw. die Zeitdauer einer minimalen Restvirämie war prognostisch bedeutend für die Prädiktion der Relapsewahrscheinlichkeit. Bei Persistenz der minimalen Restvirämie von ≤ 3 Wochen war das Risiko, einen Relapse zu erleiden mit 21% signifikant niedriger als bei Patienten mit > 3-wöchiger Persistenz der Restvirämie (41%) (Abb. 5).
Optimierung: INDIV-2 Studie
Die Ergebnisse der INDIV-1 Studie zeigen, dass
nur eine Subgruppe von Patienten von einer Verkürzung der Therapiedauer
profitiert. Das Erreichen einer anhaltenden Remission ist zum einen von einer
frühen HCV RNA-Negativierung mittels hochsensitiver Assays und zum anderen von
der Höhe der Ausgangsviruslast abhängig. Um ein verbessertes Therapiemanagement
zu erzielen, ist für die INDIV-2 Studie ein optimiertes Behandlungsprotokoll
entworfen worden (Abb. 6), welches die Therapiedauer anhand einer Einteilung
der Patienten nach hoher oder niedriger Ausgangsviruslast (cut-off 800.000 IU/ml)
und der Zeit bis zur ersten Negativierung
der HCV RNA mit einem hochsensitiven
Assay festlegt (TMA, Nachweisgrenze 5,3 IU/ml). Um den Einsatz einer solchen
individualisierten Therapie praxistauglich zu machen, erfolgt die Bestimmung
der HCV RNA im Rahmen der Festlegung der Therapiedauer zu Woche 4, 6, 8, 12 und
24. Zusätzlich wurde für Patienten mit besonders ungünstigen Voraussetzungen
(d.h. HCV RNA-Negativierung nach Woche 12 der Therapie) eine
Therapieverlängerung über 48 Wochen hinaus bis zu 72 Wochen ermöglicht. Die
kürzlich publizierten Erkenntnisse zur Bedeutung des IL28B-Gen Polymorphismus
für das dauerhafte Ansprechen auf die PEG-Interferon/Ribavirintherapie bei der
Hepatitis C werden im Rahmen der INDIV-2 Studie retrospektiv untersucht und ermöglichen
ggf. eine weitere Optimierung der individualisierten Therapie.
Auch für Triple-Therapieansätze mit PEG-Interferon, Ribavirin und einem Proteaseinhibitor, die im Jahr 2011/12 zur Standardtherapie der Hepatitis C Genotyp-1 Infektion werden, konnte in ersten Studien die Bedeutung der initialen Viruskinetik für die Festlegung der Therapiedauer nachgewiesen werden.
Fazit
- Ein individuelles Therapiedesign, welches allein auf dem Zeitpunkt basiert, mittels bDNA-Test (HCV RNA < 615 IU/ml) virusnegativ zu werden, führt zu höheren Relapseraten im Vergleich zur Standardtherapie.
- Der Einsatz hochsensitiver HCV RNA-Assays ermöglicht es, eine Subgruppe von HCV Typ 1- infizierten Patienten zu identifizieren, bei der eine 18-wöchige Therapiedauer ausreicht, um Heilungsraten von über 90% zu induzieren.
- Ein individualisiertes Therapiekonzept, basierend auf hochsensitiven HCV RNA-Tests und Ausgangsviruslast stellen einen sinnvollen Ansatz für die Zukunft dar.





