Jörg Petersen, Hamburg
Die Rolle des HBsAg in der Therapie der Hepatitis B
Die Europäische Vereinigung zum Studium der Leber EASL hat in ihren 2009 veröffentlichten Clinical Practice Guidelines zur Hepatitis B den Verlust von HBsAg (Hepatitis B surface Antigen) oder noch besser die Serokonversion zu Anti-HBs Antikörpern als den nachdrücklichst anzustrebenden Therapieendpunkt bezeichnet, der einer spontanen Heilung der Erkrankung auch am nächsten kommt (EASL CPG Hepatitis B, J Hepatology Februar 2009). Unterstützung erfährt dieser Standpunkt von den Studien zum natürlichen Verlauf der chronischen Hepatitis B. Patienten, die HBsAg immunologisch eliminieren konnten, zeigten bessere Überlebensraten, niedrigere Raten an hepatischer Dekompensation und eine Reduktion der Frequenz von hepatozellulären Karzinomen vor allem bei zirrhotischen Patienten (Fattovich G et al. Am J Gastroenterol 1998; 93:896-900). Bei diesen Patienten fand sich zudem in molekularen Studien nur noch sehr wenig cccDNA, welche die Matrize der viralen Replikation im Zellkern infizierter Hepatozyten darstellt (Werle-Lapostolle et al. Gastroenterology 2004; 126:1750-1758). Dieser Aspekt ist für den klinischen Alltag von großer Bedeutung. Das Risiko einer Reaktivierung der Hepatitis B ist bei nur noch anti HBc (core)-positiven und HBsAg-negativen Patienten niedrig, selbst wenn diese sich einer Chemotherapie bei malignen oder anderen Erkrankungen unterziehen müssen (Lok A et al. Gastroenterology 1991;100.182-86).
HBsAg-Verlust in klinischen Studien
Bislang wurde der HBsAg-Verlust aufgrund der
niedrigen Erfolgsrate nicht als primärer Endpunkt in klinischen Studien
verwendet. In der Mehrheit der Nukleos(t)idstudien konnten auch nach
mehrjähriger Therapie bislang lediglich HBsAg-Verlustraten von etwa 1-2% pro
Jahr nachgewiesen werden und das auch nur bei westlichen Patienten, die meist
initial HBeAg-positiv waren (Chu CM et al. Hepatology 2007;45.1187-92,
Heathcote J et al. EASL 2009 #909). Interferon alpha kann ebenfalls zum
HBsAg-Verlust führen, allerdings nach der 6-12 monatigen Therapie auch nur bei
sehr wenigen Patienten. Bei HBeAg-positiven Patienten hatten in den zumeist
retrospektiv erhobenen Studien
lediglich 3-10% HBsAg
verloren (Perillo R, Hepatology 2009;49:1063-65, Marcellin P et al. NEJM
2004;351:1206-17). Bei den HBeAg-negativen Patienten war dieser Prozentsatz
meist sogar noch geringer. Interessanterweise scheint die Zahl der Patienten,
die HBsAg eliminieren, im Laufe der Jahre nach Beendigung der
Interferon-Therapie weiter anzusteigen und zwar sowohl bei HBeAg-positiven und
HBeAg- negativen Patienten (Chu CM et al. Hepatology 2007; 45.1187-92, Buster E
et al. Gastroenterology 2008;135:459-67). Bei HBeAg-negativen Patienten liegen
die aktuellen Zahlen bei 12% nach 5 Jahren, wobei diese Patienten alle initial
auf die Interferontherapie angesprochen haben (Marcellin et al. AASLD 2009,
#387).
HBsAg-Abfall als Prädiktor
Von einem konzeptionellen Standpunkt aus betrachtet, könnte die Abnahme der HBsAg-Konzentration zu bestimmten Zeitpunkten unter der Therapie, Hinweise auf den nachfolgenden Therapieerfolg geben. So könnte ein Algorithmus, berechnet nach longitudinaler quantitativer HBsAg-Bestimmung, eine bessere Vorhersagbarkeit des Therapieerfolges mit positivem wie negativem Vorhersagewert ermöglichen. Dies wäre von großem Vorteil nicht nur aus Kostengründen, sondern auch im Hinblick auf die Motivation der Patienten, die unter einer nebenwirkungsträchtigen Therapie leiden sowie nicht zuletzt bei den im Allgemeinen schwieriger zu therapierenden HBeAg-negativen Patienten.
Technische Probleme
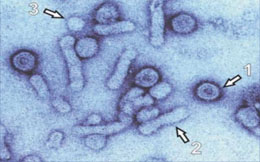
Abb. 1: HBsAg elektronenmikroskopisch: Virione 42 nm (1), Filamente 22nm (2), Sphärische Partikel (3) – Die Produktion defekter HBs Partikel übersteigt die Virionproduktion um einen Faktor von 10 3 -10 6 , wobei die Regulation der HBsAg-Synthese bislang nur unzureichend verstanden wird
Erfreulicherweise lässt sich HBsAg mittlerweile zuverlässig quantifizieren. Es existieren verschiedene kommerzielle Assays zur Quantifizierung, vor allem das Architect System der Firma Abbott, insbesondere in Europa, und das Elecsys II System der Firma Roche, vornehmlich in den USA, sowie das ADVIA Centaur System der Firma Siemens Healthcare (früher Bayer Healthcare) oder der Hepanostika Test von Biomerieux. Mit Hilfe dieser Tests lassen sich Kinetiken des HBsAg-Abfalls unter Therapie erstellen. Es soll hier jedoch betont werden, dass die HBsAg-Bestimmung nicht ganz einfach ist. Entscheidend ist, dass durch geeignete Vorverdünnung der lineare Messbereich des Tests erreicht wird. Daneben gibt es verschiedene Subfraktionen von HBsAg und Störmechanismen in der Messgenauigkeit, die bislang nicht komplett untersucht sind. Zudem sind die Steuerungsmechanismen der HBsAg-Synthese bislang nicht vollständig aufgeklärt (Abb. 1). Erste Ergebnisse kleiner Pilotstudien zeigen, dass der Abfall der Gesamtmenge an gemessenem HBsAg unter Interferon im Vergleich zu den Nukleosidanaloga deutlich akzentuierter in der Anfangsphase zu verlaufen erscheint. Substantielle Reduktionen sind zumeist bereits nach 12-24 Wochen nach Therapiebeginn zu verzeichnen, insbesondere bei Patienten, die zu einem späteren Zeitpunkt das HBsAg eliminieren konnten (Wursthorn et al. Hepatology 2006;44:675-84, Manesis EK et al. Antiviral Therapy 2007;12:73-82, Gish RG et al. Am J Gastroenterol 2007;102:2718-2723).
Aktuelle Daten
In diesem Jahr wurden zwei interessante Studien in Hepatology veröffentlicht, die sich mit HBsAg-Messungen bei HBeAg-negativen Patienten während der Therapie mit PEG IFN alpha 2a beschäftigen.
In der ersten Studie von Moucari und Kollegen (Moucari R et al. Hepatology 2009;49:1141-50) wurden 48 Patienten mit pegyliertem Interferon alpha 2a therapiert. Die Autoren konnten zeigen, dass ein früher Abfall der HBsAg-Konzentration, mit dem Architect System gemessen, hochsignifikant mit einer späteren nicht detektierbaren Menge von HBV DNA assoziiert war, was die Autoren eine SVR (sustained virale response, in Analogie zur Hepatitis C) nannten. Interessanterweise zeigte die Kinetik der HBV DNA unter Therapie keinen Unterschied zwischen SVR Patienten und späteren Relapsern. Patienten, bei denen praktisch keine Änderung der HBsAg-Konzentration bis Woche 12 und 24 zu verzeichnen war, hatten dagegen einen negativen Vorhersagewert (NPV) von 92%, respektive 97%, für eine SVR. Dieser NPV könnte somit in weiteren Studien als mögliches „stopping rule“ für den klinischen Alltag bei PEG IFN Therapien weiterentwickelt werden.
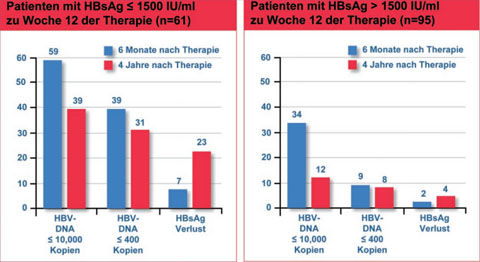
Abb. 2: HBsAg-Reduktion und virologische Antwort in HBeAg neg. Patienten unter PEG-Interferon alfa 2a (+/-Lamivudin)
In einer zweiten Studie von Brunetto und Kollegen (Brunetto M et al. Hepatology 2009; 49:1151-60) konnte gezeigt werden, dass die „end of treatment“ HBsAg-Konzentration bei 386 therapierten HBeAg-negativen Patienten, retrospektiv betrachtet, mit einer HBV DNA Reduktion auf unter 400 Kopien/ml sechs Monate nach Therapieende streng korrelierte. HBsAg-Spiegel von <10 IU/ml zum Ende der PEG IFN Therapie und Abnahme von HBsAg-Konzen-tration > 1log10 IU/ml zu Woche 48 der Therapie korrelierten signifikant mit einem HBsAg-Verlust drei Jahre nach Beendigung der IFN Therapie. Unter PEG IFN kam es zudem zu einem 30fach stärkeren Abfall der HBsAg-Spiegel im Vergleich zu Patienten, die mit Lamivudin therapiert wurden (Abb. 2).
In beiden Studien wurden die Daten retrospektiv ausgewertet, so dass prospektive Studien noch fehlen ebenso wie vergleichbare Daten mit den höher potenten Mitteln Entecavir und Tenofovir. Dennoch könnte die Messung der Konzentration von HBsAg ein zusätzliches Werkzeug zur DNA-Bestimmung im Sinne einer „response guided therapy“ oder in Analogie zu HCV eine stärker individualisierte Therapie der Hepatitis B ermöglichen. Höchstwahrscheinlich werden zukünftige Studien zur Therapie der Hepatitis B daher eine Quantifizierung von HBsAg beinhalten, und dies sowohl für IFN wie für die Nukleos(t)idanaloga. Insbesondere für die Nucleos/tid-Analoga könnte es wichtig werden, die Messung von HBsAg-Spiegeln als indirekten und nicht-invasiven Surrogatparameter für die Menge an cccDNA in der Leber heranzuziehen.
Es ist mittlerweile bekannt, dass der Genotyp
bei der Hepatitis B mit der SVR nach Interferontherapie korreliert, sowohl in
HBeAg-positiven wie in HBeAg-negativen Patienten (Bonino F et al. Gut
2007;56:699-705, Erhardt A et al. Hepatology 2008;48 (suppl):700A). Eine SVR
tritt häufiger in HBeAg-positiven Patienten mit Genotyp A und in
HBeAg-negativen Patienten mit Genotyp C ein. Hingegen zeigten sich bislang die
niedrigsten Raten an SVR in Patienten unter Interferon in HBeAg-negativen Patienten
mit Genotyp D. Interessanterweise sind dies diejenigen Patienten, die den
geringsten Abfall an HBsAg in der Studie von Brunetto und Kollegen aufwiesen.
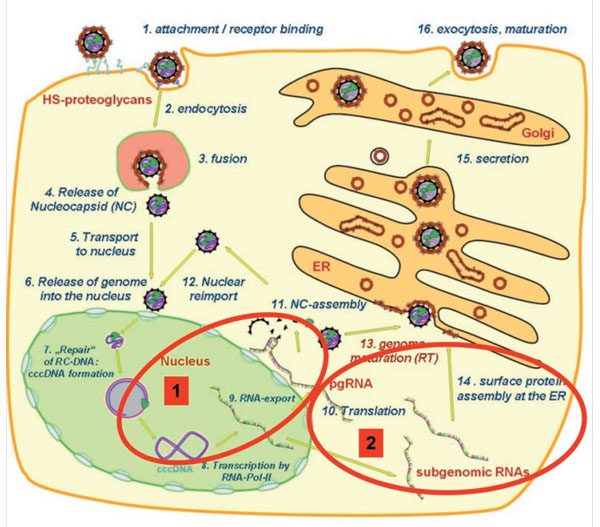 Abb. 3: Replikationszyklus HBV 1: virale Replikation, 2: HbsAg-Synthese
Abb. 3: Replikationszyklus HBV 1: virale Replikation, 2: HbsAg-Synthese
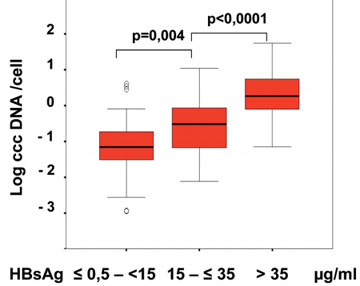
Abb. 4: Korrelation von cccDNA Kopienzahl und HbsAg-Spiegel. Volz et al. Gastroenterology 2007;133:845-52
In der Abbildung 3 ist der virale Replikationszyklus des Hepatitis B Virus dargestellt. Wichtig für das Verständnis und die Einordnung des HBsAg in die Wertigkeit zukünftiger Untersuchungen ist die Tatsache, dass die virale Replikation von der cccDNA und die Generation von HBsAg unterschiedliche, voneinander unabhängige mRNAs mit unterschiedlichen Promotoren nutzen. Von daher kann die HBsAg-Quantifizierung immer nur einen indirekten Hinweis auf die Menge von cccDNA, also virale Matrize im Zellkern, liefern, zudem die Regulationsmechanismen von cccDNA und HBsAg Synthese bislang nur unzureichend verstanden werden. Für die Korrelation von HBsAg im Serum mit der Menge an cccDNA in der Leber sind nach ersten Veröffentlichungen (u.a. Volz T et al. Gastroenterology 2007;133: 845-52, Abb. 4) beim EASL-Kongress 2009 kürzlich mehrere Studien mit z.T. widersprüchlichen Ergebnissen vorgestellt worden, was die Korrelationsmöglichkeiten von HBsAg und cccDNA betrifft (EASL 2009: T Pollicino et al. Abstract 577; L Lu et al. Abstract 567). Zu diesem sehr interessanten Aspekt, der möglicherweise zur besseren Definition von Therapieendpunkten bei der Hepatitis B beitragen kann, müssen daher noch weitere prospektive Studien abgewartet werden.





