Holger Hinrichsen, Kiel
Zukünftige Therapieoptionen bei der Hepatitis C Protease- und Polymeraseinhibitoren
2004 wurde in einer Proof of Concept-Studie erstmals die Wirksamkeit einer direkt wirkenden antiviralen Substanz auf die Replikation des Hepatitis C-Virus bewiesen. Hierbei handelte es sich um einen Proteaseinhibitor. Jetzt, fünf Jahre später, sind die ersten beiden Substanzen Telaprevir und Boceprevir in die klinische Phase III der Zulassung vorgestoßen. Sollten keine neuen Toxizitätsprobleme auftreten, ist mit einer Zulassung des ersten Proteaseinhibitors in den USA im IV. Quartal 2011 und in Europa im I. Quartal 2012 zu rechnen.
SVR-Raten bis 80%
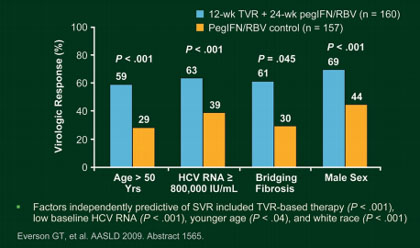
Abb. 1: PROVE 1 and 2 Pooled Subanalysis: TVR in Difficult-to-Cure Pts
Auf dem kürzlich zurückliegenden amerikanischen
Kongress für Lebererkrankungen AASLD wurden die neusten Ergebnisse zur
Behandlung mit einem Proteaseinhibitor in Kombination mit PEG-Interferon und
Ribavirin vorgestellt. Aus den bisherigen Studien der Phase II wird ersichtlich,
dass eine Behandlung mit der 3fach-Therapie bei Genotyp 1 in bis zu 80% der
Fälle zu einer dauerhaften Virusfreiheit führt, auch schwer zu behandelnde
Patienten profitieren und die Therapiedauer bei mehr als 50% der behandelten
Patienten auf 24 Wochen verkürzt werden kann (Abb. 1).
Neben den Proteaseinhibitoren werden zusätzlich noch Polymeraseinhibitoren zur Behandlung der Hepatitis C entwickelt. Diese befinden sich derzeit noch in früheren Phasen der klinischen Entwicklung, aktuell in der Phase II. Generell ist die antivirale Potenz dieser Substanzen nicht so hoch wie die der Proteaseinhibitoren, dafür sind sie nicht nur beim Genotyp 1, sondern unter Umständen auch bei anderen Genotypen gut wirksam. Was wird sich also ändern, wenn die/der erste Proteaseinhibitor zur Behandlung der Hepatitis C zugelassen wird? Können alle Patienten mit den neuen Substanzen behandelt werden?
Kontraindikationen bleiben
Zunächst einmal muss man festhalten, dass
Proteaseinhibitoren vorerst nur in Kombination mit pegyliertem Interferon und
Ribavirin zugelassen werden und nur bei HCV-Genotyp 1 wirken. Damit bleiben die
heute bestehenden Kontraindikationen für eine antivirale Therapie grundsätzlich
unverändert bestehen. Patienten, die heute nicht mit Interferon/Ribavirin
behandelt werden können (schwere psychiatrische Erkrankungen, unkontrollierte
Autoimmunerkrankungen, schwere Herz-Kreislauferkrankungen …) werden auch in
nächster Zukunft nicht mit der Tripletherapie behandelt werden können. Da zudem
nicht absehbar ist, ob die Dosis von Interferon und/oder Ribavirin in der
Dreifachtherapie reduziert werden kann, muss man sogar mit einer zusätzlichen
Toxizität rechnen. Dies hat
sich zumindest in den bisher veröffentlichen Studien so dargestellt. Aufgrund
der Nebenwirkungen ist sogar mit einer höheren Abbruchrate aufgrund von
Nebenwirkungen zu rechnen. In den bisherigen Studien haben bis zu 20% der
Patienten die Therapie wegen unerwünschter Wirkungen abgebrochen.
Gefahr Resistenzentwicklung
Die besseren Chancen auf eine SVR unter
Tripletherapie im Vergleich zur Standardkombinationstherapie bei gleichzeitiger
Verkürzung der Therapiedauer auf 24 Wochen bei mehr als der Hälfte der
Patienten sind klare Vorteile der Proteasehemmer. Aus diesem Grund ist ein
breiter Einsatz der DAA (direct acting antivirals) zu
erwarten. Bei breitem
Einsatz der neuen Substanzen, sind jedoch Fehler in der Anwendung und
Indikationsstellung nicht zu vermeiden. Welche Folgen kann das für unsere
Patienten haben? Die bisher in Phase III befindlichen Proteaseinhibitoren
müssen regelmäßig dreimal täglich exakt alle acht Stunden eingenommen werden
(08:00, 16:00 und 24:00 Uhr). Eine fehlerhafte Einnahme kann bei der hohen
HCV-Replikationsrate rasch zur Resistenzentwicklung führen. Doch wie ist die
Compliance der Patienten außerhalb von klinischen Studien?
Das Vermeiden von Resistenzen hat auch bei der FDA eine hohe Priorität. Aus diesem Grund wurden beispielsweise Null-Responder auf pegyliertes Interferon und Ribavirin von der Behandlung mit Boceprevir im Rahmen einer Tripletherapie primär ausgeschlossen. Ob diese Daten auch auf andere Proteaseinhibitoren wie Telaprevir übertragbar sind, ist derzeit noch unklar. Es sollte jedoch vor Einsatz eines Proteaseinhibitors bei Non-Respondern genau geprüft werden, ob eine Nullresponse (<1 log Viruslastabfall nach 4 bzw. 12 Wochen) oder aber zumindest ein partielles Ansprechen vorgelegen hat.
Probleme: Anämie und Exanthem
Mit welchen Nebenwirkungen haben wir zu rechnen? Zum einen können bereits unter der Standardkombinationstherapie bekannte Nebenwirkungen durch den Proteasehemmer in der Dreifachtherapie verstärkt werden. Die Anämie, eines der häufigsten Probleme, kann soweit verstärkt werden, dass eine gleichzeitige Behandlung mit Erythropoitin notwendig wird. Daneben sind insbesondere für Telaprevir dermatologische Nebenwirkungen beschrieben, die bis zum Therapieabbruch führen können. Beschrieben sind allergische Hautreaktionen, die soweit ausgeprägt sein können, dass es an ein Lyell-Syndrom erinnert. Schwere Hautveränderungen treten allerdings sehr selten auf und sind nach Absetzen der Substanz reversibel.
Therapiedauer
Die Behandlungsdauer mit der Dreifachkombination sowie die Gesamtbehandlungsdauer werden sowohl im Hinblick auf die Nebenwirkungen als auch im Hinblick auf die Kosten entscheidend sein. Telaprevir wird derzeit für eine 12wöchige Tripletherapie plus 12 Wochen Standardtherapie, Boceprevir für eine Tripletherapie über 48 Wochen entwickelt. Die Proteaseinhibitoren der zweiten Generation werden sogar für eine Behandlungsdauer von nur vier Wochen getestet. Im Prinzip gilt, je länger die Behandlungsdauer, desto geringer dürfen die Nebenwirkungen ausgeprägt sein.
Zukunftsmusik
Noch weiter in der Zukunft liegen Interferon/Ribavirin-freie Therapieregime aus direkt antiviralen Substanzen. Erste Ergebnisse der Kombination aus einem Protease- und Polymeraseinhibitor (Studie INFORM-1) weisen auf einen synergistischen Effekt beider Substanzen mit bislang fehlender Resistenzentwicklung hin. Der in dieser Studie eingesetzte Proteaseinhibitor der Firma Roche musste aktuell jedoch aufgrund von Toxizität von seiner optimalen Dosis reduziert werden. Das finale Ergebnis der Interferon/Ribavirin-freien Therapie ist nicht vor Ende 2011/2012 zu erwarten.
Literatur beim Verfasser





