Markus Heim, Basel
Nicht-Ansprechen auf Interferon bei HCV-Therapie – Ursachen und mögliche Strategien zur Verbesserung
Es ist schon lange bekannt, dass das individuelle Ansprechen auf eine Therapie bei chronischer Hepatitis C (CHC) beträchtlich variiert. Es gibt Patienten mit exzellentem Ansprechen, bei denen schon nach 4 Wochen Therapie das Hepatitis C Virus (HCV) im Serum nicht mehr nachweisbar ist. Am anderen Ende des Spektrums sind Patienten, die überhaupt nicht auf die Therapie ansprechen, bei denen also die Viruslast im Serum unverändert bleibt. Dazwischen gibt es alle möglichen Zwischenformen. Das Ansprechen auf die Therapie wird nach 4 Wochen (Rapid Virological Response; RVR), nach 12 Wochen (Early Virological Response; EVR), am Ende der Behandlung (End-of-Treatment Response; EoTR) und 6 Monate nach Therapieende (Sustained Virological Response; SVR) bestimmt. Abbildung 1 zeigt die verschiedenen Möglichkeiten des Therapieansprechens.
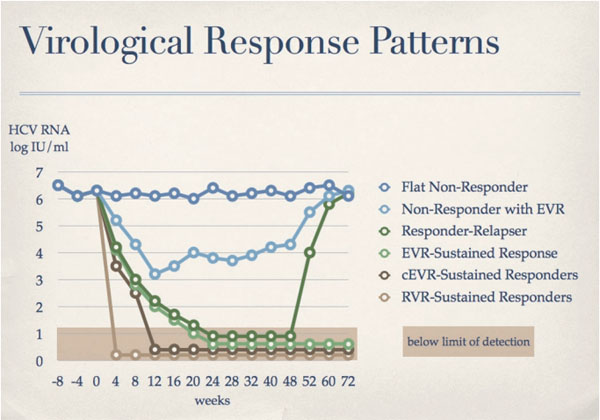
Abb. 1: Therapieansprechen bei chronischer Hepatitis C
Die Ursachen des Nichtansprechens wurden in mehreren Studien untersucht. Der wichtigste virale Faktor ist der HCV-Genotyp. Infektionen mit den Genotypen 2 und 3 werden häufiger erfolgreich behandelt als Infektionen mit dem Genotyp 1 (Abb. 2). Ebenfalls wichtig ist die Viruslast vor Behandlungsbeginn. Patienten mit Genotyp 1 und einer Viruslast über 2 Millionen Kopien pro ml haben ein signifikant schlechteres Ansprechen als Patienten mit tieferer Viruslast.
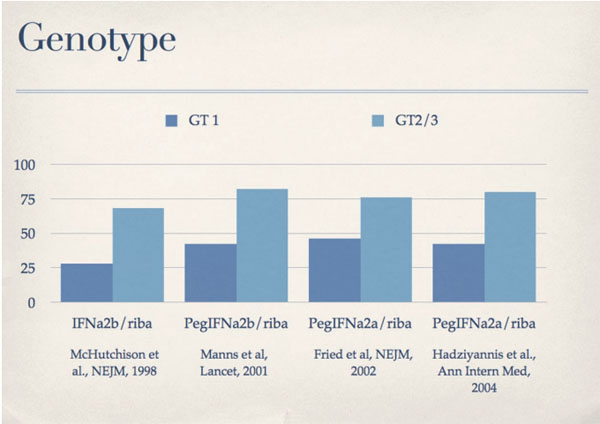
Abb. 2: Das Therapieansprechen ist maßgeblich vom HCV-Genotyp abhängig
Die wichtigsten Wirtsfaktoren für das Therapieansprechen sind Ethnizität, Geschlecht, Alter, Körpergewicht, Insulinresistenz, Diabetes mellitus, Fibrosestadium der Leber und die Leberverfettung. In verschiedenen Studien wurde immer wieder festgestellt, dass African-Americans viel schlechter ansprechen als Kaukasier und Asiaten. Männliches Geschlecht, Alter über 40, Übergewicht und Diabetes verringern die Erfolgsaussichten. Auch und bei Leberverfettung und Leberzirrhose zeigt sich ein signifikant schlechteres Ansprechen.
Kürzlich veröffentlichte Ergebnisse von genetischen Assoziationsstudien haben interessante Zusammenhänge zwischen dem Therapieansprechen und einer Allel-Variante des Interleukin 28B (IL28B) Genes aufgezeigt.1-3 Ge und Koautoren identifizierten die zwei unterschiedlichen Allele mit einem so genannten „single nucleotide polymorphism“ (SNP) etwa 3 Kilobasen vom IL28B Gen entfernt. An dieser Stelle kann entweder ein Cytosine (C) oder ein Thymidine (T) vorliegen. Patienten, die homozygot für das T Allel (T/T Genotyp) sind, haben eine SVR von unter 30%, Patienten mit einem C/C Genotyp aber einen SVR von über 75%.2 Interessanterweise ist die Häufigkeit des „schlechten“ T Allels viel höher bei African-Americans als bei European-Americans oder bei Asiaten. Damit könnte also das unterschiedliche Ansprechen von African-Americans, Kaukasiern und Asiaten erklärt werden (Abb. 3).
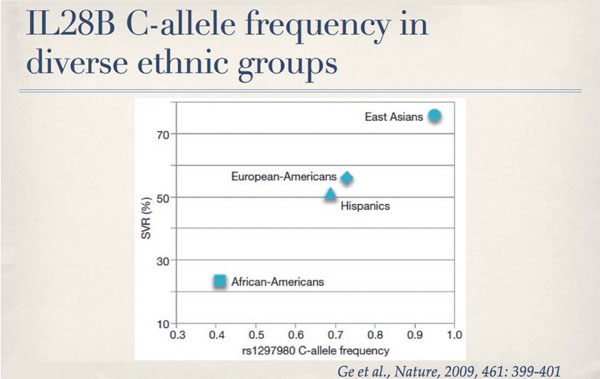
Abb. 3: Die Häufigkeit des für das Therapieansprechen günstigen C-Allels ist bei Asiaten höher als bei Amerikanern Europäischer Abstammung. African-Americans mit einer tiefen C-Allel-Häufigkeit haben auch eine tiefe Sustained Virological Response (SVR) Rate
Über welche Mechanismen diese Allelvarianten das Ansprechen auf die Interferontherapie beeinflussen ist gegenwärtig noch nicht klar. IL28B kodiert für Interferon lambda 3 (IFN-l3). Lambda Interferone sind eine 2003 entdeckte Gruppe von antiviral aktiven Substanzen, die ähnlich wie die alpha/beta Interferone wirken.4 Lambda Interferone wirken auch gegen HCV.5 Wie genau nun aber genetische Veranlagungen im IFN-l3 Gen das Ansprechen auf IFN-a Therapien beeinflussen, werden zukünftige Untersuchungen noch aufdecken müssen.
Prä-Aktivierung des endogenen IFN-Systems verhindert Ansprechen auf pegIFNa
Die Interaktionen zwischen HCV und dem angeborenen Immunsystem (innate immunity) wurden in den letzten Jahren von mehreren Gruppen intensiv untersucht. Die Primärinfektion mit HCV führt häufig zu einer chronischen Hepatitis C (ca. 70%). Es hat deshalb schon lange interessiert, welche Mechanismen HCV entwickelt hat, um die meist hochwirksame immunologische Abwehr auszuschalten. In Zellkultur-Experimenten konnte sehr schön gezeigt werden, dass ein Virusprotein, die NS3/4A Protease, zwei wichtige Signalübermittler für die Induktion der körpereigenen Interferone spaltet und inaktiviert, nämlich TRIF und MAVS.6, 7 Da diese Spaltung und Inaktivierung in Zellen äußerst effizient ist, konnte man davon ausgehen, dass HCV auch die Aktivierung des körpereigenen IFN-Systems in der Leber von infizierten Patienten verhindert. Überraschenderweise war dies aber nicht der Fall. Sowohl bei Schimpansen als auch bei Patienten mit CHC findet sich häufig eine überaus starke Induktion von IFN stimulierten Genen (ISGs) (Abb. 4).
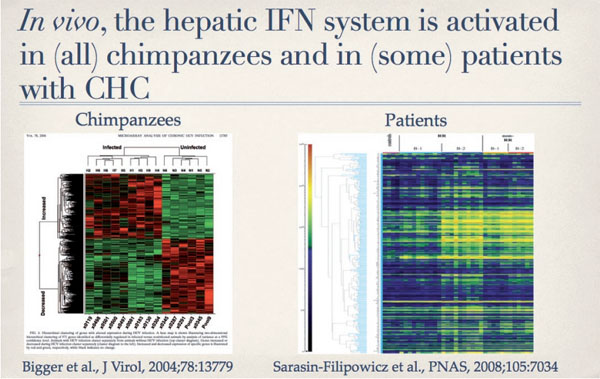
Abb. 4: Induktion von Interferon stimulierten Genen (ISG) in der Leber von Schimpansen und Patienten mit CHC
Trotz dieser Aktivierung des endogenen IFN-Systems persistiert jedoch das Virus in der Leber. Entweder sind also die ISGs nur in nicht-infizierten Hepatozyten hochreguliert, aber nicht in den virus-befallenen Hepatozyten, und sind deshalb hinsichtlich viraler Replikation wirkungslos. Oder aber HCV ist in der Lage, die entscheidenden antiviralen Effektorsysteme zu neutralisieren. Gegenwärtig sind die Daten nicht hinreichend, um zwischen diesen beiden Möglichkeiten zu entscheiden.
Die Induktion des körpereigenen IFN-Systems in der Leber ist aber nicht nur unwirksam in Bezug auf die spontane Elimination des viralen Infektes, sondern verhindert auch das Ansprechen auf therapeutisch verabreichtes pegIFNá. Diese überraschende Entdeckung wurde von drei Arbeitsgruppen unabhängig gemacht.8-10 In unserer Arbeitsgruppe haben wir 16 Patienten mit CHC untersucht, die mit pegIFNá und Ribavirin therapiert wurden. 10 Patienten hatten einen RVR und dann später auch einen SVR.6 Patienten sprachen nicht auf die Behandlung an (primary non-responders). Bei allen Patienten wurden vor Behandlung und 4 Stunden nach der ersten Injektion von pegIFNα eine Leberbiopsie durchgeführt und Leukozyten aus dem Blut isoliert. Die globale Genexpression wurde in diesen Proben mit Microarrays analysiert. Zusätzlich wurde auch die IFN Signalübermittlung untersucht. Die Auswertung ergab, dass die non-responder schon vor der Therapie eine starke Induktion von ISGs hatten, und dass die Injektion von pegIFNα zu keiner weiteren Erhöhung der Genexpression führte. Im Gegensatz dazu hatten die 10 Patienten mit einer RVR und SVR keinerlei Zeichen der Geninduktion vor Behandlung, reagierten dann aber auf pegIFNamit einer raschen und starken Expression von ISGs (Abb. 5). Bei den Leukozyten zeigten sich keine Unterschiede zwischen den beiden Patientengruppen.
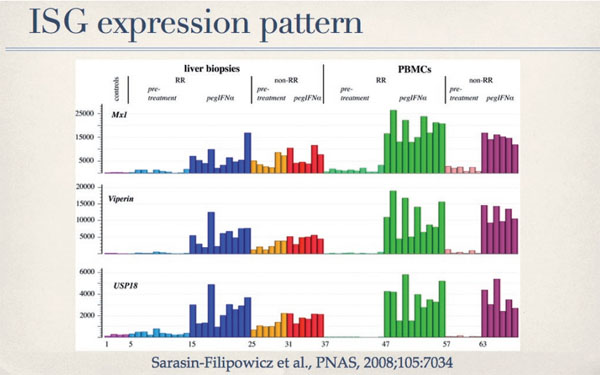
Abb. 5: Expression von 3 repräsentativen ISGs in der Leber und in Leukozyten von Patienten mit CHC. 4 Kontrollpatienten ohne CHC (Linien 1-4), 10 Patienten mit raschem Therapieansprechen (Rapid Response, RR), sowie 6 Patienten mit fehlendem Ansprechen (nonRR) wurden vor der Therapie (für RR Linien 5-14; für non-RR Linien 25-30) und 4 Stunden nach der ersten Injektion von pegIFN a untersucht (für RR Linien 15-24; für non-RR Linien 31-37)
Alle drei Arbeitsgruppen identifizierten in ihren Arbeiten eine Gruppe von Genen, deren Expression in der Leber das Ansprechen auf die Therapie voraussagen lässt.8-10 Die Entwicklung von prädiktiven Tests ist im Gange, aber gegenwärtig gibt es noch keine validierten Verfahren, welche im Sinne einer individualisierten Medizin das Ansprechen beim einzelnen Patienten mit genügender Sicherheit voraussagen können.
Mögliche Ansätze zur Verbesserung
Aus dem aufgezeigten Zusammenhang zwischen Prä-Aktivierung des körpereigenen IFN-Systems und dem Nicht-Ansprechen auf die Behandlung lässt sich die Hypothese ableiten, dass ein Zurücksetzen des körpereigenen IFN-Systems in einen nicht-induzierten Zustand auch diese Patienten wieder zu IFNá-Respondern macht, die gegenwärtig nicht auf die Standardtherapie mit pegIFNá und Ribavirin ansprechen können. Denkbar wäre hier z.B. der Einsatz von Antikörpern gegen IFNá, analog zum Einsatz von TNFá Antikörpern beim Morbus Crohn. Eine hochinteressante alternative Perspektive bieten erste noch nicht bestätigte Resultate, wonach die Unterdrückung der viralen Replikation mit antiviralen Medikamenten (NS3/4A Protease-Inhibitoren, NS5B Polymerase-Inhibitoren oder Cyclophilin-Inhibitoren wie Debio-025) ebenfalls zu einem signifikanten Rückgang der ISG-Induktion führen kann. Falls dies bestätigt wird, könnte damit für viele IFNá-Non-Responder eine erneute Behandlung mit einer Kombination von STAT-C Medikamenten (specifically targeted antiviral therapy against HCV) mit pegIFNá und Ribavirin zu einer viel versprechenden Therapie mit guten Heilungschancen avancieren.
Literatur
1 Tanaka Y, Nishida N, Sugiyama M, Kurosaki M, Matsuura K, Sakamoto N, Nakagawa M, et al. Genome-wide association of IL28B with response to pegylated interferon-alpha and ribavirin therapy for chronic hepatitis C. Nat Genet 2009;41:1105-1109.
2 Ge D, Fellay J, Thompson AJ, Simon JS, Shianna KV, Urban TJ, Heinzen EL et al. Genetic variation in IL28B predicts hepatitis C treatment-induced viral clearance. Nature 2009.
3 Suppiah V, Moldovan M, Ahlenstiel G, Berg T, Weltman M, Abate ML, Bassendine M, et al. IL28B is associated with response to chronic hepatitis C interferon-alpha and ribavirin therapy. Nat Genet 2009;41:1100-1104.
4 Kotenko SV, Gallagher G, Baurin VV, Lewis-Antes A, Shen M, Shah NK, Langer JA, et al. IFN-lambdas mediate antiviral protection through a distinct class II cytokine receptor complex. Nat Immunol 2003;4:69-77.
5 Robek MD, Boyd BS, Chisari FV. Lambda interferon inhibits hepatitis B and C virus replication. J Virol 2005;79:3851-3854.
6 Li K, Foy E, Ferreon JC, Nakamura M, Ferreon AC, Ikeda M, Ray SC, et al. Immune evasion by hepatitis C virus NS3/4A protease-mediated cleavage of the Toll-like receptor 3 adaptor protein TRIF. Proc Natl Acad Sci U S A 2005;102:2992-2997.
7 Meylan E, Curran J, Hofmann K, Moradpour D, Binder M, Bartenschlager R, Tschopp J. Cardif is an adaptor protein in the RIG-I antiviral pathway and is targeted by hepatitis C virus. Nature 2005;437:1167-1172.
8 Chen L, Borozan I, Feld J, Sun
J, Tannis LL, Coltescu C, Heath-
cote J, et al. Hepatic gene expression discriminates
responders and nonresponders in treatment of chronic hepatitis C viral
infection. Gastroenterology 2005;128:1437-1444.
9 Sarasin-Filipowicz M, Oakeley EJ, Duong FH, Christen V, Terracciano L, Filipowicz W, Heim MH. Interferon signaling and treatment outcome in chronic hepatitis C. Proc Natl Acad Sci U S A 2008;105:7034-7039.
10 Asselah T, Bieche I, Narguet S, Sabbagh A, Laurendeau I, Ripault MP, Boyer N, et al. Liver gene expression signature to predict response to pegylated interferon plus ribavirin combination therapy in patients with chronic hepatitis C. Gut 2008;57:516-524.





