Doris Schacherer1, Klaus Schlottmann2
Diagnostik und Staging des
HCC
Die Symptome des HCC sind oft die eines beginnenden Leberversagens, seltener rechtsseitige Oberbauchschmerzen bedingt durch die Kapselspannung oder Zeichen von Aszites, Gewichtsverlust, Müdigkeit und Ikterus. 40% der Patienten mit HCC zeigen jedoch keine klinischen Auffälligkeiten, was die Frühdiagnose deutlich erschwert (Bruix 2001). Zeigen die Patienten spezifische klinische Zeichen, ist der Tumor oftmals bereits weit fortgeschritten und kurative Therapieoptionen fehlen. Deshalb sind Screeninguntersuchungen im Zusammenhang mit dem hepatozellulären Karzinom sicherlich sinnvoll und wichtig.
ÜBERWACHUNG BEI LEBERZIRRHOSE
Prinzipiell sollten Screeninguntersuchungen nach standardisierten Verfahren erfolgen. Screening beginnt mit der Entscheidung, wann das Risiko für die Entwicklung eines HCC hoch genug ist, um Vorsorgeuntersuchungen einzuleiten, welche und wie oft Screeninguntersuchungen durchgeführt werden sollen und wie mit pathologischen Ergebnissen umgegangen wird. Hauptziel sollte immer sein, ein sich eventuell entwickelndes hepatozelluläres Karzinom in einem frühen Stadium zu diagnostizieren, in dem der Tumor prinzipiell kurativ behandelt werden kann.
Tumormarker
Der in der Diagnostik des HCC am häufigsten verwendete Tumormarker ist das Alpha-Fetoprotein (AFP), ein a1-Globulin, welches in fetalen Zellen, aber auch in regenerierenden und malignen Hepatozyten gebildet wird. Das AFP ist der am meisten untersuchte und gebräuchlichste Marker in der Detektion und Diagnose des HCC. Die Sensitivität dieses Markers ist mit 39-65% niedrig, die Spezifität liegt zwischen 62 und 94% und der positive Vorhersagewert lediglich bei 9-50% (Farinati 2006). Bei Patienten mit Leberzirrhose und/oder chronischer Hepatitis C-Infektion können hohe AFP-Werte einerseits eine Exazerbation der Infektion, andererseits das Vorhandensein eines hepatozellulären Karzinoms bedeuten. Somit scheint der AFP-Titer als Screeningtest allein unzureichend. Die Bedeutung anderer serologischer Marker wie des Des-gamma-carboxy prothrombins (DGCP) oder Fraktionen des AFP (AFP-L3) ist in diesem Zusammenhang bisher nicht belegt.
Ultraschall
Seit den frühen 80iger Jahren steht die Sonographie in der Diagnostik hepatischer Raumforderungen zur Verfügung. Ihre Sensitivität zur Detektion des HCC reicht von 35 bis 84% abhängig von der Erfahrung des Untersuchers und der zur Verfügung stehenden Gerätetechnik (Peterson 2001). In der Zirrhoseleber ist die Differentialdiagnose von kleinen malignen Raumforderungen zu Regeneratknoten, dysplastischen Knoten oder fokalen Fettverteilungsstörungen schwierig (Liu 2003, Taouli 2006). Die Kombination aus AFP-Bestimmung und Sonographie verbessert die Detektionsrate, erhöht aber auch die Zahl falsch positiver Ergebnisse (Zhang 1999). Zhang et al. zufolge reduziert der Einsatz von AFP und Ultraschall alle 6 Monate die Mortalitätsrate des HCC um 37% (Zhang 2004). Die Überwachungsintervalle bei Patienten mit Leberzirrhose betreffend, verdoppelt sich sowohl durch halbjährliche, als auch durch jährliche Screeningverfahren die Zahl potentieller Kandidaten für eine Lebertransplantation (Trevisani 2002). Insgesamt besteht kein Zweifel an der Wichtigkeit von Screeninguntersuchungen bei Patienten mit Leberzirrhose.
SOLITÄRE LEBERRAUMFORDERUNG IN DER ZIRRHOSELEBER
Die Charakterisierung fokaler Läsionen in der zirrhotischen Leber ist für das optimale weitere Management dieser Patienten zwingend notwendig.
Ultraschall
Die Sonographie ermöglicht eine schnelle und nicht-invasive Darstellung des Leberparenchyms, wobei eine komplette Untersuchung der Leber bei entsprechendem Habitus des Patienten im Einzelfall unmöglich sein kann. Die Darstellbarkeit kleiner hepatozellulärer Karzinome ist vor allem von der Erfahrung des Untersuchers abhängig, interessanterweise hat sich die Sensitivität der Sonographie bezüglich der HCC-Detektion trotz der technischen Innovationen in den letzten Jahren nicht verbessert (Lencioni 2005). Im Ultraschall stellen sich kleine HCC als rundliche oder ovale Läsionen mit glatter oder unregelmäßiger Begrenzung dar und können uninodulär, multifokal oder diffus auftreten. Im Vergleich zum übrigen Leberparenchym können diese Raumforderungen echoarm, isoechogen oder echoreich sein. In der Doppler- oder Powerdopplersonographie zeigt sich ein gefäßreicher Tumor mit intratumoralen arteriellen Gefäßsignalen. In kleinen Läsionen können diese Signale jedoch fehlen (Nekrose), so dass die Sonographie das in der Computertomographie darstellbare hypervaskularisierte Gefäßmuster nicht immer bestätigen kann. Insgesamt wird aber durch die Doppler- und Powerdopplersonographie die Treffsicherheit des Ultraschalls in der Diagnostik des HCC erhöht (Lencioni 1996).
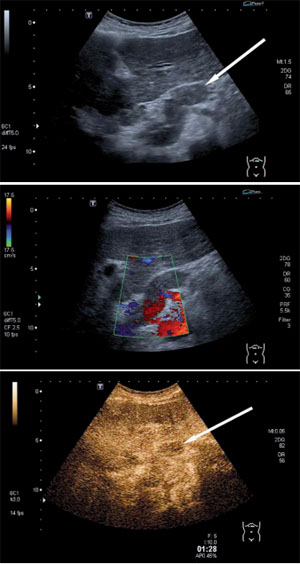
Abb. 1: 78-jähriger Patient mit äthyltoxischer Leberzirrhose
a) B Bild-sonographische Darstellung eines Thrombus in der Pfortader (Pfeil)
b) Duplexsonographische Bestätigung des Thrombus
c) Kontrastmittelsonographisch Perfusion der Thrombose und somit Sicherung eines Tumorthrombus (Pfeil)
Kontrastmittelsonographie
HCC, die größer als 3 cm sind, können mit hoher Genauigkeit sonographisch diagnostiziert werden. Was die kleineren hepatozellulären Karzinome betrifft, so stellt die Kontrastmittelsonographie eine hilfreiche ergänzende Methode dar (Rickes 2003). Die Sensitivität der Kontrastmittelsonographie in der Diagnostik des HCC liegt in Abhängigkeit von der Größe der Raumforderung bei 89-96%, die Spezifität bei 60-97% und der positive Vorhersagewert der Methode bei 96% (Quaida 2004, Gaiani 2004, D`Onofrio 2008, Strobel 2008, Forner 2008, Xu 2008).
Typische kontrastmittelsonographische Kriterien des HCC sind ein intratumorales Gefäßsignal mit chaotischer Perfusion in der früharteriellen Phase nach Kontrastmittelinjektion, gefolgt von einem schnellen „wash-out“ Phänomen und einem Perfusionsdefekt in der portalvenösen und Spätphase (Rickes 2002). Regeneratknoten hingegen zeigen keine früharterielle Kontrastmittelaufnahme und stellen sich in den folgenden Phasen relativ echogleich zum übrigen Leberparenchym dar.
Mittelgradig und schlecht differenzierte HCC zeigen ein schnelleres „wash-out“ in der portalvenösen Phase und in der Spätphase als hochdifferenzierte Karzinome (Liu 2007). Neuere Studien zeigen, dass die Kontrastmittelsonographie auch zur Differenzierung eines Tumorthrombus der Pfortader (stark perfundiertes Gewebe) von einem Gerinnungsthrombus (keine Perfusion) hilfreich ist (Tarantino 2006, Piscaglia 2007) (Abb. 1).
Zum jetzigen Zeitpunkt ist noch unklar, ob die Kontrastmittelsonographie die Computertomographie oder die Magnetresonanztomographie in der Charakterisierung suspekter Leberläsionen ersetzen können wird. Allerdings zeigen neue große Studien wie die DEGUM-Multicenterstudie zur Evaluation von 1.349 Patienten mit unklarem Lebertumor (Strobel 2008) den heutigen Stellenwert der Methode.
Computertomographie (CT)
Die dreiphasische spiralförmige computertomographische Erfassung des Leberparenchyms, welches die Darstellung vaskulärer Raumforderungen als Hinweis auf ein vorliegendes HCC ermöglicht, ist in der klinischen Diagnostik zur Standardmethode geworden. Trotz der beträchtlichen technologischen Fortschritte bleibt die Sensitivität der Computertomographie in der Diagnostik kleiner HCC relativ gering. Nur 10 bis 43% aller kleiner 1 cm großen Läsionen können so dargestellt werden (Lencioni 2005).
Magnetresonanztomographie (MRT)
Die MRT hat über die letzten Jahre hinweg durch die Entwicklung verschiedener leberspezifischer Kontrastmittel deutlich an Bedeutung gewonnen. Bei Patienten mit Leberzirrhose hat die Kontrastmittel-MRT in der Diagnostik von HCC größer oder gleich 1 cm eine hohe Sensitivität, während die Darstellbarkeit kleinerer Läsionen nach wie vor nur eingeschränkt möglich ist (Bhartia 2003). Lutz et al. beschrieben deutliche Unterschiede der Kontrastmittelaufnahme im T1-gewichteten MRT nach Verwendung von Gadolinium – oder superparamagnetischen Eisenoxid (SPIO) – Kontrastmitteln (Lutz 2005). Einer Studie von Kim YK et al. zufolge zeigte SPIO – MRT ähnliche Genauigkeit, Sensitivität und positiven Vorhersagewert in der Detektion des HCC´s wie das multiphasische CT (Kim 2006). Stoker et al. konnten in diesem Zusammenhang sogar die Überlegenheit des SPIO – MRT im Vergleich zum Spiral – CT zeigen (Stoker 2002). Ein entscheidender Vorteil des SPIO – MRT gegenüber der Computertomographie ist sicherlich die fehlende Strahlenbelastung.
Zusammenfassend haben beide bildgebenden Verfahren (CT und MRT mit Kontrastmittel) eine Treffsicherheit in der Diagnostik des HCC von über 80-90% (Llovet 2006) und haben die konventionelle und die CT-Angiographie in diesem Zusammenhang abgelöst.
In einem Review über die Bedeutung des AFP, des Ultraschall, der Computertomographie und der Kernspintomographie in der Diagnostik hepatozellulärer Karzinome wurde – zusammengefasst aus 14 sonographischen Studien – für die Sonographie eine Sensitivität von 69% und eine Spezifität von 97% angegeben. Die Computertomographie – ausgewertet aus 10 Studien – hatte eine Sensitivität von 68% und eine Spezifität von 93%, die MRT - ausgewertet aus 9 Studien – hatte eine Sensitivität von 81% und eine Spezifität von 85%. Die Sensitivität des AFP´s unterlag extremen Schwankungen (Colli 2006). Im Einzelfall detektieren die CT/MRT und die Kontrastmittelsonographie teilweise unterschiedliche Herde, so dass bei negativen Ergebnissen die jeweils andere Methode sinnvoll eingesetzt werden kann.
Stagingsysteme des HCC
Die Prognose maligner Tumoren ist prinzipiell vom Tumorstadium bei Erstdiagnose abhängig und das Tumorstadium entscheidet über therapeutische Maßnahmen. Gut definierte und generell akzeptierte Stagingsysteme existieren für annähernd alle Tumorentitäten. Hier stellt das HCC eine Ausnahme dar. Verschiedene Stagingsysteme sind weltweit verbreitet, ohne dass Konsens darüber besteht, welches davon das Beste ist.
In der Vergangenheit wurde das HCC durch das TNM- oder Okuda-Stagingsystem klassifiziert. Das TNM-System wurde wiederholt modifiziert, ist aber aktuell noch immer prognostisch zu ungenau. Außerdem basiert es auf den pathologischen Ergebnissen, ohne dass die Leberfunktion berücksichtigt wird.
Das klinisch am häufigsten verwendete Stagingsystem ist das von Okuda et al. (Yan 2003), welches klinische Kriterien wie Aszites, Serumalbumin, Bilirubin und Tumorgröße mit einbezieht. Dieses Stagingsystem identifiziert Patienten mit einem HCC im Endstadium, ist aber ungeeignet zur Klassifikation von Patienten mit HCC in früheren Stadien. Das Child-Pugh-System berücksichtigt lediglich die Leberfunktion und scheint somit ebenfalls nicht optimal. Das System der „Cancer of the Liver Italian Program (CLIP)” bezieht sich auf das Child-Pugh-Stadium, den AFP-Wert, die Tumormorphologie und eine eventuelle Gefäßinvasion. Es wird vielfach zur Prognosebestimmung von Patienten mit HCC verwendet.
Das „Barcelona-Clinic-Liver-Cancer (BCLC)” Stagingsystem ist derzeit das einzige System welches Tumorstadium, Leberfunktion, Allgemeinzustand der Patienten und tumorassoziierte Symptome berücksichtigt. Der Hauptvorteil dieses Systems ist, dass es Staging mit Therapieoptionen verbindet und eine Einschätzung der Prognose basierend auf den jeweiligen Responseraten der verschiedenen Therapiemaßnahmen ermöglicht (Marrero 2005). Es selektioniert Patienten, die von kurativen Therapiemaßnahmen profitieren von denjenigen bei denen im Endstadium der Erkrankung nur noch palliative Optionen zur Verfügung stehen (Tab. 1).
| Kriterien | Einteilung | |
|---|---|---|
| Okuda | Tumorgröße, Aszites, Labor | I – III |
| TNM (UICC) | Tumorgröße, Anzahl pathologischer lymphknoten, Metastasen | I – IV |
| CLIP | Okuda + AFP | 0 – 6 |
| BCLC | PST + Tumorcharakteristika + hepatische Parameter | A – D |
Tab. 1: Derzeit gebräuchliche Stagingsysteme des HCC (CLIP=Cancer of the liver italian program scoring system, BCLC=Barcelona clinic liver cancer staging classification)
Histologie
Mehr als die Hälfte aller sich in der zirrhotischen Leber entwickelnden Knoten sind hepatozelluläre Karzinome und fast 90% dieser malignen Läsionen lassen sich durch sonographisch gesteuerte Biopsie histologisch sichern (Caturelli 2004). Zeigt die initiale Gewebeprobe keine malignen Zellen, so lässt sich bei einem Drittel der Patienten durch wiederholte Biopsieentnahme eine Diagnose stellen, insbesondere wenn die erste Gewebeprobe nekrotisches Gewebe zeigte oder aber ein falsch-negatives Ergebnis bedingt durch ein eigentlich vorliegendes hochdifferenziertes HCC vorlag (Caturelli 2002).
Ein Problem der Biopsieentnahme suspekter Leberraumforderungen stellt der Umgang mit einem negativen Ergebnis dar. Einerseits ist bei sehr kleinen Raumforderungen gelegentlich unklar, ob die suspekte Läsion tatsächlich getroffen wurde, andererseits fällt die Differentialdiagnose zwischen einem hochdifferenzierten HCC und normalem Lebergewebe oft schwer. Auch die Unterscheidung zwischen hochgradig dysplastischen Knoten und einem HCC ist schwierig. Man kann argumentieren, dass die Diagnose eines hochgradig dysplastischen Knotens der eines HCC gleichbedeutend ist und entsprechend therapiert werden muss. Allerdings ist unklar, wieviele dieser Knoten tatsächlich in hepatozelluläre Karzinome übergehen oder umgekehrt – wieviele nicht maligne Tumore man so unnötig therapieren würde.
Die Rate von Stichkanalmetastasen nach Biopsie eines potentiellen HCC´s wurde bisher nicht ausreichend untersucht, scheint aber sehr selten und therapeutisch angehbar zu sein.
Das Risiko der perkutanen Biopsieentnahme ist gering, insbesondere in Anbetracht des damit verbundenen diagnostischen Gewinns.
Diagnostischer Ablauf
Die Prävalenz des HCC´s in sonographisch diagnostizierten
Leberläsionen in der Zirrhoseleber hängt stark von der Größe der Raumforderung
ab. Die Hälfte aller weniger als 1 cm großen Knoten ist nicht maligne. Bei den
meisten der über 2 cm großen Knoten hingegen handelt es sich um hepatozelluläre
Karzinome (Bruix 2001). Die Differentialdiagnose zwischen kleinen HCC und
Regeneratknoten stellt eine Herausforderung an alle bild-
gebenden Verfahren der Leber dar.
Deshalb sollte in diesen Fällen alle drei Monate eine Ultraschalluntersuchung der Leber erfolgen – bis zu dem Zeitpunkt, an dem die Raumforderung an Größe zunimmt. Sobald die Grenze von über 1 cm Größe erreicht ist, müssen weitere diagnostische Methoden eingesetzt werden. Ist die Raumforderung zwischen 1 und 2 cm groß, muss die diagnostische Bestätigung durch zwei verschiedene bildgebende Verfahren (CT, MRT oder Ultraschall mit Kontrastmittel) erfolgen. Ist auch durch zwei dieser bildgebenden Verfahren keine Diagnose möglich, muss eine Biopsieentnahme durchgeführt werden. Hierbei ist zu bedenken, dass das negative histologische Ergebnis aus einer hypervaskularisierten Läsion in der Zirrhoseleber Malignität nicht ausschließt.
Bei einer Raumforderung von über 2 cm Größe in der Zirrhoseleber und den typischen Kriterien eines HCC in der Bildgebung (vor allem der Hyperperfusion) oder aber bei einem AFP-Wert von >400 ng/ml wird von einem HCC ausgegangen. Eine Biopsie ist nur dann notwendig, wenn sich die Läsion in der Bildgebung atypisch darstellt.
PATIENT MIT BEKANNTEM HCC
Tumormarker
Die Entwicklung sensitiver und spezifischer Tumormarker des hepatozellulären Karzinoms trägt nicht nur zu dessen Diagnostik, sondern auch zur Verlaufsbeurteilung und prognostischen Einschätzung dieser Tumorentität bei. Der AFP-Wert kann zur Bestätigung eines HCC bei einer neu diagnostizierten Raumforderung bei Patienten mit Leberzirrhose hilfreich sein. Allerdings besteht kein statistischer Zusammenhang zwischen dem AFP-Wert, dem gesamten Tumorvolumen und der Wachstumsgeschwindigkeit der malignen Raumforderung (Bolondi 1990). Die Tumormarker sind in der Verlaufsbeurteilung, in der Einschätzung der Prognose und in der Beurteilung des Therapieerfolges hilfreich.
1. Bosch FX, Ribes J, Diaz M, Cleries R.Primary liver cancer: worldwide incidence and trends. Gastroenterology 2004;127:5-16.
2. Bruix J, Sherman M, Llovet JM, Beaugrand M, Lencioni R, Burroughs AK, Christensen E, Pagliaro L, Colombo M, Rodés J; EASL Panel of Experts on HCC. Clinical management of hepatocellular carcinoma. Conclusions of the Barcelona-2000 EASL conference. European Association for the Study of the Liver. J Hepatol. 2001;35:421-430.
3. Farinati F, Marino D, De Giorgio M, Baldan A, Cantarini M, Cursaro C, Rapaccini G, Del Poggio P, Di Nolfo MA, Benvegnu L, Zoli M, Borzio F, Bernardi M, Trevisani F (the Italian Liver Cancer Group). Diagnostic and prognostic role of a-fetoprotein in hepatocellular carcinoma: both or neither? Am J Gastroenterol 2006;101:524-532.
4. Peterson MS, Baron RL. Radiologic diagnosis of hepatocellular carcinoma. Clin Liver Dis 2001;5:123-144.
5. Liu WC, Lim JH, Park CK, Kim MJ, Kim SH, Lee SJ, Lee WJ, Lim HK. Poor sensitivity of sonography in detection of hepatocellular carcinoma in advanced liver cirrhosis: accuracy of pretransplantation sonography in 118 patients. Eur Radiol 2003;13:1693-1698.
6. Taouli B, Krinsky GA. Diagnostic imaging of hepatocellular carcinoma in patients with cirrhosis before liver transplantation. Liver Transpl 2006;12:1-7.
7. Zhang BH, Yang BH. Combined alpha fetoprotein testing and ultrasonography as a screening test for primary liver cancer. J Med Screen 1999;6:108-110.
8. Zhang BH, Yang BH, Tang ZY. Randomized controlled trial of screening for hepatocellular carcinoma. J Cancer Res Clin Oncol 2004;130:417-422.
9. Trevisani F, De NS, Rapaccini G, Farinati F, Benvegnu L, Zoli M, Grazi GL, Del PP, Di N, Bernardi M; Italian Liver Cancer Group. Semiannual and annual surveillance of cirrhotic patients for hepatocellular carcinoma: effects on cancer stage and patient survival (Italian experience). Am J Gastroenterol 2002;97:734-744.
10. Lencioni R, Cioni d, Della Pina C, Crocetti L, Bartolozzi C. Imaging diagnosis. Semin Liver Dis 2005;2:162-170.
11. Lencioni R, Pinto F, Armillotta N, Bartolozzi C. Assessment of tumor vascularity in hepatocellular carcinoma: comparison of power Doppler US and color Doppler US. Radiology 1996;201:353-358.
12. Rickes S, Schulze S, Neye H, Ocran KW, Wermke W. Impro-ved diagnosing of small hepatocellular carcinomas by echo- enhanced power Doppler sonography in patients with cirrhosis. Eur J Gastroenterol Hepatol 2003;15:893-900.
13. Quaida E, Calliada F, Bertolotto M, Rossi S, Garioni L, Rosa L, Pozzi-Mucelli R. Characterization of focal liver lesions with contrast-specific US modes and a sulfur hexafluoride-filled microbubble contrast agent: diagnostic performance and confidence. Radiology 2004;232:420-430.
14. Gaiani S, Celli N, Piscaglia F, Cecilioni L, Losinno F, Giangregorio F, Mancini M, Pini P, Fornari F, Bolondi L. Usefulness of contrast-enhanced perfusional sonography in the assessment of hepatocellular carcinoma hypervascular at spiral computed tomography. J Hepatol 2004;41:421-426.
15. D´Onofrio M, Faccioli N, Zamboni G, Malagò R, Caffarri S, Fattovich G, Mucelli RP. Focal liver lesions in cirrhosis: value of contrast-enhanced ultrasonography compared with Doppler ultrasound and alpha-fetoprotein levels. Radiol Med 2008;113:978-991.
16. Strobel D, Seitz K, Blank W, Schuler A, Dietrich C, von Herbay A, Friedrich-Rust M, Kunze G, Becker D, Will U, Kratzer W, Albert FW, Pachmann C, Dirks K, Strunk H, Greis C, Bernatik T. Contrast-enhanced Ultrasound for the Characterization of Focal Liver Lesions - Diagnostic Accuracy in Clinical Practice (DEGUM multicenter trial). Ultraschall Med 2008;29:499-505.
17. Forner A, Vilana R, Ayuso C, Bianchi L, Solé M, Ayuso JR et al. Diagnosis of hepatic nodules 20 mm or smaller in cirrhosis: Prospective validation of the noninvasive diagnostic criteria for hepatocellular carcinoma. Hepatology 2008;47:97-104.
18. Xu HX, Xie XY, Lu MD, Liu GJ, Xu ZF, Zheng YL, Liang JY, Chen LD. Contrast-enhanced sonography in the diagnosis of small hepatocellular carcinoma < or =2 cm. J Clin Ultrasound 2008;36:257-266.
19. Rickes S, Ocran K, Schulze S, Wermke W. Evaluation of Doppler sonographic criteria for the differentiation of hepatocellular carcinomas and regenerative nodules in patients with liver cirrhosis. Ultraschall Med 2002;23:83-90.
20. Liu GJ, Xu HX, Lu MD, Xie XY, Xu ZF, Zheng XL, Liang JY. Correlation between enhancement pattern of hepatocellular carcinoma on real-time contrast-enhanced ultrasound and tumor cellular differentiation on histopathology. Br J Radiol 2007;80:321-330.
21. Tarantino L, Francica G, Sordelli L, Esposito F, Giorgio A, Sorrentino P et al. Diagnosis of benign and malignant portal vein thrombosis in cirrhotic patients with hepatocellular carcinoma: color Doppler US, contrast-enhanced US, and fine-needle biopsy. Abdom Imaging 2006;31:537-544.
22. Piscaglia F, Gianstefani A, Ravaioli M, Sagrini E, Lodato F, Morelli C et al. Reliability of imaging techniques in assessing portal venous thrombosis in patients with hepatocellular carcinoma candidates for liver transplantation. Ultraschall Med 2007;28:S35.
23. Bhartia B, Ward J, Guthrie JA, Robinson PJ. Hepatocellular carcinoma in cirrhotic livers: double-contrast thin-section MR imaging with pathologic correlation of explanted tissue. AJR Am J Roentgenol 2003;180:577-584.
24. Lutz AM, Willmann JK, Goepfert K, Marincek B, Weishaupt D. Hepatocellular carcinoma in cirrhosis: enhancement patterns at dynamic gadolinium- and superparamagnetic iron oxide-enhanced T1-weighted MR imaging. Radiology 2005;237:520-528.
25. Kim YK, Kwak HS, Kim CS, Chung GH, Han YM, Lee JM. Hepatocellular carcinoma in patients with chronic liver disease: comparison of SPIO-enhanced MR imaging and 16-detector row CT. Radiology 2006;238:531-541.
26. Stoker J, Romijn MG, de Man RA, Brouwer JT, Weverling GJ, van Muiswinkel JM, Zondervan PE, Lameris JS, Ijzermans JN. Prospective comparative study of spiral computer tomography and magnetic resonance imaging for detection off hepatocellular carcinoma. Gut 2002;51:105-107.
27. Colli A, Fraquelli M, Casazza G, Massironi S, Colucci A, Conte D, Duca P. Accuracy of ultrasonography, spiral CT, magnetic resonance, and alpha-fetoprotein in diagnosing hepatocellular carcinoma: a systemic review. Am J Gastroenterol 2006;101:513-523.
28. Caturelli E, Solmi L, Anti M, Fusilli S, Roselli P, Andriulli A, Fornari F, Del Vecchio Blanco C, de Sio I. Ultrasound guided fine needle biopsy of early hepatocellular carcinoma complicating liver cirrhosis: a multicentre study.Gut 2004;53:1356-1362.
29. Bolondi L, Benzi G, Santi V, Gaiani S, Li Bassi SL, Zironi G, Mazziotti A, Sama C, Grigioni W, Gozzetti G et al. Relationship between alpha-fetoprotein serum levels, tumour volume and growth rate of hepatocellular carcinoma in a western population. Ital J Gastroenterol 1990;22:190-194.
30. Yan P, Yan LN. Staging of hepatocellular carcinoma. Hepatobiliary Pancreat Dis Int 2003;2:491-495.
30. Marrero JA, Fontana RJ, Barrat A, Askari F, Conjeevaram HS, Su GL, Lok AS. Prognosis of hepatocellular carcinoma: comparison of 7 staging systems in an american cohort. Hepatology 2005;41:707-716.





