Ulrich M. Lauer und Michael Bitzer, Tübingen
Medikamentöse Therapie des HCC
Blick in
die Zukunft
Bis zur klinischen Einführung des Multikinase-Inhibitors Sorafenib im Jahr 2007 gab es kein Medikament, das für die Therapie des Hepatozellulären Karzinomes (HCC) zugelassen war.
Dies lag nicht daran, dass es in den vergangenen Jahrzehnten nicht ausreichend klinische HCC-Studien gegeben hätte, in denen umfangreich die verschiedenartigsten Wirkstoffe getestet worden wären. Der Hauptgrund für diese missliche Lage liegt darin, dass es sich beim HCC nachgewiesenermaßen um eine weitestgehend Wirkstoff-resistente Tumorart handelt, d.h. der Tumor spricht auf die systemische Therapie mit herkömmlichen zytotoxischen, neuartigen monoklonalen Antikörpern bzw. small molecule Substanzen, immunmodulatorischen oder hormonellen Wirkstoffen bis dato allenfalls gering bis gar nicht an. Eine Verlängerung des Überlebens von HCC-Patienten konnte dementsprechend bisher außer für Sorafenib in keinem weiteren Fall gesichert werden. An diesem Umstand konnte auch die intensiv betriebene Forschung zu den pathogenetischen Grundlagen des HCC bislang nichts ändern.
Darüber hinaus gibt es auch bei der Therapie des HCC ein hohes Maß an primären & sekundären Resistenzen gegen Sorafenib. Dies wird dadurch verdeutlicht, dass die unter Monotherapie mit Sorafenib im Vergleich zu Placebo erzielte Verlängerung des Überlebens gemäß den Phase-III-Studien SHARP und ASIA/PACIFIC weniger als 3 Monate beträgt.
Grundsätzliche Strategien
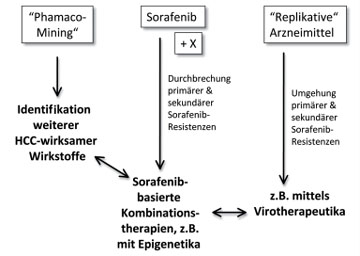
Abb. 1: Zukünftige medikamentöse Therapieformen des Hepatozellulären Karzinomes (HCC)
Die Strategien für neue Therapien des HCC umfassen verschiedene grundsätzliche Strategien, die Identifizierung weiterer Wirkstoffe mit Wirksamkeit beim HCC, die Entwicklung von Sorafenib-basierten Kombinationstherapien zur Überwindung primärer & sekundärer Sorafenib-Resistenzen bei HCC-Patienten und die Evaluation experimenteller Therapieverfahren, die über die bisherige Wirkstoff-basierte Forschung hinausgehen (Abb. 1).
Weitere Wirkstoffe
Zur Identifizierung weiterer Wirkstoffe mit Wirksamkeit beim HCC laufen umfangreiche Phase-I/II-Studien. Aktuelle Informationen finden sich auf der Homepage des National Cancer Institute (NCI), Bethesda, MD, USA: http://www.cancer.gov/clinicaltrials; Stichwort: Liver cancer, adult primary; Unter-Stichworte: advanced adult primary liver cancer; recurrent adult primary liver cancer.
Aufgrund der hier dokumentierten vielfältigen Anstrengungen besteht berechtigte Hoffnung, dass in naher Zukunft weitere Substanzen mit Wirksamkeit beim HCC gefunden werden. Potentielle Kandidaten sind u.a. die Wirkstoffe Erlotinib, Everolimus, Sirolimus, Temsirolimus, Brivanib, Cediranib, Lapatinib, Pazopanib, Valatinib sowie Cetuximab. Detail-Informationen zu den einzelnen Wirkstoffen finden sich online im NCI Drug Dictionary unter http://www.cancer.gov/drugdictionary.
Sorafenib-basierte Kombinationstherapien
Im Falle einer medikamentösen Überwindung primärer & sekundärer Sorafenib-Resistenzen sollte es möglich sein, die unter alleiniger Monotherapie mit Sorafenib bislang erzielte Verlängerung des Überlebens bei HCC-Patienten über den Zeitraum von 3 Monaten hinaus auszudehnen.
Aufgrund der vorliegenden pathogenetischen Grundlagen des HCC ist zu vermuten, dass bei Hepatomzellen mehrere Resistenzmechanismen/-ebenen gegenüber der Wirkung von Sorafenib existieren bzw. sich unter Therapie entwickeln. Man kann also davon ausgehen, dass die Kombination spezifisch wirksamer Substanzen mit einem sehr engen Wirkspektrum (im Sinne eines „targeted approach“) möglicherweise nicht zielführend ist, um die vermuteten komplexen Sorafenib-Resistenzen zu überwinden.
Alternativ könnten Ansätze mit weitgreifender Modulation der Genexpression von Hepatomzellen die komplexen Sorafenib-Resistenzen bei HCC-Patienten überwinden. Einen derartigen innovativen Ansatz stellt beispielsweise der Einsatz epigenetisch wirksamer Medikamente dar, die in Krebszellen u.a. dysregulierte Gene für Proliferation, Apoptose und Differenzierung sowie viele andere Gene gegenregulieren. So wurden unter epigenetischen Therapeutika Expressionsänderungen in bis zu 22% aller zellulären Gene festgestellt (Peart et al.; PNAS 2005). Damit könnte man nicht nur einen (i) direkten Beitrag zum Stopp der Tumorprogression erzielen, sondern darüber hinaus auch (ii) Krebszellen zugänglich für in Kombination verabreichte Wirkstoffe machen („Überwindung primärer Resistenzen“) bzw. (iii) sich unter Therapie entwickelnde Wirkstoff-Resistenzen revertieren („Durchbrechung sekundärer Resistenzen“).
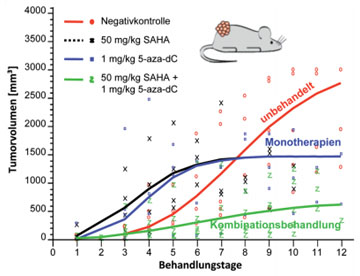
Abb. 2: In der kombinatorischen Behandlung (5-aza-dC plus SAHA) findet sich im Xenograft-Hepatommodell für das Kombinations-Regime eine signifikant bessere Hemmung des HCC Tumorwachstums als mit der jeweiligen Einzelsubstanz (aus: Venturelli et al., Cancer 2007).
Epigenetika
Einige Epigenetika sind bereits für einzelne Indikationen zugelassen, nämlich
- DNA demethylierende Wirkstoffe (DNMT Inhibitoren) und
- sog. Histondeacetylase-Inhibitoren (HDACi)
Substanzen aus diesen beiden neuartigen Wirkstoffklassen können im HCC-Kontext nach präklinischen Daten nicht nur monotherapeutisch, sondern interessanterweise auch in Kombination und dann sogar mit erhöhter Wirksamkeit eingesetzt werden. Die monotherapeutische Applikation des DNMT Inhibitors 5-aza-2‘-deoxycytidin (5-aza-dC) oder des HDACi Wirkstoffes Suberoylanilid Hydroxaminsäure (SAHA) zeigt jeweils einen hochgradig antiproliferativen Effekt auf Hepatomzellen in vitro und in vivo. Unter der Kombination beider Substanzen (5-aza-dC plus SAHA) findet sich bei in vivo Bedingungen im Xenograft-Hepatommodell für das Kombinationsregime eine signifikant bessere Hemmung des HCC Tumorwachstums als mit der jeweiligen Einzelsubstanz (Abb. 2) (Venturelli et al.; Cancer 2007).
Diese Ergebnisse belegen die Möglichkeit, durch epigenetisch wirksame Substanzen in Hepatomzellen deaktivierte Gene zu reaktivieren und die dem HCC inhärente Chemotherapie-Resistenz zu überwinden. Inwiefern diese Prinzipien auch bei der Durchbrechung primärer und sekundärer Resistenzen des HCC gegenüber Sorafenib klinisch erfolgreich eingesetzt werden können, wird derzeit auf vielfältigen Ebenen untersucht.
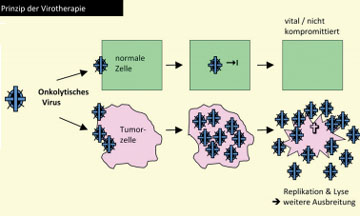
Abb. 3:
Onkolytische Viren können sich in Tumorzellen aufgrund ihrer zahlreichen
genetischen Defekte massiv vermehren, diese dadurch zerstören (Prozess der
Onkolyse) und massenhaft Nachkommenviren freisetzen, die wiederum benachbarte
Tumorzellen infizieren und ebenfalls lysieren; normale Zellen haben dagegen
eine intakte Virusabwehr und werden deshalb nicht beeinträchtigt, weshalb
Virotherapeutika bereits ohne Modifikation eine hervorragende therapeutische
Breite haben. Zusätzlich bietet ein „Molekular-virologisches Bioengineering“
die Möglichkeit, die Effektivität onkolytischer Viren gegenüber Tumorzellen
gezielt weiter zu steigern, beispielsweise durch „Armierung“ mit sogenannten
Suizidgenen.
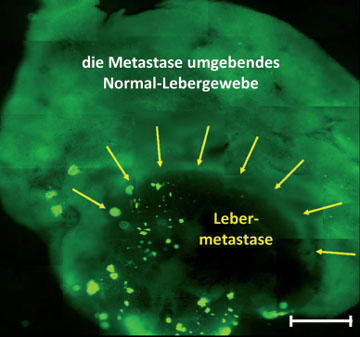
Abb. 4: Mit
onkolytischen Masern-Impfviren infizierter Lebergewebeschnitt, der sowohl
Anteile einer kolorektalen Lebermetastase (grüner Hintergrund) als auch
umgebendes Normal-Lebergewebe (grauer Hintergrund) umfasst. Unter dem
Fluoreszenzmikroskop wird nach 3 Tagen in vitro Kultivierung sichtbar, dass das
eingesetzte Virotherapeutikum bevorzugt das Metastasengewebe infiziert und dort
stark repliziert (in der Fluoreszenz sich intensiv hellgrün demarkierende
Infektionsrundherde); im Gegensatz dazu lassen sich im umgebenden
Normal-Lebergewebe so gut wie keine Infektionsereignisse nachweisen. Dies
zeigt, dass Virotherapeutika von Hause aus ein weitgehend auf Tumorgewebe
restringiertes Infektions- und Replikationsverhalten aufweisen, was sowohl im
Hinblick auf Effizienz als auch auf Sicherheit von großer Bedeutung ist. Der
Balken repräsentiert 1 mm (aus: Zimmermann et al., Int J Oncology 2009).
Neuartige „replikative“ Arzneimittel
Im Rahmen multimodaler Ansätze zur Durchbrechung hochgradiger Therapieresistenzen von soliden Tumoren wie dem HCC sind neuartige experimentelle Verfahren, die sich von jeglicher bisher klinisch verfügbarer Therapieform unterscheiden, von besonderem Interesse. Bei solchen differentiellen Therapiemodalitäten kommen neuartige Effektormechanismen zum Tragen, für die ein anderes Muster primärer & sekundärer Resistenzen vorliegt als für die bislang eingesetzten Krebstherapeutika.
Virotherapie
Ein solches experimentelles Therapieprinzip stellt der Einsatz von onkolytischen Viren (sog. Virotherapie) dar (Abb. 3). Der Einsatz von Viren in der Behandlung von Tumorerkrankungen stellt ein erst in jüngster Zeit systematisch verfolgtes wissenschaftliches Konzept dar. Dabei ist seit längerem bekannt, dass Virusinfektionen zumindest transient zu Tumorremissionen führen können, was durch eine erhöhte Immunantwort auf Virus-infizierte Tumorzellen allein nicht erklärbar ist.
Der onkolytische Wirkmechanismus unterscheidet sich substantiell von Mechanismen der auf dem Markt befindlichen Cytostatika oder Antikörper, so dass sich eine ganz neue Klasse von Therapeutika erschließt. Einzigartig bei der Verwendung replikationskompetenter Viren ist darüber hinaus die Tumor-spezifische Vermehrung der therapeutisch wirksamen Substanz (= onkolytische Viruspartikel) im Tumor, die eine selektive Verstärkung der onkolytischen Wirkung im Tumor ermöglicht (Abb. 4). Dementsprechend verfügen virotherapeutische Verfahren über das einzigartige Potential, Tumorzellen an jeder beliebigen Lokalisation aufzuspüren, dort eine Infektion und die Produktion von Nachkommenviren zu bewirken, welche wiederum bis dato uninfizierte Tumorzellen befallen und onkolytisch zerstören können.
Derzeit befinden sich verschiedene onkolytische Viren in unterschiedlichen Phasen der Erforschung bzw. der klinischen Entwicklung. Die Resultate der bisherigen präklinischen und klinischen Studien zeigen, dass Virotherapeutika bei einer ganzen Reihe von Tumorentitäten sicher und wirkungsvoll eingesetzt werden können. Impfvirus-basierten Virotherapeutika (z.B. Vaccinia-Impfviren, Masern-Impfviren) kommt eine besondere Stellung und Bedeutung zu, da diese im Impfkontext bereits Millionen-fach mit exzellenter Verträglichkeit eingesetzt wurden und eine hervorragende präklinische Datenbasis aufweisen (Zimmermann et al., Int J Oncol 2009).
Erste klinische Daten
Eine erste klinische Phase-I-Studie mit rekombinanten Vaccinia-Impfviren zeigt vielversprechende Ergebnisse. Die intratumorale Injektion des Vaccinia Vektors JX-594 in primäre oder sekundäre Lebertumorherde wurde gut toleriert. Zudem wurden eine systemische Vektordissemination ausgehend von der Inokulationsstelle der Viruspartikel auf andere Tumorlokalisation sowie erste antitumorale Effekte nachgewiesen (Park-BH et al., Lancet Oncol. 2008).
In einer zweiten Studie der gleichen Autoren wurde das Virotherapeutikum JX-594 direkt in Hepatitis B-Virus (HBV)-assoziierte HCC-Herde injiziert. Die Therapie war gut verträglich und bei allen drei Patienten wurden antitumorale Effekte beobachtet, erstaunlicherweise trotz hoher Spiegel neutralisierender antiviraler Antikörper. Eine systemische Vektordissemination auf andere, primär nicht adressierte Tumorlokalisation wurde ebenfalls nachgewiesen (Liu-TC et al., Mol Ther. 2008).
Derartige positive Wirkeffekte beim HCC lassen sich künftig evtl. noch weiter verstärken, indem man die Möglichkeiten zur Transgen-Kodierung onkolytischer Viren, z.B. mit sog. Suizidgenen (Lemken et al., Int J Oncol. 2007), nutzt.
Literatur:
Venturelli S, Armeanu S, Pathil A, Hsieh CJ, Weiss TS, Vonthein R, Wehrmann M, Gregor M, Lauer UM, Bitzer M. Epigenetic combination therapy as a tumor selective treatment ap-proach for hepatocellular carcinoma. Cancer 2007; 109:2132-41.
Park BH, Hwang T, Liu TC, Sze DY, Kim JS, Kwon HC, Oh SY, Han SY, Yoon JH, Hong SH, Moon A, Speth K, Park C, Ahn YJ, Daneshmand M, Rhee BG, Pinedo HM, Bell JC, Kirn DH. Use of a targeted oncolytic poxvirus, JX-594, in patients with refractory primary or metastatic liver cancer: a phase I trial. Lancet Oncol. 2008; 9:533-42.
Liu TC, Hwang T, Park BH, Bell J, Kirn DH. The targeted oncolytic poxvirus JX-594 demon-strates anti¬tumoral, antivascular, and anti-HBV activities in patients with hepatocellular carci-noma. Mol Ther 2008; 16:1637-42.
Zimmermann M, Armeanu S, Smirnow I, Kupka S, Wagner S, Wehrmann M, Rots MG, Groothuis GMM, Weiss TS, Königsrainer A, Gregor M, Bitzer M, Lauer UM. Human Precision Cut Liver Tumor Slices as a comprehensive predictive test system for the oncolytic effective-ness of measles vaccine viruses; Int J Oncol 2009; 34:1247-56.
Lemken ML, Graepler F, Wolf C, Wybranietz WA, Smirnow I, Schmidt U, Gregor M, Bitzer M, Lauer UM. Fusion of HSV-1 VP22 to a bifunctional chimeric SuperCD suicide gene compen-sates for low suicide gene transduction efficiencies. Int J Oncol 2007;30:1153-61.
Peart MJ, Smyth GK, van Laar RK, Bowtell DD, Richon VM, Marks PA, Holloway AJ, Johnstone RW. Identification and functional significance of genes regulated by structurally different histone deacetylase inhibitors. PNAS 2005; 102:3697-3702.





