58. Tagung der AASLD, Boston, 02.-06. November 2007 
Substanzen und Strategien auf dem Prüfstand
Im Mittelpunkt der Tagung standen die neuen Substanzen zur Therapie der chronischen Hepatitis B und C. Es wurden die 48-Wochen-Daten zu Tenofovir sowie die ersten SVR-Raten zur Therapie mit Telaprevir vorgestellt. Zahlreiche Studien beschäftigten sich mit den Prädiktoren für den Therapieerfolg. Es waren viele Fortschritte, aber auch einige Rückschläge zu verzeichnen, die für die Praxis heute und morgen relevant sind.
Die Wirksamkeit des Proteasehemmers Telaprevir (TVR) bei chronischer Hepatitis C mit Genotyp 1 wurde in den beiden Phase-2-Studien PROVE 1 und 2 geprüft. PROVE 1 wurde in den USA, PROVE 2 in Europa durchgeführt. Das Design der Studien ist unterschiedlich und die Studien laufen unterschiedlich lange (Abb. 1 und 2). Eine Zusammenfassung bzw. Vergleich der Ergebnisse beider Studien ist daher sehr komplex.
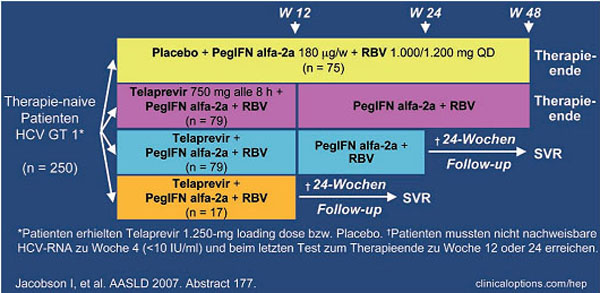
Abb. 1: Studiendesign PROVE 1
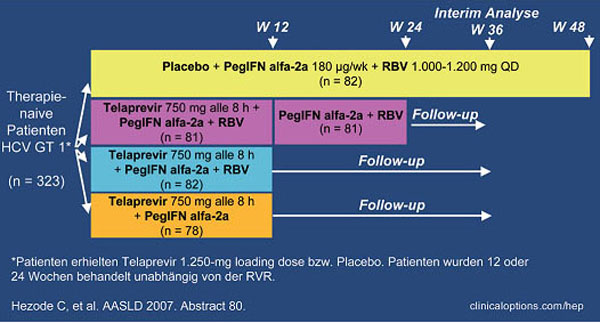
Abb. 2: Studiendesign PROVE 2
TELAPREVIR: KÜRZER UND BESSER
Generell kann man festhalten, dass die Kombination Peginterferon plus Telaprevir plus Ribavirin in beiden Studien deutlich besser abgeschnitten hat als ohne Ribavirin. Am besten war das Ergebnis beim "12+12-Regime", d.h. 12 Wochen 3er-Kombination und anschließend 12 Wochen Standardtherapie (Abb. 3). Dadurch wurden in beiden Untersuchungen SVR-Raten von rund 60% erzielt. Mit diesem Regime lassen sich somit bei kürzerer Therapiedauer etwas bessere SVR-Raten erzielen als mit der herkömmlichen Behandlung. Die Kombination ohne Ribavirin hat in beiden Studien mit einer SVR unter 30% deutlich schlechter abgeschnitten als die 3er-Kombination. Auf Ribavirin wird man in Zukunft somit nicht verzichten können.
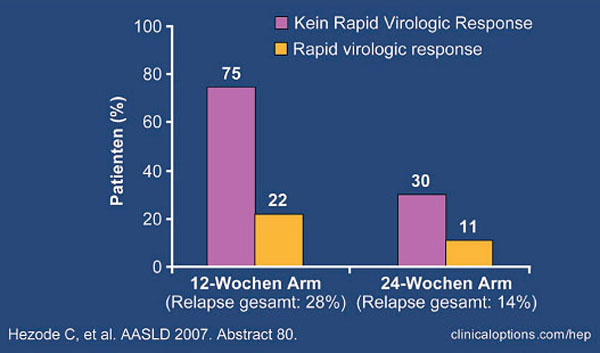
Abb. 3: PROVE 2: Relapse-Raten bei Patienten mit und ohne Rapid Virologic Response zu Woche 4
VERTRÄGLICHKEIT
Die Verträglichkeit von Telaprevir war im Allgemeinen gut. Unter Telaprevir kam jedoch häufiger zu gastrointestinalen Beschwerden und Hautausschlägen. In PROVE 2 beispielsweise wurde die Therapie mit Telaprevir in 10% der Fälle wegen Exanthem, Juckreiz und Magen-Darm-Symptomen abgesetzt. Der Hautausschlag trat bis zu 12 Wochen nach Therapiebeginn auf (#177 Jacobson IM et al.; #80 Hezode C et al.).
RESISTENZ
Ein bedeutendes Problem bei der STAT-C-Therapie ist die Resistenzentwicklung. Eine zweiwöchige Telaprevir-Therapie mit oder ohne Peginterferon beispielsweise kann zu Resistenzmutationen an den Positionen V36, T54, R155 und A156 führen. Nach Fortsetzen der Therapie mit Peginterferon/Ribavirin kann es zum virologischen Durchbruch der Telaprevir-resistenten Mutanten kommen (#50 Forestier N et al.).
RVR: POSITIVER PRÄDIKTOR
HCV-Test für alle Tätowierten!
Menschen mit Tätowierungen haben ein dreifach erhöhtes Risiko für eine HCV-Infektion, auch wenn es sich nicht um Drogengebraucher handelt. In New York wurden im Rahmen einer Studie 3871 Menschen (80% Männer, mittleres Alter 55 Jahre) in drei Zentren nach den Risiken für eine HCV-Infektion befragt. Die eine Hälfte hatte eine HCV-Infektion, die andere Hälfte war die Kontrollgruppe.
Die häufigsten Risikofaktoren waren erwartungsgemäß intravenöser Drogengebrauch und Bluttransfusionen. Die HCV-Patienten hatten zudem signifikant häufiger ein oder mehrere Tattoos (35% vs. 13%). Bei den 1.887 Menschen ohne die bekannten Risikofaktoren hatten Menschen mit Hepatitis C nach Adjustierung für demographische Faktoren dreimal häufiger Tattoos (34% vs. 12%). Menschen mit Tätowierungen sollten daher nach Meinung der Autoren auf HCV-getestet werden. (#136 Dhalla S et al.).
In einer Metaanalyse der Daten von über 2.000 Patienten mit HCV- sowie HIV/HCV-Infektion, die mit Ribavirin und Peginterferon alfa-2b behandelt wurden, lag der positive prädiktive Wert der RVR bei allen Genotypen bei 89%. Zwischen den einzelnen Genotypen gab es Unterschiede, diese waren jedoch nicht allzu groß (G1 75%, G2 89%, G3 90% und HIV/HCV 83%). Der positive prädiktive Wert der EVR, definiert wie üblich als negative HCV-RNA oder Abfall der HCV-RNA >2log, war aufgrund seiner Schwankungsbreite von 48% bis 100% je nach Population weitaus weniger zuverlässig. Die EVR hatte allerdings mit 71% bis 100% einen guten negativen prädiktiven Wert (#305 Poordad F et al.).
Die Aussagekraft der RVR wird dabei nicht von der Sensitivität des Tests beeinflusst, sofern die Nachweisgrenze der Methode <50 IU/ml liegt. Das ergab die Analyse von gefrorenen Serumproben der Studien NV15942 und ACCELERATE mit den Testsystemen COBAS Amplicor (Nachweisgrenze <50 IU/ml) und COBAS TaqMan (Nachweisgrenze <15 IU/ml positiv und nicht nachweisbar sowie Nachweisgrenze ganz negativ). Die SVR-Rate korrelierte zudem gleich gut mit der cEVR, d.h. einer HCV-RNA <50 IU/ ml zu Woche 12 (#1299 Sarrazin C et al.).
WENIG HOFFNUNG FÜR NONRESPONDER
Nonresponder und Relapser stellen in der Praxis ein großes Problem dar. Leider ist für diese Patienten kein Durchbruch in Sicht. In REPEAT (Retreatment With Peginterferon alfa-2a in Patients Not Respon-ding to Prior Peginterferon alfa-2b/Ribavirin Combination Therapy) wurden gleich mehrere Strategien evaluiert. Die 942 Non-responder (90% G1) wurden entweder, wie üblich, 48 Wochen oder 72 Wochen oder mit einer Induktionstherapie mit doppelter Interferon-Dosis über 12 Wochen und dann entweder, wie üblich, insgesamt 48 Wochen bzw. länger insgesamt 72 Wochen behandelt. Die Ergebnisse waren enttäuschend. Die Induktion hatte keinen positiven Effekt, die längere Therapiedauer brachte nur eine moderate Verbesserung. Die SVR-Raten waren in allen Armen mit 7% bis 16% recht gering (#LB4 Jensen DM et al.). Allerdings hatten die 17% der Patienten, die nach 12 Wochen virusfrei waren, eine gute Chance auf Heilung. 76% davon erreichten nach 72 Wochen eine SVR.
ALBINTERFERON
Albinterferon, ein Fusionsmolekül aus humanem Albumin und pegyliertem Interferon alfa-2b, hat eine längere Halbwertszeit als herkömmliches Interferon und muss nur einmal alle zwei bzw. vier Wochen (q2w bzw. q4w) gespritzt werden. Es wurde in zwei Phase-2-Studien an naiven und vorbehandelten Patienten geprüft. In der Studie an 458 naiven Patienten mit Genotyp 1 erreichten unter Albinterferon alfa-2 900 µg q2w, 1.200 µg q2w sowie 1.200 µg q4w in Kombination mit Ribavirin genauso viele Patienten eine SVR wie unter Standardtherapie (51-58% vs. 58%) (Abb. 4). Interessanterweise erzielten adhärente Patienten mit einem Körpergewicht =75 kg unter Albinter-feron alfa-2b 900 µg q2w häufiger eine SVR als unter Peginterferon alfa-2a jeweils in Kombination mit Ribavirin (74,2% vs 53,3%).
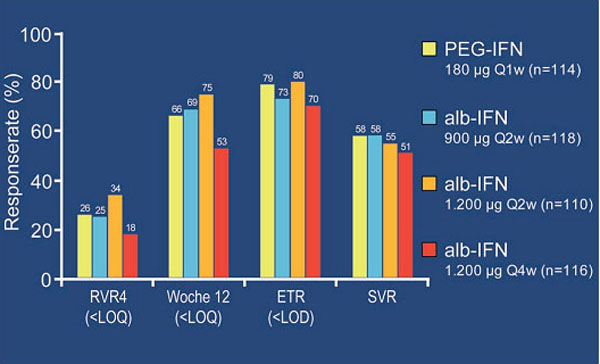
Abb. 4: Albinterferon bei therapienaiven Patienten mit HCV GT1. Virologisches Ansprechen (ITT-Analyse).
Nach Zeuzem S et al., AASLD, Abstr. 189
Die Verträglichkeit des neuen Albinterferons war gut und die Lebensqualität darunter signifikant besser. Am wenigsten Arbeitstage verloren die Patienten in der Gruppe Albinterferon alfa-2b 900 µg q2w (#180 Zeuzem S et al.).
Bei Nonrespondern scheint Albinterferon die SVR-Raten bei erneuter Therapie nicht wesentlich zu verbessern. 115 Nonrespondern wurden mit Albinterferon alfa-2b 900 µg, 1.200 µg, 1.500 µg oder 1.800 µg q2w bzw. 900 µg q4w jeweils in Kombination mit Ribavirin oder konventionell behandelt. Die SVR lag insgesamt bei 17,4%, bei Genotyp 1 sogar nur bei 11%. Zwischen den Therapiearmen bestand kein signifikanter Unterschied. Höhere Albinterferon-Dosen hatten somit keinen besseren Effekt (#51 Nelson DR et al.).
HALT-C: KEIN NUTZEN
Schon seit einigen Jahren versucht man, die Progression der Leberfibrose bei HCV-Patienten, die nicht auf die Behandlung angesprochen hatten, durch eine niedrig-dosierte Interferontherapie aufzuhalten. Diese Konzept wurde in der großangelegten Studie HALT-C an über 1.000 Non-
resondern geprüft. 517 Nonresponder mit Leberfibrose (Ishak 3 or 4) oder -zirrhose (Is-hak 5 or 6) erhielten 3,5 Jahre lang Peginterferon alfa-2a 90 µg/Woche. 533 vergleichbare Patienten dienten als Kontrollgruppe. 95% der Studienteilnehmer hatten einen Genotyp 1,4% bereits eine Zirrhose. Die HCV-RNA lag im Schnitt bei 6,7 log IU/ml. Klinische Kontrollen fanden alle drei Monate statt. Nach 1,5 und 3,5 Jahren wurde eine Leberbiopsie durchgeführt.
In beiden Gruppen erreichten gleich viele Patienten einen der primären Studienendpunkte, nämlich Tod, Dekompensation (Varizen-Blutung, Aszites, hepatische Enzephalopathie, spontane bakterielle Peritonitis, Child-Turcotte-Pugh [CTP] Score =7), HCC bzw. einen Anstieg des Ishak-Scores um =2 point (wenn keine Zirrhose zu Baseline vorlag) (34,1% vs. 33,8%). Im Lauf der 3,5 Jahre war es lediglich zu einer signifikanten Reduktion der HVC-RNA und GPT (p <0,0001 für beide) sowie einer stärkeren Reduktion der Nekroinflammation (p <0,001) gekommen (#LB1 Di Bis-ceglie AM et al.).
NITAZOXANID VERBESSERT HCV-THERAPIE
Auf der Tagung wurden zahlreiche neue Substanzen vorgestellt. Besonderes Aufsehen erregte eine ägyptische Arbeit, in der Nitazoxanid mit erstaunlichem Erfolg gegen HCV eingesetzt wurde. Nitazoxanid ist als Cryptaz™ oder Alinia™ in den USA zur Behandlung von Diarrhoen, hervorgerufen durch Cryptosporidien und Giardia lamblia, zugelassen. Die antivirale Wirkung des ersten Vertreters der Klasse der Thiazolide wurde erst später entdeckt. Derzeit laufen zwei Phase-2-Studien, in denen Nitazoxanid auf verschiedene Arten mit Peginterferon/Ribavirin kombiniert wurde. Die vorläufigen Ergebnisse zeigen einen signifikanten synergistischen Effekt und die Nitazoxanid-haltigen Therapiestrategien schnitten im gesamten Verlauf der Therapie besser ab (Abb. 5). Die Verträglichkeit von Nitazoxanid war gut. Häufigste Nebenwirkungen waren gastrointes-tinale Beschwerden und Kopfschmerzen (#718 Rossignol J et al., Pressemitteilung Romark Laboratories).
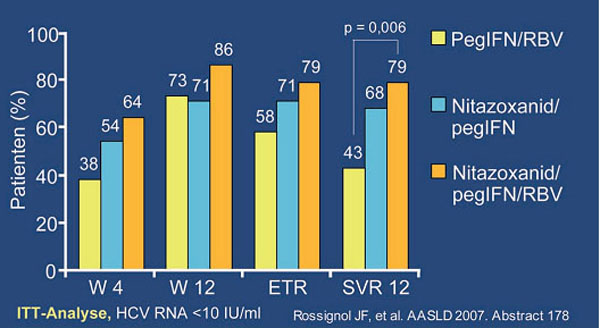
Abb. 5: Nitazoxanid bei therapienaiven Patienten mit HCV Genotyp 4
POLYMERASEHEMMER R1626
Der neue Polymerasehemmer R1626 führte in einer Phase-2a-Studie in Kombination mit Peginterferon/Ribavirin bei über 80% der Patienten mit Genotyp 1 zu einer RVR. Resistenzen wurden nicht beobachtet, wohl aber vermehrt gastrointestinale Beschwerden und bei 40% der Patienten eine Neutropenie vom Schweregrad 2 (#167 Pockros PJ et al.; #1298 Le Pogam S et al.).
TENOFOVIR: 48 WOCHEN DATEN
In den zwei internationalen Multizenter-Studien wurden 641 Patienten mit HBeAg-positiver bzw. -negativer chronischer Hepatitis B 48 Wochen lang entweder mit Tenofovir oder Adefovir behandelt. Von den 375 HBeAg-negativen Patienten (HBV-RNA 7 log Kopien/ml) waren 18% mit Lamivudin oder Emtricitabine vorbehandelt. Jeweils 64% hatten eine GPT >2xULN bzw. einen HBV-Genotyp D. Nach 48 Wochen hatten signifikant mehr Patienten unter Tenofovir eine Viruslast unter der Nachweisgrenze (93% vs. 63%) und gleich viele eine Normalisierung der GPT (77%) (Abb. 6).
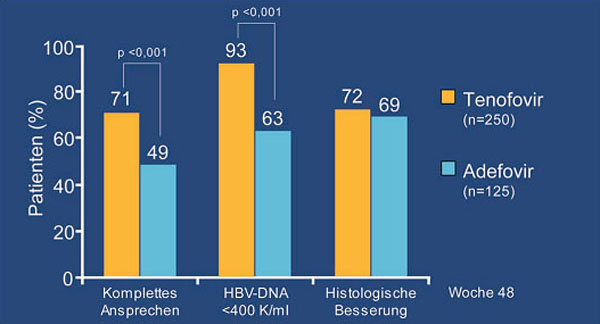
Abb. 6: Tenofovir bei HBeAg-negativen Patienten. Komplettes Ansprechen bedeutet Anteil der Patienten mit
einer Viruslast <400 Kopien/ml plus eine Verbesserung des histologischen Knodell-Score um mindestens 2
Punkte
Bei den 266 HbeAg-positiven Patienten (HBV-DNA ca 9 log Kopien/ml) schnitt Tenofovir erneut signifikant besser ab (VL <400 Kopien/ml 76% vs. 13%, normale GPT 69% vs. 54%) (Abb. 7). Einer vorläufigen Datenanalyse zufolge kam es unter Tenofovir bei 21% der Patienten zur HBe-Serokonversion und bei 3% zum Verlust von HBeAg im Vergleich zu 18% bzw. 0% unter Adefovir.
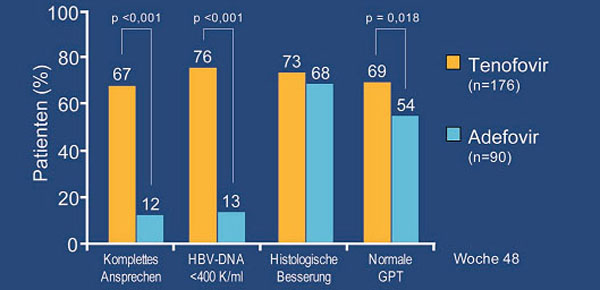
Abb. 7: Tenofovir bei HBeAg-positiven Patienten. Komplettes Ansprechen bedeutet Anteil der Patienten mit
einer Viruslast <400 Kopien/ml plus eine Verbesserung des histologischen Knodell-Score um mindestens 2
Punkte
Die Verträglichkeit von Tenofovir und Adefovir war in beiden Studien gleichermaßen gut. In keinem Fall kam es unter Tenofovir zu einem Anstieg des Serumkreatinin um mehr als 0,5 mg/dl (#LB6 Marcellin P et al.).

TENOFOVIR BEI RESISTENZ
Tenofovir wirkt auch bei mit Lamivudin und Adefovir vorbehandelten Patienten. In einer deutsch-holländischen retrospektiven Analyse hatten 108 Patienten im Schnitt 20 Monate lang Tenofovir eingenommen. Nach 12 Monaten war die Viruslast um rund 4 log Kopien/ml gefallen. Bei 90% (84/90) der Patienten lag sie <400 Kopien/ml, wobei alle (42/42) mit einer Ausgangsviruslast von <7 log Kopien/ml dieses Ziel erreichten. Es wurde kein virologischer Rebound beobachtet (#83 Van Bömmel F et al.). Auch zehn Patienten mit nachgewiesener genotypischer Adefovir-Resistenz, die auf Tenofovir umgestellt wurden, sprachen trotz der bekannten Kreuzresistenz an. Bei allen Patienten kam es zu einem Abfall der HBV-DNA unter die Nachweisgrenze. Die mittlere Beobachtungszeit betrug 17 Monate, die mittlere Reduktion der HBV-DNA 4,4 log Kopien/ml. Ein Rebound wurde bisher bei einer maximalen Beobachtungszeit von 21 Monaten nicht festgestellt (#960 Van Bömmel F et al.).
PRÄDIKTOREN FÜR ERFOLG
Wichtigster Prädiktor für den langfristigen Erfolg mit Nukleosid(t)en scheint eine negative HBV-DNA zu Woche 24 zu sein. In der GLOBE-Studie, in der Telbivudin dem Lamivudin überlegen war, waren neben diesem Prädiktor bei HBeAg-positiven Patienten eine höhere GPT und eine geringe Viruslast sowie bei HBeAg-negativen Patienten eine niedrige Viruslast bei Therapiebeginn Hinweise für ein gutes Ansprechen. Ein virologischer Rebound war hier selten und signifikant seltener als unter Lamivudin (#994 Zeuzem S et al).
Zu Entecavir wurden 4-Jahre-Daten vorgestellt, die bei therapienaiven HBeAg-positiven Patienten erneut eine geringe Resistenzrate von <1% zeigen (#938 Han S et al.). Bei Patienten (n=12), die unter Adefovir nach 48 Wochen noch eine HBV-DNA >5 log Kopien/ml aufwiesen, führte Entecavir über 24 Wochen zu einem Abfall der Viruslast, jedoch in keinem Fall unter die Nachweisgrenze. Entecavir-Mutationen wurden nicht beobachtet (#951 Reijnders JG et al.). RV
Zusammenfassung
HCV-Therapiestrategien
Bei der HVC-Therapie wurde erneut die Bedeutung der RVR nach vier Wochen als positiver Prädiktor sowie einer fehlenden EVR nach 12 Wochen als negativer Prädiktor bestätigt. Patienten mit Genotyp 2 und 3 ohne RVR sowie Patienten mit Genotyp 1 ohne EVR könnten von einer längeren Therapiedauer profitieren. Bei Nonrespondern mit Genotyp 1 hat die Intensivierung der Therapie keinen, die Therapieverlängerung lediglich einen moderaten Effekt. Die Erhaltungstherapie mit niedrig-dosiertem Interferon hatte bei Nonrespondern mit Fibrose keinen Einfluss auf klinische Endpunkte und die Progression der Fibrose.
STAT-C
Das neue Konzept der STAT-C hat erstmals Belege für den klinischen Nutzen geliefert. Telaprevir in Kombination mit Peginterferon/Ribavirin verbessert bei Genotyp 1 die SVR-Raten und verkürzt die Therapiedauer. Dennoch machte sich ein leises Gefühl der Enttäuschung breit. Bei den SVR-Raten war kein Quantensprung gelungen, auf Ribavirin wird man auch in Zukunft nicht verzichten können und es wurden klinisch relevante Nebenwirkungen beobachtet. Zudem ist noch nicht ganz absehbar, welche Bedeutung die mögliche Resistenz auf lange Sicht haben wird. Die gute Nachricht: Es gibt viele neue Substanzen am Horizont, angefangen bei neuen Interferonen über Protease- und Polymerasehemmer bis hin zu Antikörpern.
Therapie Hepatitis B
Das Highlight bei der Hepatitis B waren die 48-Wochen-Daten zu Tenofovir. Das Nukleotid war in zwei großen internationalen Studien an 641 Patienten Adefovir signifikant überlegen. Bei den HBeAg-negativen Patienten erreichten 93% vs. 63% eine HBV-DNA <400 Kopien/ml, bei den HBeAg-positiven waren es 76% vs. 13%. In einer retrospektiven Analyse hatte Tenofovir selbst bei vorbehandelten Patienten, teilweise sogar bei genotypisch nachgewiesener Adefovir-Resistenz, noch einen sehr guten Effekt. RV





