Wolfram H. Gerlich1,2, Dieter Glebe1, Christian G.
Schüttler1,2, Ulrike C. Wend1, Wulf R. Willems1,2
Nationales Konsiliarlabor für Hepatitis B und D in Gießen - Ein Erfahrungsbericht
Teil I: Infektionsketten-Aufklärung, Virussicherheit und Qualitätskontrolle
Nationale Konsiliarlaboratorien werden vom Robert Koch-Institut in Auftrag des Bundesgesundheitsministeriums ausgewählt, damit sie Ärzten, Patienten und Mitbürgern mit Problemen bei bestimmten Infektionskrankheiten mit Rat und gegebenenfalls auch mit Laboruntersuchungen helfen. Das Institut für Medizinische Virologie in Gießen hat eine jahrzehntelange Kompetenz in der Untersuchung von Hepatitis B und D Infektionen. Hier berichten seine Mitarbeiter in 2 Teilen über die wichtigsten Probleme, die an sie herangetragen wurden, und welche Beiträge sie zu deren Lösung bisher leisten konnten.
VORGESCHICHTE:
Das Robert Koch-Institut hat seit 1995 zur Unterstützung seiner Arbeit 16 anerkannte Institute als Nationale Referenzzentren sowie 48 weitere als Konsiliarlaboratorien (KL) für bestimmte Krankheitserreger bzw. Erregergruppen berufen. Für besonders wichtige Erreger wurden Nationale Referenzzentren ernannt. Sie erhalten im Gegensatz zu den KL für ihre Arbeit eine gewisse finanzielle Förderung durch das Bundesministerium für Gesundheit. Solche Zentren gibt es zurzeit u. a. für Hepatitis C, Influenza, Enteroviren und Retroviren1. Seit den 70er Jahren, noch zu Zeiten des früheren Bundesgesundheitsamts, gab es in Göttingen ein Nationales Referenzzentrum für Virushepatitis unter Leitung von Prof. Reiner Thomssen. Mit dessen Emeritierung wurde dieses Referenzzentrum nicht weitergeführt, sondern dessen Aufgaben wurden später aufgeteilt. Hepatitis C galt damals als besonders wichtig, und daher wurde hierfür ein eigenes Referenzzentrum benannt, das Institut für Virologie in Essen (Leitung Prof. Roggendorf). Die Betreuung der enteral übertragbaren Hepatitis-Virustypen A und E erfolgte durch das KL an der Universität Regensburg (Leitung Prof. Jilg), während das KL für die parenteral übertragbaren Hepatitis B und D Viren (HBV, HDV) Wolfram Gerlich übertragen wurde, der kurz vorher von Göttingen nach Gießen berufen worden war1. Damals wurden Hepatitis B und D im Gegensatz zu Hepatitis C diagnostisch und gesundheitspolititisch weitgehend als gelöst betrachtet, und daher erschien die Einstufung als KL ausreichend. Mittlerweile sind jedoch neue Umstände eingetreten, die Hepatitis B zu einem besonders komplexen Gebiet der Infektionskrankheiten machen:
- Eine erhöhte Aufmerksamkeit bei der Aufklärung von Infektionsquellen und Übertragungswegen erfordert vertiefte molekularepidemiologische Untersuchungen und höchstempfindliche quantitative Messung von Virustitern mit Methoden, die nicht allen Laboratorien zur Verfügung stehen.
- Gestiegene Sicherheitsstandards bei Blut- und Organspendern sowie bei der Ausübung medizinischer Berufe haben zu einer großen Zahl von Reihenuntersuchungen auf bestehende oder durchgemachte HBV-Infektionen bei gesunden Personen geführt. Häufig werden dabei positive Befunde erhoben, deren Spezifität und Bedeutung oft nur schwer abzuschätzen ist.
- Die Standardisierung diagnostischer Methoden, insbesondere zur objektiven Qualitätskontrolle, erfordert internationale Referenzmaterialien und klare Definitionsgrundlagen auf wissenschaftlicher Grundlage, die im Falle der Hepatitis nicht immer gegeben waren. Insbesondere die PCR hat Anfang der 90er Jahre zunächst mehr zur Verwirrung als zur Klärung beigetragen.
- Im Zusammenhang mit der seit 1995 in Deutschland allgemein empfohlenen Hepatitis B Impfung tauchen sehr viele Fragen in der Bevölkerung auf, wobei oft auch das KL zu Rate gezogen wurde.
- Die Erkenntnis, dass auch sogenannte "ausgeheilte" HBV-Infektionen in okkulter Form intrahepatisch weiter bestehen und bei Immunsuppression manchmal mit fatalen Folgen reaktivieren können, stellt Diagnose und Prävention der HBV-Infektion vor völlig neue Probleme, die mit der herkömmlichen HBV-Stufendiagnostik und deren Interpretation nicht zu lösen sind.
- Mit der Verfügbarkeit von z. T. hochwirksamen Nukleosid- bzw. Nukleotid-Analoga hat die Therapie der chronischen Hepatitis B neue Möglichkeiten gewonnen, jedoch zeigt die klinische Anwendung, dass primäres und resistenzbedingtes Therapieversagen häufiger sind, als die ersten optimistischen Veröffentlichungen erwarten ließen.
In allen diesen Bereichen hat das KL für Hepatitis B und D Lösungen erarbeitet und Beiträge geleistet. In Teil I dieses Erfahrungsberichts werden die Infektionskettenaufklärung, die Virussicherheit und die Standardisierung der diagnostischen Methoden diskutiert, in Teil II folgen die Interpretation ungewöhnlicher serologischer Muster, hinter denen sich oft okkulte oder reaktivierte HBV-Infektionen verbergen, sowie die Untersuchung der Therapieresistenz.
INFEKTIONSKETTEN-AUFKLÄRUNG.
Ein seit den 70er Jahren bekanntes Problem ist die HBV-Übertragung von (chronisch) infiziertem, invasiv tätigem medizinischem Personal auf die behandelten Patienten2. Noch Anfang der 90er Jahre glaubte man in Deutschland, auch hochvirämischen HBV-Trägern, die bereits Patienten angesteckt hatten, das Operieren nicht verbieten zu müssen, sondern wies lediglich auf besondere Vorsichtsmaßnahmen hin3. Während Großbritannien unter dem Eindruck mehrerer tödlich verlaufener Ansteckungsfälle die operative Tätigkeit HBV-positiver Ärzte bereits Anfang der 90er Jahre verbot2, musste es in Deutschland erst zu einem in der Öffentlichkeit viel beachteten Fall kommen, bei dem ein infizierter Herzchirurg im Verlauf von acht Jahren rund 100 Patienten ansteckte. Das KL wurde für das erforderliche Gutachten hinzugezogen und konnte durch molekularepidemiologische Untersuchungen zweifelsfrei beweisen, dass bei acht nachverfolgten chronisch infizierten Patienten der Chirurg die Infektionsquelle war4. Der Vorfall führte zu einer Formulierung von Richtlinien der DVV für HBV- (und HCV-) positives medizinisches Personal, an denen das KL maßgeblich mitwirkte5, 6. War vor dem Vorfall eine allzu große Liberalität vieler Betriebsärzte gegenüber HBV-Trägern unter dem medizinischen Personal zu verzeichnen, kippte die Stimmung danach völlig um. Die meisten HBV-Träger haben weniger als 105 HBV-Partikel/ml (gemessen durch quantitative PCR auf HBV-DNA), während praktisch alle infektiösen Operateure mehr als 106/ml zeigen. Dies wird in den DVV-Richtlinien mit einem Grenzwert für uneingeschränkte Berufsausübung zwischen 103 und 105 je nach Verletzungsrisiko berücksichtigt. Dennoch neigen heute Betriebsärzte und/oder Personalabteilungen dazu, jede HBsAg-positive Person bei Einstellungen für medizinische Tätigkeit mit Patientenkontakt auszuschließen, wodurch ohne jede Notwendigkeit viele Ungerechtigkeiten entstehen und Karrieren zerstört werden. Das KL versucht in solchen Fällen zu helfen, allerdings meist ohne Erfolg.

Abb. 1: Frau Ulrike C. Wend beim Vergleich der von ihr amplifizierten und sequenzierten HBV-DNA-Proben
untereinander und mit Genbank-Sequenzen. Im Hintergrund ein der Ordner mit Unterlagen zu Fällen des
Konsiliarlabors.
Die meisten HBV-Infektionen nach einer Operation gehen nicht von Chirurgen bzw. ihren Assistenten aus. Bei einem kürzlich publizierten Ausbruch von sechs HBV-Infektionen gelang es dem KL im Zusammenwirken mit einem geradezu detektivisch arbeitenden Gesundheitsamt eine Infektionskette von Patient zu Patient aufzuklären, bei der ein Anästhesist offensichtlich die Übertragungen durch illegale Mehrfachverwendung von Infusionsschlauchsystemen ausgelöst hatte7. Auch Hygienemängel bei so kleinen Eingriffen wie einer Kapillar-Blutentnahme können zu Hepatitis B Ausbrüchen führen, z.B. mit 17 akuten Hepatitis B Erkrankungen vor einigen Jahren in einem Pflegeheim, wobei den vom KL durchgeführten HBV-Sequenzanalysen (Abb. 1) große Bedeutung zukam8. Mittlerweile ist das KL auch an großen epidemiologischen Studien des Robert Koch-Instituts beteiligt.
VIRUSSICHERHEIT
Blutspenden sind heute nur sehr selten eine Quelle von HBV Infektionen. Gemessen an der extremen Seltenheit von HCV- und HIV-Übertragungen (unter 1: 4 Millionen), ist das Restrisiko für HBV-Übertragungen, je nach Testprogramm der Blutbank in Deutschland, jedoch rund 10- bis 20-mal höher9. Das KL konnte in Zusammenarbeit mit engagierten Kollegen vor Ort die Empfänger von einigen zunächst unerkannt infizierten Spendern nachverfolgen und untersuchen. Einige Spender befanden sich noch in der ganz frühen Infektionsphase und waren daher noch HBsAg-negativ7, 10, 11.
Persistierend okkult infizierte Spender stellen jedoch das Hauptproblem dar: Unter 25 derartig infizierten Empfängern verstarben drei durch akutes Leberversagen11. Nicht zuletzt aufgrund dieser Untersuchungen haben das Paul Ehrlich- und das Robert Koch-Institut 2006 zusätzlich zum HBsAg-Screening das Screening aller Blutspender auf anti-HBc empfohlen12, während die Nukleinsäure-Amplifikationstechnik (PCR und ähnliche Verfahren) auf HBV-DNA zur Erkennung der frühen HBV-Infektionsphase von den meisten Spendeinstituten freiwillig durchgeführt wird.
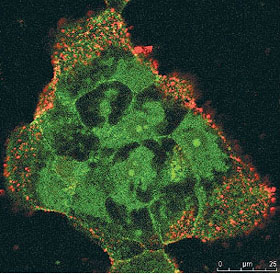
Abb. 2: Dr. Dieter Glebe bei der Durchmusterung von primären Hepatozytenkulturen mit dem konfokalen
Laser Scanning Mikroskop.

Abb. 3: Immunfluoreszenzaufnahme von rot fluoreszierenden subviralen HBV-Partikeln, die sich an die
peripheren Bereiche einer Gruppe von Tupaia-Hepatozyten gebunden haben. In grün der zelluläre
Asialoglykoproteinrezeptor, der sowohl im Cytoplasma als auch auf der Zelloberfläche gefunden wird
und als Marker für die Zellstrukturen dient.

Abb. 4: Dr. Christian G. Schüttler charakterisiert den Internationalen HBsAg-Standard unter andrem
durch Gelchromatographie zur Bestimmung der Partikelgröße.
Ein Problem bei der Bekämpfung von HBV ist die Validierung von Desinfektionsmitteln bzw. Inaktivierungsverfahren. Einerseits kann HBV im Serum-Infektiositätstiter über 108/ml für Übertragungen von Mensch zu Mensch erreichen, anderseits ist seine Infektiosität in Zellkulturen nur unter größten Schwierigkeiten nachzuweisen. Dem hohen Risiko einer Übertragung durch kleinste Blutspuren steht also eine unzureichende Validierung von Methoden zu seiner Beseitigung gegenüber. Seit Jahren bemühen sich weltweit Arbeitsgruppen, dieses Problem durch Surrogatteste zu lösen, unter anderem auch das KL13.
Nun hat Dieter Glebe am KL in Zusammenarbeit mit dem Fachausschuss "Desinfektion" der DVV ein System für das HBV-ähnliche Enten-Hepatitis-B-Virus erarbeitet14, und außerdem auch ein Zellkultur-System (Abb. 2 und 3) für die direkte Messung der HBV-Infektiosität15, 16. Die bisherigen Daten zeigen, dass natürliches HBV aus Trägerblut wesentlich resistenter als "rekombinantes" HBV aus Zellkultur ist, und daher nur natürliches HBV für solche Validierungen verwendet werden sollte.
STANDARDISIERUNG UND QUALITÄTSKONTROLLE
Schon in den 70er und 80er Jahren hat das Paul Ehrlich-Institut (PEI) in Zusammenarbeit mit dem Göttinger Referenzzentrum für Virushepatitis quantitative nationale Referenzpräparate für HBsAg, HBeAg, anti-HBc, anti-HBe und anti-HBc-IgM geschaffen, denen zwar die Anerkennung durch die WHO versagt blieb, die aber (außer für HBsAg) bis heute international die einzigen Präparate geblieben sind, mit denen die Hersteller die analytische Sensitivität ihrer Testkits dokumentieren können.
Für HBsAg führte die WHO 1980 einen 1. Internationalen Standard und entsprechende International Units ein. Bei der serologischen, biochemischen und molekularbiologischen Charakterisierung des kürzlich eingeführten 2. Internationalen Standards für HBsAg wirkte das KL maßgeblich mit. Bei den hierfür erforderlichen internationalen Ringversuchen zeigte sich, dass die bei vielen Testherstellern üblichen Nanogramm-Einheiten für HBsAg stark (bis zum Faktor 13) divergierten und somit auf fehlerhaften Messungen beruhten. Das KL hat Methoden für die genaue Quantifizierung des HBsAg durch immunologische17 und biochemische Charakterisierung (Abb. 4) entwickelt, die auch für medizinische Fragestellungen nützlich sind18. Die Ergebnissen haben zu einer breiteren Anwendung der IU für HBsAg geführt und stellen auch die Basis für eine Vergleichbarkeit klinischer Daten dar.
Nun ist bekannt, dass HBV in vielen Genotypen, Genosubtypen und regionalen Varianten vorkommt. Der internationale Standard für HBsAg repräsentiert aber nur den in Mittel- und Nordeuropa sowie in den USA häufigen Genosubtyp A2, während 99 % der HBV-Träger weltweit andere Geno(sub)typen aufweisen. Im Auftrag der WHO analysiert das KL in Zusammenarbeit mit dem PEI zurzeit hunderte von HBV-Proben, um für jeden HBV-Geno (sub)typ eine repräsentative Referenzprobe zu identifizieren und zu charakterisieren.
Schon in den frühen 90er Jahren hat das KL die Qualitätskontrolle und Standardisierung der qualitativen und quantitativen Bestimmung der HBV-DNA mittels PCR vorangetrieben. Damals ergab ein internationaler Ringversuch, dass nur 2 von 32 Laboratorien (die beiden Referenzlaboratorien) ein fehlerfreies Ergebnis erzielten19. Daraufhin wurde ein virushaltiges Plasmapräparat des KL als "Eurohep" Standard für die HBV-DNA eingeführt20, das später die Basis für den WHO Standard wurde21. Da die Mehrzahl der Teilnehmer des von der WHO durchgeführten Ringversuches zu keinem übereinstimmenden Ergebnis über die Zahl der HBV-DNA-Moleküle kam (auch "Copies" oder Genomäquivalente genannt), führte die WHO eine IU für HBV-DNA ein. Dies ist etwas bedauerlich, da der erste Eurohep Ringversuch gezeigt hatte, dass bei Beseitigung aller Fehlerquellen eine Absolutbestimmung möglich ist20. Demnach entspricht eine IU bei fehlerfreier Eichung des Messverfahrens 5,4 HBV-DNA-Molekülen des Genotyps A2.
Auch hier besteht, weltweit gesehen, die Genotyp-Problematik. Bereits jetzt liegt ein provisorisches HBV Genotyp-Panel des KL vor, das für Prüfzwecke angefordert werden kann. Daneben soll das im Aufbau befindliche, oben erwähnte HBsAg-Genotyp-Panel der WHO auch für die Standardisierung und Qualitätskontrolle der HBV-DNA-Messung eingesetzt werden. Wesentlich ist die exakte Quantifizierung der HBV-DNA für die Indikationsstellung und die Verlaufskontrolle der antiviralen Therapie, für die Beurteilung der Infektiosität in der Betriebsmedizin und für die Qualitätskontrolle im Blutspendewesen.
HEPATITIS DELTA VIRUS (HDV)
Ko- oder Superinfektionen mit dem HBV-abhängigen HDV sind eine seltene, aber schwerwiegende Komplikation der HBV-Infektion. Bei ausgeprägter chronischer oder fulminanter Hepatitis B sollte nach HDV als pathogenitätssteigerndem Agens gesucht werden. Chronische HBV/HDV-Infektionen sind meist therapiebedürftig, jedoch ist die übliche HBV-Therapie mit RT-Hemmstoffen weitgehend unwirksam. In Zusammenarbeit mit A. Ehrhardt von der Universitätsklinik Düsseldorf hat das KL den Verlauf der HD-Virämie während der Therapie mit pegyliertem Interferon verfolgt und geholfen, Kriterien für die Erfolgsaussichten der Therapie zu erarbeiten. Hierfür wurde eine quantitative Real Time RT/PCR entwickelt22. Falls erforderlich, kann das PCR-Produkt zur Genotypisierung mittels Sequenzanalyse verwendet werden. Da es kein käufliches Test-Kit für die Bestimmung der HDV-RNA gibt, erhält das KL Proben aus ganz Deutschland und der Schweiz zur Untersuchung.
Fortsetzung nächstes Heft
Wolfram H. Gerlich1,2, Dieter Glebe1, Christian G.
Schüttler1,2, Ulrike C. Wend1, Wulf R. Willems1,2
Institut für Medizinische Virologie, Fachbereich Medizin
der Justus Liebig-Universität1 und Universitätsklinikum
Gießen und Marburg GmbH, Standort Gießen2
Literatur
1. www.rki.de - Infektionsschutz - Nationale Referenzzentren, Konsiliarlaboratorien.
2. Roß S R, Roggendorf M (Hrsg.) Übertragungsrisiko von HBV, HCV und HIV durch infiziertes medizinisches Personal. Pabst, Science Publishers, Lengerich 2. Auflage 2007.
3. Jilg W, Deinhardt F, Posch J, Maass G, Gerlich WH, Thomssen R. Chronische HBsAg-Träger im Berufsleben. Dtsch. Ärzteblatt 1988, 85: 291-293.
4. Schaefer S, Gerlich WH. Infektionsgefährdung von Patienten durch Hepatitis B-Virus infiziertes Personal. In Zitat 2, S. 11-32, 2007.
5. Deutsche Vereinigung zur Bekämpfung der Viruskrankheiten e.V. Empfehlungen der Deutschen Vereinigung zur Bekämpfung der Viruskrankheiten e. V. (DVV) zur Prävention der nosokomialen Übertragung von Hepatitis B-Virus (HBV) und Hepatitis C-Virus (HCV) durch im Gesundheitswesen Tätige. In Zitat 2 S. 139-148, 2007.
6. Gerlich WH. Hepatitis B und C-Übertragungsrisiko auf Patienten durch infiziertes medizinisches Personal. Bundesgesundheitsblatt 2004, 47:369-378.
7. Furtwängler M, Edwards A, Cyran E, Wend UC, Gerlich WH. Nosokomiale Hepatitis-B-Übertragungen. Dtsch. Ärzteblatt 2006, 103: 1084-1087.
8. Dreesman JM, Baillot A, Hamschmidt L, Monazahian M, Wend UC, Gerlich WH. Outbreak of hepatitis B in a nursing home associated with capillary blood sampling. Epidemiol. Infect. 2006, 26: 1102-1113.
9. Offergeld R, Faensen D, Ritter S, Hamouda O. Human immunodeficiency virus, hepatitis C and hepatitis B infections among blood donors in Germany 2000-2002: risk of virus transmission and the impact of nucleic acid amplification testing. Euro Surveill. 2005 10:8-11.
10. Meisel H, Endres A, Walther HU, Wend UC, Gerlich WH. Transmission of hepatitis B virus two months prior to HBsAg positivity of donor blood. Transfusion Medicine and Hemotherapy, 2003, 30: 228-231.
11. Gerlich, W.H. and 15 coauthors. HBsAg non-reactive HBV infection in blood donors: transmission and pathogenicity.J. Med. Virol., 2007, 79 S1: S32-S36.
12. Burger R, Offergeld R. Testing plasma donations for hepatitis B core antigen (anti-HBc) in order to improve safety of cellular blood components and of quarantined fresh frozen plasma. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 2005 48:698-9.
13. Gerlich WH, Glebe D. Methods for Validation of Hepatitis B Virus Inactivation. In: PDE/EMEA European Virus Safety Forum, Robertson J (Ed.) Dev Biol. 2004, Vol. 118, p. 112-122, Karger, Basel.
14. Sauerbrei A, Schacke M, Schultz U, Egerer R, Merkle I, Glebe D, Gerlich WH, Wutzler P.Alternative methods for validation of cell culture infection with duck hepatitis B virus. J Virol Meth. 2005, 129:178-185.
15. Glebe D, Aliakbari M, Krass P, Knoop E, Valerius KP, Gerlich WH. PreS1 antigen dependent infection of Tupaia hepatocyte cultures with human hepatitis B Virus. J Virol. 2003, 77:9511-21.
16. Glebe D, Urban S, Knoop EV, Çag N, Krass P, Grün S, Bulavaite A, Sasnauskas K, Gerlich, WH. Mapping of the hepatitis B virus attachment site by infection-inhibiting preS1 lipopeptides using Tupaia hepatocytes. Gastroenterology 2005;129:234-245.
17. Gerlich WH, Wend U, Glebe D. Quantitative assay of hepatitis B surface antigen in serum or plasma using Laurell electrophoresis. In: Lau, J., Hamatake, R.: Hepatitis B Virus protocols book, p. 57-63,Humana press, Totowa, N.J. 2004.
18. Gerlich WH, Glebe D, Schüttler CG. Deficiencies in the standardization and sensitivity of diagnostic tests for hepatitis B virus. J Viral Hepatitis. 2007, 14(Suppl.1):
19. Quint WGV, Heijtink RA, Schirm J, Gerlich WH, Niesters HGM. Reliability of methods for hepatitis B virus DNA detection. J Clin Microbiol.1995, 33:225-228.
20. Heermann KH, Gerlich WH, Chudy M, Schaefer S, Thomssen R, Eurohep Pathobiology Group. Quantitative Determination of Hepatitis B Virus DNA in two International Reference plasmas. J Clin Microbiol. 1999, 37: 68-73.
21. Saldanha J, Gerlich WH, Lelie N, Dawson P, Heermann KH, Heath A and the WHO Collaborative Study Group. An international collaborative study to establish a World Health Organization international standard for hepatitis B virus DNA nucleic acid amplification techniques. Vox Sanguinis, 2001, 80: 63-71.
22. Erhardt AH, Gerlich WH, Starke C, Wend UC, Donner A, Sagir A, Heintges T, Häussinger D. Treatment of chronic hepatitis delta with pegylated interferon-alpha2b. Liver Int. 2006, 26: 805-810.





