PD Dr. Thomas Berg, Berlin
Transplantathepatitis
Prophylaxe und Therapie
Der Langzeiterfolg der Lebertransplantation bei Virushepatitis wird durch ein Rezidiv der Grunderkrankung im Transplantat wesentlich beeinträchtigt. Eine effektive Prophylaxe bzw. Therapie des Hepatitisrezidivs ist daher von zentraler Bedeutung. Bei der Hepatitis B steht die Immunprophylaxe mit Hyperimmunglobulin und Nukleos(t)id-Analoga im Mittelpunkt. Bei der Hepatitis C ist eine solche Prophylaxe nicht möglich. Hier muss die antivirale Therapie entsprechend der Situation individuell optimiert werden.
LEBERTRANSPLANTATION BEI HBV
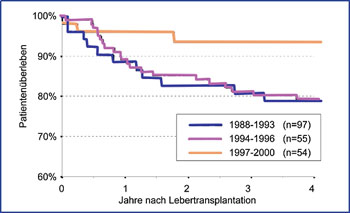
Abb. 1: Überleben nach Lebertransplantation (LTX) bei Patienten mit chronischer HBV Infektion in Abhängigkeit vom Zeitpunkt der LTX. Durch die Einführung der kombinierten HBV-Prophylaxe konnten die Überlebensraten seit 1997 deutlich gesteigert werdennach 2
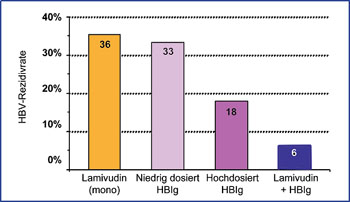
Abb. 2: HBV-Reinfektionsraten nach Lebertransplantation in Abhängigkeit von der verwendeten HBV-Prophylaxenach 4
Bei Patienten mit chronischer HBV-Infektion kommt es nach Lebertransplantation ohne Prophylaxe regelhaft zur Reinfektion des Transplantates. Die Reinfektionshepatitis verläuft unbehandelt in aller Regel schwer, führt in der Mehrzahl der Patienten zum Verlust des Organs und ist mit einer hohen Mortalität assoziiert1. Ein HBsAg-positiver Status galt wegen der Gefahr der Reinfektion des Transplantats durch HBV bis Anfang der 90er Jahre in vielen Zentren, vor allem in Nordamerika, als relative Kontraindikation zur Lebertransplantation. Durch die lebenslange HBV-Reinfektionsprophylaxe, die in den meisten Zentren aus der Kombination von Hepatitis-B-Hyperimmunglobulin (HBIg) plus Lamivudin besteht, konnte die Prognose deutlich verbessert werden. Die Langzeitüberlebensraten liegen heute bei über 80% und damit höher als bei Patienten mit anderen Indikationen (Abb. 1) 2,3.
Die Rate der HBV-Reinfektion ist dramatisch gesunken und liegt heute unter 10% (Abb. 2)4,5.
REINFEKTIONSPROPHYLAXE
Primäres Ziel der Prophylaxe ist der Verlust von HBsAg verbunden mit einer negativen HBV-DNA im Serum. Bei nicht antiviral vorbehandelten Patienten sind Lamivudin plus HBIg immer noch Mittel der Wahl. Patienten mit hoher HBV-Replikation (>107 Kopien/ml) zum Zeitpunkt der Lebertransplantation (LTX) können jedoch von der Gabe eines im Vergleich zu Lamivudin potenteren Nukleos(t)id-Analogons (z.B. Entecavir, Telbivudin oder Tenofovir) mit HBIg profitieren. Bei Patienten mit Nukleos(t)id-Analoga-Resistenz zum Zeitpunkt der LTX sollte die Prophylaxe mit einer gegen die resistente Mutante wirksamen Substanz plus HBIg durchgeführt werden.
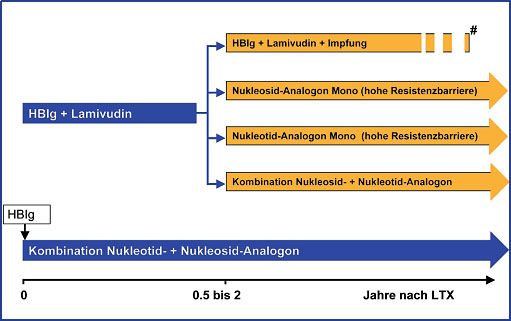
Abb. 3: Mögliche zukünftige Strategien zur Langzeitprophylaxe der HBV Reinfektion nach LTX. (#
nach erfolgreicher aktiver HBV-Impfung kann im Einzelfall die HBIg Therapie beendet werden)nach 5
Die Immunprophylaxe ist in der Regel zeitlich nicht limitiert, da man auch bei Verlust des HBsAg im Serum von einer intrahepatischen Persistenz der HBV-Infektion ausgehen muss6. Die lebenslange HBIg-Therapie ist allerdings mit erheblichen Kosten verbunden. Deshalb sollten in Zukunft auch alternative Prophylaxe-Regime evaluiert werden (Abb. 3). Bei einigen Patienten kann man beispielsweise durch eine aktive HBV-Impfung unter Fortführen der Immunprophylaxe eine dauerhafte anti-HBs-Antwort induzieren und dann die HBIg-Therapie beenden7-9.
HBV-THERAPIE VOR LTX?
Die Prognose von Patienten mit HBV-induzierter fortgeschrittener Zirrhose ohne Lebertransplantation ist ungünstig. Dennoch lässt sich in einigen Fällen die Situation durch eine orale antivirale Therapie mit Nukleos(t)id-Analoga stabilisieren oder sogar verbessern (Rekompensation der Erkrankung)10. Im Einzelfall kann die LTX aufgeschoben oder sogar langfristig vermieden werden. Die antivirale Therapie wird daher generell für alle Patienten mit replikativer HBV-Infektion vor LTX empfohlen11. Die Langzeit-Nukleos(t)idanaloga-Therapie bringt allerdings das Risiko einer Resistenz-Entwicklung mit sich. Nukleos(t)id-Analoga-resistente HBV-Varianten können ein erhebliches Problem für die Reinfektionsprophylaxe darstellen. Daher sind in dieser Situation nur Substanzen mit hoher Resistenzbarriere (Entecavir oder Tenofovir) oder primär eine Kombinationstherapie empfehlenswert. Interferon-alpha ist bei fortgeschrittener Zirrhose im Stadium Child B bzw. C kontraindiziert.
MANAGEMENT DER HBV-REINFEKTION
Die Persistenz oder das Wiederauftreten von HBsAg im Serum nach LTX definiert die HBV-Reinfektion. Bei kombinierter Immunprophylaxe mittels Nukleos(t)idanalogon plus HBIg ist die HBV-Reinfektion meist die Folge einer Nukleos(t)idanaloga Resistenz-Entwicklung und geht nur selten auf die Selektion von HBIg-Escape-Mutanten zurück.
Bei nachgewiesener HBV-Reinfektion besteht die Indikation zur oralen antiviralen Therapie mittels Nukleos(t)idanaloga. Die HBIg-Gabe sollte beendet werden. Ziel der antiviralen Therapie ist die rasche und komplette Suppression der HBV-Replikation unter die Nachweisgrenze sensitiver Tests (HBV-DNA <1.000 Kopien/ml bzw. 200 IU/ml).
Die Wahl der antiviralen Therapie erfolgt in Abhängigkeit von der Vortherapie bzw. der Resistenzsituation entsprechend den Empfehlungen bei chronischer Hepatitis. Die Indikation zu einer oralen Kombinationstherapie sollte großzügig gestellt werden. Tenofovir besitzt bei Lamivudin-Resistenz zurzeit die höchste antivirale Potenz und stellt z.B. bei inkompletter Response auf Adefovir eine wertvolle Option dar12,13.
LEBERTRANSPLANTATION BEI HCV
Bei chronisch HCV-infizierten Patienten kommt es nach LTX in nahezu allen Fällen zu einer Transplantat-Reinfektion14,15. Untersuchungen zur Viruskinetik nach LTX haben gezeigt, dass das Transplantat unmittelbar nach LTX reinfiziert wird und die Hepatitis-C-Virusreplikation innerhalb der ersten Woche nach LTX beginnt16. Die Konsequenzen der Transplantat-Reinfektion sind individuell unterschiedlich. Bei einem Teil der Patienten ist trotz persistierender Hepatitis-C-Virämie auch im Langzeitverlauf nach LTX keine signifikante Transplantathepatitis nachweisbar. In der Mehrzahl der Fälle kommt es jedoch erneut zur chronischen Hepatitis, die bis zur Zirrhose fortschreiten kann.
TRANSPLANTAT-HEPATITIS
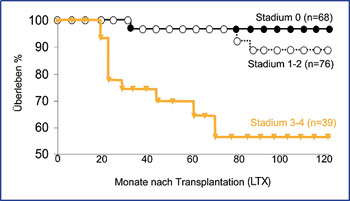
Abb. 4: Überleben nach LTX bei Patienten mit HCV-Reinfektionshepatitis in Abhängigkeit vom Fibrosestadium in der 1-Jahres Leberbiopsienach 17
Die chronische HCV-induzierte Transplantathepatitis zeigt in Analogie zum natürlichen Verlauf der chronischen Hepatitis C initial meist wenig Entzündungsaktivität. Im Lauf der Zeit nimmt aber die Zahl der Patienten zu, die eine progrediente chronische Hepatitis bis zur Zirrhose entwickeln (ca. 30% nach 5 Jahren). Besonders Patienten, bei denen bereits in den ersten Monaten nach LTX mittels Leberbiopsie eine Reinfektionshepatitis nachgewiesen wurde, haben ein hohes Risiko für die Entwicklung einer Transplantat-Zirrhose17 (Abb. 4). Die Zeitspanne bis zur Zirrhose ist dabei kürzer als im natürlichen Verlauf der chronischen Hepatitis C. Dies ist wahrscheinlich eine Folge der postoperativen immunsuppressiven Therapie, die zu einer Steigerung der Virusreplikation führt.
| Risikofaktor | Mögliche Konsequenz |
|---|---|
| Hohe HCV RNA Konzentrationen vor und kurz nach LTX | Antivirale Therapie vor Transplantation |
| Hohes Spenderalter (>40-50 Jahre) | Verwendung junger Spenderorgane für Patienten mit HCV-Infektion |
| Spenderorgane mit signifikanter Verfettung | Verwendung nicht-steatotischer Spenderorgane für Patienten mit HCV-Infektion |
| Cytomegalievirus-Infektion post LTX | CMV-Prophylaxe |
| Überimmunsuppression | Individualisierte immunsuppressive Therapie |
|
- Steroidbolus-Therapie - Anti-Thymozyten-Globulin - Abrupte Modifikationen der Immunsuppression |
Zusätzlich kommt es in seltenen Fällen (<10%) zu schweren cholestatisch verlaufenden Transplantatreinfektionen (fibrosierend cholestatische Hepatitis), die unbehandelt meist zu einem Transplantatversagen innerhalb des ersten postoperativen Jahres führt. Aufgrund der hohen Rezidivrate liegt das Transplantat- und Gesamtüberleben bei Patienten mit chronischer Hepatitis C nach LTX ca. 5-10% unter dem von Patienten mit anderen Grunderkrankungen18-20.
Die Gründe für die unterschiedlichen Manifestationen der HCV-Reinfektion sind nicht eindeutig
geklärt. Es konnten jedoch zahlreiche Parameter definiert werden, die mit der Entwicklung einer
schweren Reinfektionshepatitis assoziiert sind. Insbesondere ein hohes Spenderalter geht mit einer ungüns-tigen
Prognose einher
MANAGEMENT DER HCV-REINFEKTIONSHEPATITIS
Die Zahl der Patienten mit Transplantathepatitis, die nach LTX eine Zirrhose entwickeln, nimmt im Lauf der Zeit kontinuierlich zu (Abb. 5). Eine Therapie bzw. Prophylaxe der Transplantathepatitis C erscheint daher sinnvoll. Dazu gibt es drei unterschiedliche Strategien:
- Therapie auf Warteliste
- präemptive Therapie
- Therapie der akuten bzw. chronischen Reinfektionshepatitis.
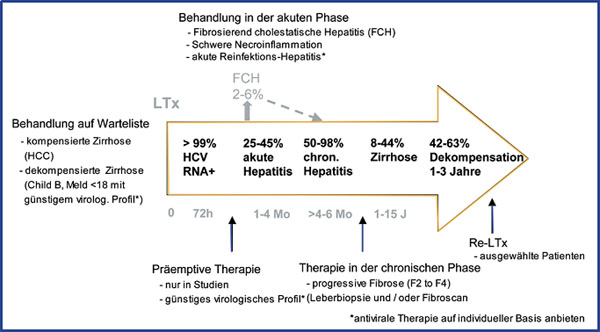
Abb. 5: Übersicht über den natürlichen Verlauf der HCV-Reinfektion und mögliche
therapeutische Interventionsstrategiennach 20
THERAPIE AUF WARTELISTE
Eine HCV-Prophylaxe, die eine Transplantatinfektion verhindert, existiert bisher nicht. Gelingt es aber, durch eine antivirale Kombinationstherapie mit pegyliertem Interferon plus Ribavirin vor LTX eine Remission der HCV-Infektion zu induzieren (HCV-RNA negativ), bleibt ein signifikanter Prozentsatz der Patienten auch post LTX HCV-RNA negativ, d.h. es kommt nicht zur HCV-Reinfektion21-24. Daher sollte stets im Einzelfall geprüft werden, ob eine antivirale Therapie vor LTX möglich ist. Diese sollte aufgrund der hohen Komplikationsrate nur in Transplantationszentren durchgeführt werden.
| Therapie | Abbruch- rate |
Rejektions- rate |
EOT | SVR |
|---|---|---|---|---|
| % | % | % | % | |
| Präemptiv | ||||
| 2-6 Wo post-LTX, n=199 (12-36 Patienten pro Studie) |
37 (0-50) |
45 (0-57) |
n.d. | 17 (0-43) |
| Bei Reinfektionshepatitis | ||||
| IFNa+RBV, n=346; (10-54 Patienten pro Studie) |
26 (5-53) |
2,3 (0-8) |
37 (9-64) |
23 (5-53) |
| PEG-IFNa+RBV, n=319* (20-55 Patienten pro Studie) |
18** (0-43) |
11 (0-25) |
54 (38-68) |
34 (21-45) |
| RBV = Ribavirin EOT = virologische Response am
Therapieende SVR = anhaltende virologische Response Eine supportive Therapie mit Erythropoietin und G-CSF war in der Regel erforderlich, um die Therapie fortzuführen. Akute und chronische Rejektionen wurden nur selten beobachtet |
||||
PRÄEMPTIVE THERAPIE
Bereits 1997 haben Mazzaferro und Mitarbeiter eine Pilotstudie zur frühpostoperativen Prophylaxe der Reinfektionshepatitis mittels Standard-Interferon plus Ribavirin (Therapiebeginn innerhalb der ersten 4 Wochen post-LTX) durchgeführt25. 40% der Patienten erreichten eine anhaltende virologische Remission (SVR). Leider haben sich diese positiven Ergebnisse in Folgestudien nicht bestätigt. Insgesamt liegen die SVR-Raten bei präemptiver Therapie eher niedriger als bei der Therapie im chronischen Verlauf. Zusätzlich ist die Verträglichkeit schlechter und das Risiko einer akuten Abstoßungsreaktion höher (Tab. 2)2.
THERAPIE DER REINFEKTIONSHEPATITIS
Erste Studien zur Therapie der chronischen Transplantathepatitis mit Interferon- bzw. Ribavirin-Monotherapie zeigten einen Rückgang bzw. Normalisierung der Transaminasen verbunden mit einer Abnahme der entzündlichen Aktivität in der Leberhistologie. Bei keinem Patienten kam es jedoch zu einer anhaltenden Response mit Elimination der chronischen HCV-Infektion. Mit pegyliertem Interferon plus Ribavirin werden heute virologische Responseraten unter Therapie von bis zu 70% erzielt, meist auch in Assoziation mit einer histologischen Response (Abb. 6)26. Die SVR-Raten liegen jedoch mit durchschnittlich 20-30% deutlich unter denen, die man bei Patienten mit chronischer Hepatitis C ohne Transplantation erwarten würde (Tab. 2)20, 27-29.

Abb. 6: Bedeutung der antiviralen Therapie für die Fibroseprogression bei Patienten mit
HCV-Reinfektion. Es zeigt sich eine klare Korrelation zwischen virologischer (biochemischer) und
histologischer Response. Insbesondere bei Patienten mit SVR zeigt sich eine Stabilisierung bzw.
Verbesserung des Fibrosestadiums im Verlauf nach Therapienach 26
Mögliche Ursachen für die relativ geringen virologischen Responseraten nach LTX sind:
- Negativ-Selektion von Patienten
- Nonresponder bereits vor LTX?
- >80% HCV-Typ 1
- hohe Viruslast
- Immunsupprimierter Patient - Suboptimale pegIFNalfa- und Ribavirin-Dosis bzw. Notwendigkeit der Dosisreduktionen aufgrund von Nebenwirkungen (Blutbildveränderungen)
- Inadäquate Therapiedauer
| Zeitpunkt | HCV-RNA | SVR |
|---|---|---|
| Woche 4 | Negativ | 100% |
| Positiv | 18% | |
| Woche 12 | Negativ | 71% |
| Positiv | 8% |
Um die SVR-Raten bei Posttransplantationshepatitis zu verbessern, ist entsprechend der aktuellen Daten und Erfahrungen aus der Therapie der chronischen Hepatitis C das Konzept einer Response-gesteuerten Therapie mit individueller Anpassung (insbesondere der Therapiedauer) sinnvoll (Tab. 3). Die Mehrzahl der Patienten zeigt aufgrund der oben genannten Faktoren eine langsame virologische Response. Daher ist in der Regel eine Therapiedauer von 72 Wochen und mehr notwendig, um die Relapseraten zu reduzieren.
SCHWERE TRANSPLANTATHEPATITIS
Ein spezielles Problem stellt die Therapie der akuten schweren Reinfektionshepatitis bzw. der fibrosierend cholestatischen Hepatitis dar. Bei diesen Patienten zeigt sich meist eine sehr hohe Virusreplikation. Als Ursache wird ein direkter zellschädigender Effekt durch die hohe HCV-Replikation (Immunsuppression-vermittelt) vermutet. Die Abgrenzung gegen eine akute Abstoßungsreaktion kann schwierig sein.
Klare Therapieempfehlungen existieren nicht. Eine individuell angepasste bzw. dosierte antivirale Therapie in Kombination mit einer Umstellung bzw. Reduktion der immunsuppressiven Therapie stellt ein rationales Behandlungskonzept dar. Aufgrund der Rezidivgefahr ist eine Langzeitbehandlung zu empfehlen.
PD Dr. med. Thomas Berg
Medizinische Klinik mit Schwerpunkt Hepatologie und Gastroenterologie
Charité - Universitätsmedizin Berlin,
Campus Virchow-Klinikum
Augustenburger Platz 1 · 13353 Berlin
E-Mail: thomas.berg@charite.de
Literatur
1. Samuel D, Muller R, Alexander G et al. Liver transplantation in European patients with the hepatitis B surface antigen. N Engl J Med 329, 1842-1847, 1993
2. Steinmüller T, Seehofer D, Rayes N et al. Increasing applicability of liver transplantation for patients with hepatitis B related liver disease. Hepatology 35, 1528-1535, 2002
3. Kim WR, Poterucha JJ, Kremers WK, Ishitani MB, Dickson ER. Outcome of liver transplantation for hepatitis B in the United States. Liver Transpl 10: 968-974, 2004
4. Seehofer D, Rayes N, Neuhaus P: Prophylaxis and treatment of Hepatitis B recurrence after liver Transplantation in the antiviral era. Expert Rev Anti-infect Ther 1:307-318, 2003
5. Seehofer D, Berg T. Prevention of hepatitis B virus recurrence after liver transplantation. Transplantation 2005 Sep 27;80(1S Suppl):S120-S124.
6. Roche B, Feray C, Gigou M, Roque-Afonso AM, Arulnaden JL, Delvart V, Dussaix E, Guettier C, Bismuth H, Samuel D. HBV DNA persistence 10 years after liver transplantation despite successful anti-HBS passive immunoprophylaxis. Hepatology. 38:86-95, 2003
7. Sanchez-Fueyo A, Rimola A, Grande L et al. Hepatitis B immunoglobulin discontinuation followed by hepatitis B virus vaccination: a new strategy in the prophylaxis of hepatitis B virus recurrence after liver transplantation. Hepatology 31, 496-501, 2000
8. Angelico M, di Paolo D, Trinito MO et al. Failure of a reinforced triple course of hepatitis B vaccination in patients transplanted for HBV-related cirrhosis. Hepatology 35, 176-181, 2002
9. Bienzle U, Gunther M, Neuhaus R, Vandepapeliere P, Vollmar J, Lun A, Neuhaus P. Immunization with an adjuvant hepatitis B vaccine after liver transplantation for hepatitis B-related disease. Hepatology 38: 811-819, 2003
10. Yao FY, Terrault NA, Freise C, Maslow L, Bass NM. Lamivudine treatment is benifical in patients with severly decompensated cirrhosis and actively replicating hepatitis B infection awaiting liver transplantation: a comparative study using a matched, untreated cohort. Hepatology 34, 411-416, 2001
11. Cornberg M, Protzer U, Dollinger MM, Petersen J, Wedemeyer H, Berg T, Jilg W, Erhardt A, Wirth S, Schirmacher P, Fleig WE, Manns MP: [Prophylaxis, Diagnosis and Therapy of Hepatitis-B-Virus-(HBV-)Infection: upgrade of the guideline, AWMF-Register 021/011]. Z Gastroenterol. 2007; 45: 525-74.
12. van Bommel F, Wunsche T, Mauss S, Reinke P, Bergk A, Schurmann D, Wiedenmann B, Berg T. Comparison of adefovir and tenofovir in the treatment of lamivudine-resistant hepatitis B virus infection. Hepatology. 2004; 40:1421-1425 (IF: 10.416). (SCI=19).
13. van Bömmel F, Zöllner B, Sarrazin C, Spengler U, Hüppe D, Möller B, Feucht HH, Wiedenmann B, Berg T. Tenofovir rescue therapy for patients with lamivudine-resistant hepatitis B virus (HBV) infection showing persistent high level replication during adefovir therapy. Hepatology 2006; 44:318-325
14. Wright TL, Donegan E, Hsu HH, Ferrell L, Lake JR, Kim M, Combs C, Fennessy S, Roberts JP, Ascher NL, Greenberg HB (1992) Recurrent and acquired hepatitis C viral infection in liver transplantation recipients. Gastroenterology 103:317-322
15. Berg T, Hopf U, Bechstein WO, Müller AM, Fukumoto T, Neuhaus R, Lobeck H, Neuhaus P. Pretransplant virological markers hepatitis C virus genotype and viremia level are not helpful in predicting the individual outcome after orthotopic liver transplantation. Transplantation 1998; 66: 225-228. (IF: 3.568). (SCI=16).
16. Fukumoto T, Berg T, Ku Y, Bechstein WO, Knoop M, Lemmens HP, Lobeck H, Hopf U, Neuhaus P. Viral dynamics of hepatitis C early after orthotopic liver transplantation: evidence for rapid turnover of serum virions. Hepatology 1996; 24: 1351-1354. (Impact-Factor = 10.416). (SCI=85).
17. Neumann UP, Berg T Bahra M, Harren M, Heise M, Seehofer D, Langrehr JM, Neuhaus R, Radke C, Neuhaus P. Fibrosis Progression After Liver Transplantation in Patients with Recurrent Hepatitis C. J Hepatol, 2004 2004; 41:830-836
18. Neumann UP, Berg T, Bahra M, Puhl G, Guckelberger O, Langrehr JM, Neuhaus P. Long-term outcome of liver transplants for chronic hepatitis C: A ten years follow-up. Transplantation 2004; 77: 226-231
19. Thuluvath PJ, Krok KL, Segev DL, Yoo HY. Trends in post-liver transplant survival in patients with hepatitis C between 1991 and 2001 in the United States. Liver Transpl 2007; 13: 719-24.
20. Berenguer M. Management of hepatitis C virus in the transplant patient. Clin Liver Dis 2007; 11; 355.
21. Forns S, Garcia-Retortillo M, Serrano T, Ferliu A, Suarez F, de la Mata M et al. Antiviral therapy of patients with decompensated cirrhosis to prevent recurrence of hepatitis C after liver transplantation. J Hepatol 2003 ; 39 : 389-396.
22. Thomas RM, Brems JJ, Guzman-Hartman G, Yong S, Cavaliere P, Van Thiel DH. Infection with chronic hepatitis C virus and liver transplantation. J Hepatol 2003; 9: 905-15.
23. Everson GT, Trotter J, Forman L, Kugelmas M, Halprin A fey B eta al. Treatment of advanced hepatitis C with a low accelerating dosage regimen of antiviral therapy. Hepatology 2005; 42: 255-262.
24. Crippin JS, McCashland T, Terrault N, Sheiner P, Charlton MR. A pilot study of the tolerability and efficacy of antiviral therapy in hepatitis C virus-infected patients awaiting liver transplantation. Liver Transpl 2002; 8: 350-5.
25. Mazzaferro V, Regalia E, Pulvirenti A, Tagger A, Andreola S, Pasquali M, Baratti D, Romano F, Palazzo U, Zuin M, Bonino F, Ribero ML, Gennari L Prophylaxis against HCV recurrence after liver transplantation: effect of interferon and ribavirin combination. Transplant Proc. 1997;29 (1-2): 519-21
26. Carrión JA, Navasa M, García-Retortillo M, García-Pagan JC, Crespo G, Bruguera M, Bosch J, Forns X. Efficacy of antiviral therapy on hepatitis C recurrence after liver transplantation: a randomized controlled study. Gastroenterology 2007; 132: 1746-54.
27. Shiffman ML. Treating chronic hepatitis C virus after liver transplantation: balancing the risks against the chance for success. Liver Transpl 2007; 13; 1088-91.
28. Teixeira R, Menezes EG, Schiano TD. Therapeutic management of recurrent hepatitis C after liver transplantation. Liver Int 2007; 27: 302-12.
29. Neumann U, Puhl G, Bahra M, Berg T, Langrehr JM, Neuhaus R, Neuhaus P. Treatment of patients with recurrent hepatitis C after liver transplantation with peginterferon alfa-2B plus ribavirin. Transplantation 2006;15:43-7. (IF 3.608).
30. Oton E, Barcena R, Moreno-Planas JM, Cuervas-Mons V, Moreno-Zamora A, Barrios C, Garcia-Garzon S, Moreno A, Boullosa-Graña E, Rubio-Gonzalez EE, Garcia-Gonzalez M, Blesa C, Mateos ML. Hepatitis C recurrence after liver transplantation: Viral and histologic response to full-dose PEG-interferon and ribavirin. Am J Transplant 2006; 6: 2348-55.





