ADVANCE: Hohe SVR-Raten bei therapienaiven HCV-Patienten Genotyp 1 mit 12 Wochen Telaprevir
Die doppelblinde, plazebokontrollierte Zulassungsstudie ADVANCE untersuchte zwei verschiedene Response-gesteuerte Telaprevir-basierte Therapien und verglich diese mit der 48-wöchigen Standardtherapie 180 μg/Woche Peginterferon alpha-2a plus 1.000-1200 mg/Tag Ribavirin je nach Körpergewicht (pegIFN/RBV; PR): Eine RGT mit 8 oder 12 Wochen 750 mg Telaprevir (T8PR bzw. T12PR) alle 8 Stunden jeweils plus pegIFN/RBV gefolgt von weiteren 16 bzw. 12 Wochen pegIFN/RBV; bei sehr frühem Ansprechen, d.h. HCV-Negativität in Woche 4 und 12 (extended rapid viral response; eRVR) konnten die Patienten die Therapie nach Woche 24 beenden, Patienten ohne eRVR erhielten nochmals 24 Wochen pegIFN/RBV und beendeten die Therapie nach 48 Wochen. Bei Patienten, die unter Telaprevir zu Woche 4 nach wie vor eine Viruslast von > 1.000 IU/ml HCV-RNA hatten, wurde Telaprevir gestoppt und mit pegIFN/RBV weiterbehandelt. Bei Patienten, bei denen die Viruslast zu Woche 12 weniger als 2 Logstufen gesunken war, und bei Patienten, die zwischen Woche 24 und 40 nach wie vor eine nachweisbare Viruslast hatten, wurde die Studie vorzeitig beendet.
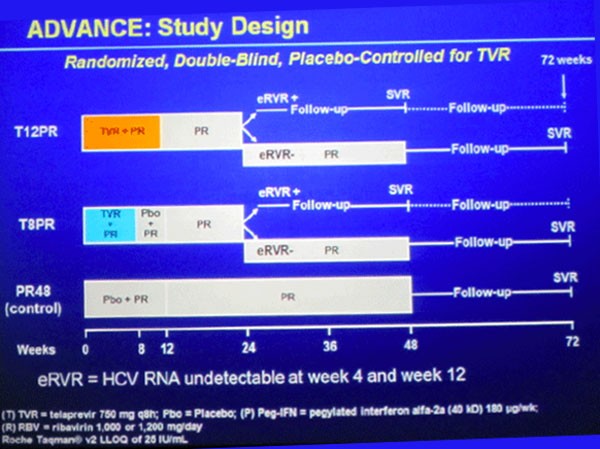 Abb.:
Studiendesign ADVANCE
Abb.:
Studiendesign ADVANCE
Die 1.088 Patienten wurden im Verhältnis 1:1:1 auf die drei Arme randomisiert. Insgesamt 77% der Patienten hatten zu Studienbeginn eine Viruslast von ≥800.000 IU/ml, 58% den Genotyp 1a, und 21% eine Fibrose oder kompensierte Zirrhose.
Im Vergleich zur Standardtherapie (44%) erreichten signifikant mehr Patienten mit T12PR (75%) und mit T8PR (69%) eine SVR (jeweils p<0,0001 versus Kontrolle). Eine eRVR erreichten 58% und 57% Patienten (Kontrolle 8%), die dann die Therapie bereits nach weiteren 24 Wochen pegIFN/RBV beenden konnten. In allen drei Armen erreichten mindestens 80% der Patienten mit einer eRVR eine SVR.
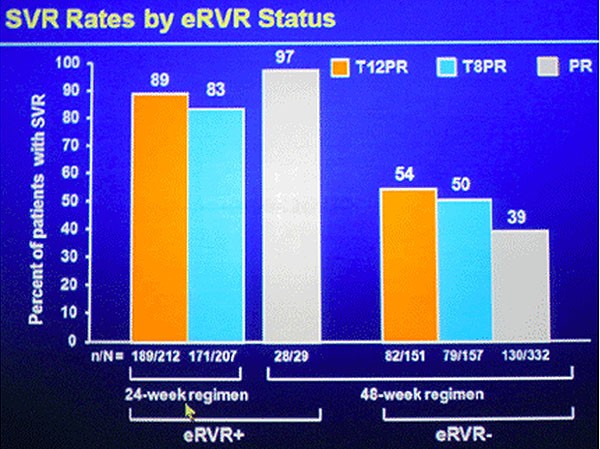 Abb. SVR-Raten in Abhängigkeit vom sehr frühen Ansprechen (eRVR)
Abb. SVR-Raten in Abhängigkeit vom sehr frühen Ansprechen (eRVR)
Die Relapse-Raten waren in den Telaprevir-Armen niedriger (jeweils 9%) als im Kontroll-Arm (28%). Virologisches Versagen trat unter T8PR häufiger auf als unter T12PR (8% versus 12%). Patienten ohne, mit leichter und mit portaler Fibrose erreichten häufiger eine SVR als Patienten mit grenzwertiger „bridging“ Fibrose und Zirrhose. Die SVR-Raten bei Patienten mit grenzwertiger „bridging“ Fibrose und Zirrhose waren jedoch höher als im Kontrollarm.
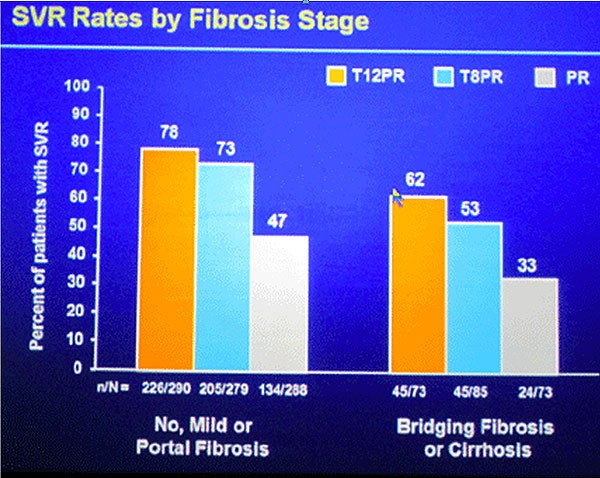 Abb. SVR in Abhängigkeit vom Fibrose-Stadium
Abb. SVR in Abhängigkeit vom Fibrose-Stadium
Die am häufigsten berichteten unerwünschten Ereignisse (>25%) waren Fatigue, Juckreiz, Übelkeit, Kopfschmerzen , Anämie, Rash (überwiegend ekzematöser Hautauschlag) , Grippe-ähnliche Symptome, Schlaflosigkeit, Fieber, und Diarrhöe. Wegen eines unerwünschten Ereignisses brachen 7% /T12PR), 8% (T8PR) und 4% (PR) der Patienten die Studie ab, wegen eines Hautausschlages 1,4%, 0,5% bzw. 0,0% und wegen einer Anämie 0,8%, 3,3% bzw. 0,6%.
Bei einem mittleren bis schweren Rash unter der Triple-Therapie wurden die Medikamente sequenziell abgesetzt: Zuerst Telaprevir und nach sieben Tagen Ribavirin, falls der Rash anhielt auch Peginterferon. Bei Auftreten einer Anämie wurde die Ribavirin-Dosis modifiziert, eine Behandlung mit Erythropoietin war in der Studie nicht erlaubt.
Das Fazit: Die endgültige Auswertung der Studie ADVANCE bestätigte die hohen Heilungsraten einer Telaprevir-basierten Triple-Therapie. Das Nebenwirkungsprofil von Telaprevir wurde bestätigt, allerdings waren im Vergleich zu den Phase-II-Studien in dieser Phase-III-Studie die Abbruchraten wegen Rash und Anämie geringer.





