Reinhart Zachoval, München
Prävention der Hepatitis-B-Reaktivierung
Grundlagen und Definition
Bei Individuen, die entweder chronisch mit HBV infiziert sind (HBsAg-positiv) oder serologisch eine abgelaufene Infektion aufweisen (anti-HBc-positiv ± anti-HBs-positiv) kann eine starke Immunsuppression zur Reaktivierung der Hepatitis B (HBVr) führen.1-6 Als klinische Szenarien sind hier zu nennen: Chemotherapie bei malignen Erkrankungen, Immunsuppression (einschließlich der Gabe von „Immunresponse-Modifiern“) bei Autoimmunkrankheiten (z.B. auto-immune Hepatitis), rheumatologischen Erkrankungen (z.B. rheumatoide Arthritis) chronisch-entzündlichen Darmerkrankungen oder bestimmten Haut-erkrankungen (z.B. Psoriasis) oder bei Organtransplantation.
Definiert ist die HBVr durch einen plötzlichen deutlichen Anstieg der HBV-DNA (≥2 log über einen vorher stabilen Basiswert) oder einen neuen Nachweis von HBV-DNA ≥100 IU/mL und Transaminasenstieg, ggf. auch Ikterus und Gerinnungsstörung bis hin zum Leberversagen. Der Schweregrad der HBVr wird charakterisiert durch Fehlen/Vorhandensein von Ikterus, durch das Ausmaß der nekroinflammatorischen Aktivität bis hin zum akuten Leberversagen sowie durch den Verlauf (Restitution, chronische Hepatitis, Tod oder Lebertransplantation). Die HBVr kann spontan auftreten, folgt aber typischerweise einer Immunsuppression bei Patienten mit chronischer HBV-Infektion (HBsAg-Positivität mit normalen Transaminasen), chronischer Hepatitis B (HBsAg-Positivität und erhöhte Serumleberwerte) und seltener auch bei serologisch abgelaufener Infektion. Bei anti-HBc-positiven Patienten zeigt sich die HBVr an einer HBsAg-Seroreversion und/oder Nachweis von HBV-DNA.7
Pathophysiologisch kommt es zum Verlust der Immunkontrolle über die virale Replikation, Störung der Lmphozytenfunktion, Hemmung inhibitorischer Zytokine und zur vermehrten Expression von HBV-Antigenen auf Hepatozyten, die nach Abbruch der Chemotherapie/Immunsuppression oder zwischen Behandlungszyklen durch zytotoxische T-Zellen zerstört werden. Neben dieser Störung der spezifischen T-Zell-Antwort bewirken Glucocorticoide allein oder in Kombination durch Stimulation des Glucocorticoid-sensitiven Elementes im HBV-Genom eine Hochregelung der HBV-Genexpression.8,9
Risiko-adaptiertes Vorgehen
Das Risiko einer HBVr nach verschiedenen medikamentösen Maßnahmen oder Interventionen kann als hoch (>10%), mittelgradig (1-10%) oder gering (< 1%) klassifiziert werden.5,10
Die Faktoren, die zur Reaktivierung der Hepatitis B führen, sind nicht vollständig aufgeklärt, jedoch spielen neben den virologischen Charakteristika die Grunderkrankung und die Art und Dauer des immunsuppressiven Regimes eine entscheidende Rolle.
Der Schlüssel zum Verhindern einer HBVr liegt in der Kenntnis der HBV-Serologie (HBsAg- und anti-HBc-Status) des einzelnen Patienten vor Beginn einer Immunsuppression/Chemotherapie!
Alle HBsAg-positiven Personen sollten vor Immunsuppression/Chemotherapie hepatologisch evaluiert und wegen des Risikos einer HBVr prophylaktisch mit einem potenten Nukleos(t)idanalogon (NUK: Entecavir, Tenofovir) für die Dauer der Behandlung und danach über weitere 12 Monate (im Fall der Gabe von Rituximab eher 18 Monate) therapiert werden. Die Überwachungs-Weiterbehandlungs- und Stopregeln danach unterscheiden sich nicht vom Vorgehen bei Immunkompetenten.1,11
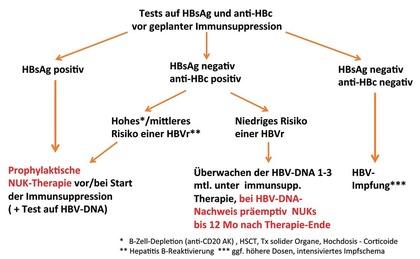
Abb. 1 Algorithmus zum HBV-Screening und zum praktischen Vorgehen bei Patienten mit immun-suppressiver Therapie (modif. nach DGVS-Leitlinie und EASL-CPG-Guideline1,2)
Bei HBsAg-negativen/anti-HBc-positiven Individuen richtet sich die Strategie nach der Art der geplanten Immunsuppression: Bei hohem Risiko (Gabe von Anti-CD 20-Antikörpern, Stammzelltransplantation, Transplantation solider Organe) ist eine Prophylaxe mit einem potenten NUK angezeigt. Bei mittlerem/niedrigem HBVr-Risiko wird von den meisten Fachgesellschaften eine präemptive Strategie empfohlen.1,2 Präemptiv heißt in diesem Fall engmaschige ein- bis drei-monatliche Tests auf HBV-DNA und bei Virusnachweis sofortiger Beginn der antiviralen Therapie. Auch in diesem Fall ist Entecavir oder Tenofovir bevorzugt einsetzen. Lamivudin ist zwar billiger, aber nur bei niedriger Ausgangs-Viruslast und zeitlich limitierter nicht zu starker Immunsuppression zu erwägen. Das Risiko der Resistenzentwicklung un-ter Lamivudin nach dem ersten Jahr ist deutlich höher. Bei fehlender Immunität und fehlenden Hinweisen auf eine bestehende oder abgelaufene Hepatitis B ist vor Immunsuppression/Chemotherapie – wenn zeitlich möglich – eine Impfung gegen Hepatitis B zu empfehlen, ggf. mit einem intensivierten Impfschema (Abb.1).
Antimetabolite (Azathioprin, Methotrexat)
Aufgrund langer Erfahrung mit diesen Substanzen und der nur in Einzelfällen beschriebenen HBVr werden diese Substanzen, in üblicher Dosierung gegeben, als relativ sicher mit geringem Risiko eingestuft.5
TNF-α Inhibitoren
TNF-α Inhibitoren sind für die Behandlung der rheumatoiden Arthritis, entzündlicher Darmerkrankungen und die Psoriasis zugelassen und werden breit angewendet. Verschiedene Substanzen dieser Gruppe wurden mit einer HBVr assoziiert, insbesondere nach der Gabe von Infliximab bei rheumatoider Arthritis4,17,25; das Risiko einer HBVr scheint aber hauptsächlich für chronische HBsAg-Träger (s.o.) zu bestehen, weniger (<1%) für Patienten mit isoliertem anti-HBc, weshalb hier ein präemptives Vorgehen gerechtfertigt ist.
Lokoregionäre Therapie des hepatozellulären Karzinoms
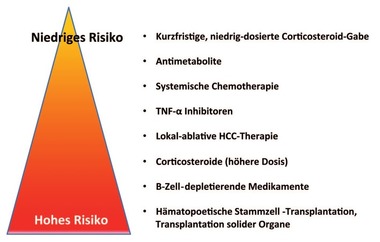
Abb. 2 Immunsuppression und relatives Risiko einer Hepatitis-B-Reaktivierung (modif. nach Bessone F et al. 2016) 12-21
Bei der transarteriellen Chemoembolisation wurden trotz des nur geringen systemischen Effektes der Behandlung Reaktivierungen einer HBV-Infektion beschrieben, das gleiche gilt für stereotaktische Bestrahlungen von HCC-Läsionen5,6,15,22, auch hier erscheint ein präemptives Vorgehen angemessen.
Corticosteroide
Hochdosierte Corticosteroide alleine oder in Kombination mit anderen Immunsuppressiva sind die Grundlage vieler chemotherapeutischer Regime und haben ein mittleres bis deutlich erhöhtes Risiko für HBVr bei HBsAg-positiven Patienten; bei anti-HBc-positiven Patienten wird eine Dosis von <10 mg Prednison für weniger als 4 Wochen ebenso wie die lokale Corticoid-Applikation mit einem nur niedrigen Risiko einer HBVr assoziiert.5 Die Gabe höherer Dosen (>20 mg/d) über einen Zeitraum länger als 4 Wochen ist mit einem mittleren Risiko der HBVr verbunden.
Systemische Chemotherapie
Bei systemischer Chemotherapie ist das Risiko der HBV-Reaktivierung entscheidend von der Grunderkrankung und damit von der Art und Dauer der Chemotherapie abhängig; schwere Verläufe und eine deutlich erhöhte Mortalität sind insbesondere für chronische HBsAg-Träger unter Lymphomtherapie (Cortison/Rituximab) beschrieben. HBVr wurden jedoch auch im Rahmen der Behandlung solider Tumore (Brust, Colon, Lunge) berichtet; diese Patienten sind der Gruppe mit intermediärem Risiko (HBVr-Risiko 1-10%) zuzuordnen.15,17
Biologika
Rituximab ist als die Hochrisiko-Substanz für eine HBVr anzusehen. In der Kombination mit Standard-Chemotherapie wurde bei Patienten mit Non-Hodgkin-Lymphomen auch bei serologisch abgelaufener Hepatitis B eine Reaktivierung bei 25% der Patienten beobachtet! Die Reaktivierungen traten auch noch 12 Monate nach Ende der Therapie auf, auch bei Patienten mit ursprünglich isoliertem anti-HBc.17 Für neuere Biologika-Tyrosinkinaseinhibitoren, Zytokin- und Integrin-Inhibitoren liegen bisher nur Einzelfallberichte der HBVr vor. Aufgrund des Wirkmechanismus dieser Substanzen muss jedoch mit einem bis zu mittleren Risiko einer HBVr gerechnet werden.
Transplantation
Stammzell-/Knochenmark-Transplantierte (HSCT) erhalten typischerweise eine intensive Chemotherapie/Ganzkörperbestrahlung und tragen ebenso wie die Empfänger solider Organe ein hohes HBVr-Risiko19, sie sollten deshalb unbedingt prophylaktisch antiviral behandelt werden (HBVr-Raten bis 50% bei HBsAg- positiven und isoliert anti-HBc-positiven Patienten). Für die Dauer der prophylaktischen Therapie (Jahre? Lebenslang?) gibt es keine verbindlichen Richtlinien.
DAA-Therapie bei HBV/HCV
Die Behandlung einer chronischen Hepatitis C mit DAAs kann im Einzelfall zu einer HBVr führen.23,24 HCV/HBV-koinfizierte Patienten, die die Kriterien für eine HBV-Therapie erfüllen, sollten zusätzlich zur DAA-Therapie mit NUKs behandelt werden.1 Nicht allgemeiner Konsens, aber möglicherweise sinnvoll ist auch hier die Gabe eines NUK bei jedem HBsAg-positiven HCV-Patienten und bis 12 Wochen nach Ende einer DAA-Behandlung der Hepatitis C.26 Bei HBsAg-negativen/anti-HBc-positiven Patienten mit Hepatitis C ist unter DAAs eine Überwachung der Transaminasen zum Ausschluss einer HBVr ausreichend.1
Fazit
Alle Patienten, bei denen eine immunsuppressive Behandlung oder Chemotherapie vorgesehen ist, sollten auf HBV-Marker getestet werden. HBsAg positive Individuen müssen hepatologisch evaluiert und prophylaktisch mit potenten antiviralen NUKs (Entecavir oder Tenofovir) behandelt werden. Bei anti-HBc- positiven Patienten ist die Datenlage nicht so eindeutig und richtet sich nach dem HBVr-Risiko. Beim Einsatz von Rituximab, bei HSCT oder Transplantation solider Organe und bei Hochdosis-Corticoid-Gabe ist ebenfalls eine prophylaktische Therapie sinnvoll. Das gleiche gilt für Situationen mit langdauernder Immunsuppression, limitierter Compliance bei der Überwachung oder in Situationen mit unbekanntem HBVr-Risiko (z.B. neue Biologika). Bei geringem/mittlerem HBVr-Risiko ist bei engmaschiger Überwachung ein präemptives Vorgehen bei anti-HBc-positiven Patienten ausreichend.
1 EASL 2017 Clinical Practice guidelines on the management of hepatitis B virus infection. J Hepatol 2017;67:370-398
2 Cornberg M et al. Aktualisierung der S3-Leitlinie zur Prophylaxe, Diagnostik und Therapie der Hepatitis-B-Virus-Infektion. Z Gastroenterol 2011;49:871-930
3 Di Bisceglie AM et al. Recent US food and drug administration warnings on HBV reactivation with immunosuppressing and anti-cancer drugs: just the tip of the iceberg? Hepatology 2015;61:703-711
4 Bessone F et al. Management of hepatitis B reactivation in immunosuppressed patients: An update on current recommendations. World J Hepatol 2016;8(8):385-394
5 Perillo RP et al. AGA institute technical review on prevention and treatment of HBV reactivation during immunosuppressive therapy. Gastroenterology 2015;148:221-244
6 Liaw YF et al. Asian-Pacific consensus statement on the management of chronic hepatitis B. Hepatol Int 2012;6:531-561
7 Visram A et al. Defining and grading HBV reactivation. Clinical Liver Disease 2015;5:35-38
8 Roche B et al. The difficulties of managing severe hepatitis B reactivation. Liver Int 2011;31 Suppl.1: 104-110
9 Shouval D et al. Immunosuppression and HBV reactivation. Semin Liver Dis 2013;33:167-177
10 Reddy KR et al. American gastroenterological association institute guideline on the prevention and treatment of hepatitis B reactivation during immunosuppressive drug therapy. Gastroenterology 2015;148:215-219
11 Cholongitas et al. Management of patients with hepatitis B in special populations. World J Gastroenterol 2015;21(6):1738-1748
12 Loomba R et al. Systematic review: the effect of preventive lamivudine on hepatitis B reactivation during chemotherapy. Ann Int Med 2008;148:519-528
13 Perez-Alvarez R et al. HBV reactivation in patients receiving tumor necrosis factor (TNF)-targeted therapy. Medicine (Baltimore) 2011;90:359-371
14 Hoofnagle JH et al. A short course of prednisolone in chronic hepatitis B. Report of a double-blind randomised study, placebo controlled trial. Ann Int Med 1986;104:12-17
15 Jang JW et al. A randomised controlled trial of lamivudine in patients receiving transarterial chemolipiodolization. Hepatology 2006;43:233-240
16 Lau GK et al. Early is superior to deferred premptive lamivudine therapy for hepatitis B patients undergoing chemotherapy. Gastroenterology 2009; 125:1742-1749
17 Reynolds JA et al. Medical interventions associated with HBV reactivation: Common and less common. Clinical Liver Dis 2015;5:32-34
18 Gu HR et al. HBV reactivation in an HBV negative patient with multiple myeloma treated with prednisolone maintenance therapy after autologous HSCT. Blood Res 2015;50:51-53
19 Hwang JP et al. Hepatitis B reactivation during cancer chemotherapy. J Viral Hepatitis 2015;22:346-352
20 Mozessohn L et al. Hepatitis B reactivation in HBsAg negative/anti-HBc antibody positive patients receiving rituximab for lymphoma: a meta-analysis. J Viral Hepat 2015;22:842-849
21 Martin ST et al. Hepatitis B reactivation and rituximab: a new boxed warning and considerations for solid organ transplantation. Am J Transplant 2014;14:788-796
22 Huang W et al. Risk factors for HBV reactivation after conformal radiotherapy in patients with hepatocellular carcinoma. Cancer Sci 2014; 105: 697-703
23 Belperio PS et al. Evaluation of hepatitis B reactivation among 62920 veterans treated with oral hepatitis C antivirals. Hepatology 2017;66:27-36
24 Chen G et al. Hepatitis B reactivation in hepatitis B and C coinfected patients treated with antiviral agents: a systematic review and meta-analysis. Hepatology 2017,66:13-26
25 Lee YH et al. Hepatitis B reactivation in HBsAg positive patients with rheumatic diseases undergoing anti-tumor necrosis factor therapy. Int J Rheum Dis 2013;16:527-531
26 Perillo R et al. Hepatitis B virus reactivation during DAA treatment of chronic hepatitis C: a hidden danger of an otherwise major success story. Hepatology 2017;66:4-6





