Ulrich Spengler, Bonn
Infektion der Leber mit humanen Herpesviren
Übersicht über human-
pathogene Herpesviren
Alpha-Herpesvirinae
- Simplex-Viren: HSV-1 (HHV-1), HSV-2 (HHV-2)
- Varizella-zoster-Virus (VZV = HHV-3)
Beta-Herpesvirinae
- Cytomegalievirus (CMV = HHV-5)
- Roseoloviren: Humanes Herpesvirus 6
und 7 (HHV-6 und HHV-7)
Gamma-Herpesvirinae
- Lymphocryptoviren:
Epstein-Barr-Virus (EBV = HHV-4) - Rhadinoviren: Humanes Herpesvirus 8
(HHV-8)
Tab 1.
Herpesviren bilden eine weitverbreitete Virusfamilie mit acht humanpathogenen Viren (Tab. 1). Herpes-simplex-Virus (HSV), Varizella-zoster-Virus (VZV), Epstein-Barr-Virus (EBV), Zytomegalievirus und humanes Herpesvirus Typ 6 können bei zwischen 50% und 90% der Bevölkerung nachgewiesen werden und werden meist in jungen Jahren erworben. Diese Viren können die Leber im Rahmen der Infektion schädigen. Sie persistieren lebenslang und können unter Immunsuppression zu aggressiven Lebererkrankungen führen. Im Unterschied dazu ist das humane Herpesvirus Typ 8 weniger stark in der Bevölkerung verbreitet. Es findet sich im Speichel und wird wahrscheinlich auch vertikal von der Mutter auf das Kind übertragen werden. Komplikationen von HHV8 unter starker Immunsuppression sind Kaposi-Sarkom und lymphozytäre Neoplasien.
Herpes simplex virus
Eine gefürchtete Komplikation bei HSV 1- oder HSV2-Infektion ist ein fulminantes Leberversagen. Es wird unter starker Immunsuppression aber nur im Ausnahmefall bei immunkompetenten Patienten beobachtet. Typische Risikokonstellationen sind Organtransplantation, HIV-Infektion, Malignome und hämatologische Systemerkrankungen oder Steroidtherapie. Ein Leberversagen wurde auch bei HSV-Infektion von Schwangeren oder Neugeborenen beobachtet. Die HSV-assoziierte Hepatitis hat unbehandelt eine hohe Mortalität (>80%). Die Patienten bieten ein septisches Krankheitsbild mit Fieber, Übelkeit, Erbrechen, Bauchschmerzen sowie einer schweren Gerinnungsstörung und Lymphopenie. Ein Drittel zeigt die typischen Bläschen im Mund- oder Genitalbereich, aber Ikterus kann fehlen. Die Diagnose muss rasch gestellt werden, entweder durch Virusisolation, Immunfluoreszenz oder Polymerase-Kettenreaktion. Serologische Verfahren sind dazu nicht geeignet.1
Bei der Autopsie findet man eine vergrößerte Leber mit diffus verteilten hellen Flecken, die histologisch Nekrosen mit einer aber nur geringen Entzündungsreaktion zeigen. Mehrkernige Riesenzellen kommen vor.
Keiner der Patienten mit fulminanter HSV-Hepatitis hat überlebt, wenn ein diffuser Leberbefall vorlag, während ca. 40% der Patienten mit mehr umschriebenem Leberbefall überlebten, falls rechtzeitig mit Aciclovir behandelt wurde. Die Prophylaxe mit Aciclovir reduziert zudem die Häufigkeit einer HSV-Reaktivierung nach Organtransplantation. Im Falle der seltenen Aciclovir-Resistenz (< 0,5%) können Foscarnet oder Cidofovir als Alternative eingesetzt werden, da sich das Resistenzprofil von Valganciclovir und Famciclovir nicht von Aciclovir unterscheidet.
Varizella-Zoster-Virus (VZV)
VZV ist der Erreger der Windpocken beim Kind und des Herpes zoster beim Erwachsenen. Obwohl sich VZV in den Epithelien von Darm, Atemwegen und endokrinen Drüsen vermehren kann, ist eine Leberbeteiligung eine ausgesprochene Rarität. Chemotherapie bei Malignomen und hochdosierte Kortikosteroidtherapie sind beispielsweise Risikofaktoren dafür. Das Krankheitsbild ähnelt der HSV-Hepatitis und es finden sich in der Biopsie ausgedehnte Nekrosen mit Einschlusskörperchen bei nur geringer Entzündungsreaktion. Die Diagnose wird am besten mit der Polmerase-Kettenreaktion gestellt.1 Therapie und Prophylaxe der VZV-Hepatitis unterscheiden sich nicht von der HSV-Infektion, da Aciclovir auch gegen VZV gut wirksam ist. VZV ist auch als Auslöser einer schweren Autoimmunhepatitis beschrieben worden.2
Zytomegalievirus (CMV)
Bei immunkompetenten Personen verläuft die Zytomegalievirus-Infektion oft asymptomatisch bzw. führt nur zu einer milden transienten Erkrankung. Bei 10% kommt es zum Syndrom der infektiösen Mononukleose, die von erhöhten Transaminasen und einer milden Hepatitis begleitet wird. Histologisch zeigt sich eine fokale Schädigung der Hepatozyten und Gallengänge sowie eine lymphozytäre Infiltration der Sinusoide. Sinusendothelzellen, Kupferzellen und Leberzellen schwellen an und enthalten basophile Einschlüsse im Zytoplasma. Auch typische amphophile intranukleäre Einschlusskörperchen können beobachtet werden, die von einem hellen Halo umgeben sind und dadurch an ein „Eulenauge“ erinnern. Die Einschlusskörperchen im Kern und Zytoplasma sind voller Virionen. Manchmal finden sich auch epitheloidzellige Granulome ohne Nekrose. Der Nachweis typischer Zytomegalie-Einschlusskörperchen oder eine immunhistologische Färbung von Zytomegalie-Antigenen gelingt dann jedoch nur relativ selten. Bei HIV-positiven Patienten im Stadium AIDS wurden auch Gallengangsnekrosen beobachtet, die zu dem klinischen Bild der HIV-Cholangiopathie beitragen.
Krankheitsbilder bei
CMV-Infektion
- „Infektiöse Mononukleose“ mit Leberbeteiligung
- Organinfektionen: Gastroenteritis, Retinitis, Hepatitis
- Granulomatöse Hepatitis
- Fulminantes Leberversagen
- Hepatitis und Immunaktivierung nach Transplantation
Tab 2.
Die Zytomegalievirus-Infektion ist die häufigste Ursache einer Hepatitis nach Organtransplantation. Die Infektion geht entweder auf eine Reaktivierung von endogenem Zytomegalievirus unter Immunsuppression oder eine Infektion durch ein CMV-positives Spenderorgan, Blutkonserven oder Blutprodukte zurück. Nach einer Lebertransplantation werden postoperativ Komplikationen durch das Zytomegalievirus meistens zwischen dem ersten und sechsten Monat nach der Operation beobachtet. Neben der eigentlichen Hepatitis gilt die CMV-Infektion auch als Risikofaktor für eine nachfolgende akute oder chronische Abstoßung. Andererseits kann die Abstoßungstherapie mit hoch-dosierten Corticosteroiden auch eine Reaktivierung einer latenten CMV-Infektion bewirken. Die Biopsie nach einer Lebertransplantation zeigt kleine Nekroseherde mit Entzündung (Mikroabszesse), aber nur wenige Zellen mit Einschlusskörperchen. Tabelle 2 gibt einen Überblick über die mit CMV-Infektion assoziierten Krankheitsbilder.
De novo CMV-Antikörper oder ein mindestens vierfacher Anstieg von CMV-IgM stellen beim Immunkompetenten einen Hinweis auf eine Zytomegalie-Infektion dar. Da die serologische Diagnostik jedoch unverlässlich ist, werden heute zur Diagnose quantitative DNA-Amplifikationsverfahren zum Nachweis der CMV-DNA empfohlen.3 Mittlerweile werden an den meisten Transplantationszentren regelmäßige Kontrollen der CMV-DNA durchgeführt. Zudem erhalten Hochrisikopatienten, z.B. CMV-Antikörper negative Empfänger eines CMV-positiven Spenderorgans, eine Prophylaxe mit Hyperimmunglobulinen oder direkt antiviralen Medikamenten. Dennoch kann es noch zu einer CMV-Hepatitis kommen, die dann prompt behandelt werden sollte. Gancyclovir intravenös oder orales Valganciclovir (900 mg/d) über 3 Wochen sind die Behandlung der Wahl. Diese Medikamente können in halber Dosierung als Chemoprophylaxe weitergegeben werden, wenn eine längere Dauer der Immuninsuffizienz angenommen werden muss. Glücklicherweise sind Resistenzen gegen beide Medikamente selten, so dass nur in Ausnahmefällen auf die toxischeren Alternativen Cidufovir oder Foscarnet ausgewichen werden muss.
Humane Herpesviren Typ 6 (HHV6) und 7 (HHV7)
HHV6
besitzt die beiden Varianten HHV6A und HHV6B, die sich in ihrer
Resistenz gegenüber Aciclovir und
Valganciclovir unterscheiden.
Obwohl molekulargenetisch deutlich von HHV6 verschieden, ähnelt HH7
biologisch in vielfacher Hinsicht HHV6. Die Infektionen erfolgen
meist im Kindesalter als febriles Exanthema subitum oder Roseola
infantum (HVV6) oder Pityriasis rosea (HHV7). Zudem wird ein weites
Spektrum an möglichen Folgeerkrankungen, insbesondere bei Menschen
mit Immundefekt diskutiert.4
Zu dem Krankheitsspektrum gehören auch verschiedene Verläufe einer
Hepatitis.
Eine
Hepatitis durch HHV6 hat gelegentlich bei Neugeborenen zum akuten
Leberversagen geführt. Zudem wurden auch bei Erwachsenen, die wegen
eines akuten Leberversagens unklarer Genese transplantiert werden
mussten, HHV6-DNA und HHV6-Antigene nachgewiesen. Eine Hepatitis
durch HHV6 oder HHV7 kann auch eine Komplikation nach
Organtransplantation sein. Insbesondere scheint eine Reaktivierung
von HHV6 nach Lebertransplantation mit einer erhöhten Mortalität
assoziiert zu sein (Abb. 1).6
Nach Lebertransplantation können HHV6 und HHV7 sich sowohl
gegenseitig als auch CMV reaktivieren und dadurch eine symptomatische
Hepatitis verursachen. Zudem wurde HHV6 mit Autoimmunität, einer
Riesenzellhepatitis und einer Riesenzelltransformation der
Gallengänge in Verbindung gebracht.
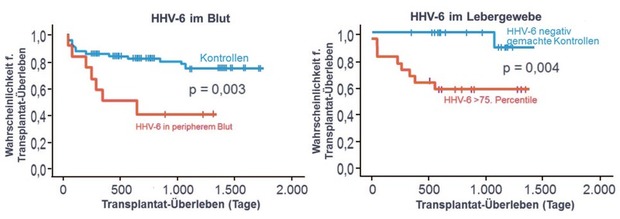
Abb. 1 Nachweis von HHV6 DNA im Gewebe in höheren Konzentrationen oder im Blut korrespondiert mit schlechterem Überleben nach Lebertransplantation (modifiziert nach 6 )
Zum Nachweis einer HHV6 bzw. HVV7 Infektion wird der Nachweise durch quantitative DNA-Amplifikation empfohlen.7 Der HHV6-Nachweis gelingt häufiger in Gallenflüssigkeit oder Biopsiegewebe als im peripheren Blut. Bei Nachweis von HHV6 im Gewebe muss aber eine konnatale HHV6-Transmission ausgeschlossen werden, bei der sich HHV6-DNA in allen Zellen, z.B. auch Haarwurzelzellen, findet. Eine Reaktivierung kann dann nur über die aufwendigere RT-PCR nachgewiesen werden.
Bei immunkompetenten Personen verursachen HHV6 und HHV7 meist benigne selbst-limitierte Erkrankungen, die keiner Therapie bedürfen. Foscarnet wirkt gegen alle drei Viren, HHV6-A, HHV6-B und HHV7. Im Unterschied dazu sind HHV6-A und HHV7 gegen Aciclovir oder Valgangciclovir relativ resistent.8 Cidofovir bietet dann eine therapeutische Alternative, gegen die allerdings auch schon resistente HHV6-Isolate beobachtet wurden. Obwohl einige Hinweise für einen möglichen Nutzen einer antiviralen Therapie insbesondere bei Patienten mit Immundefekt existieren, ist bisher der Stellenwert der antiviralen Therapie bei HHV6 und HHV7-Infektion nicht durch kontrollierte Studien geklärt.
Epstein-Barr-Virus (EBV)
Epstein-Barr-Virus ist ein streng lymphotropes Virus, das in über 90% die Ursache eine akuten infektiösen Mononukleose ist. Es persistiert lebenslang in B-Lymphozyten, wird aber im Unterschied zu den anderen Herpesviren nur selten zu Krankheitsbildern durch Reaktivierung. Es ist aber ursächlich bei einigen Malignomen des lymphozytären Systems und dem Nasopharynxkarzinom beteiligt.
Epstein-Barr-Virus findet sich in oralen Sekreten, so dass die Erst-Infektion häufig im Oropharynx beginnt. Eine Erst-Infektion geschieht häufig im jungen Erwachsenenalter, jedoch wird EBV im Kontext einiger kongenitaler Anomalien wie z.B. der biliären Atresie als mögliche Ursache diskutiert.
Bei der infektiösen Mononukleose, einer akut febrilen Erkrankung mit Pharyngitis, geschwollenen Halslymphknoten und den charakteristischen veränderten Lymphozyten im Blutausstrich, besteht zu 90% gleichzeitig eine milde Hepatitis. Eine nur im Ausnahmefall benötigte Leberbiopsie zeigt diffuse lymphozelluläre Infiltrate in den Sinusoiden. Die Leberzellen werden selbst nicht infiziert, können aber vereinzelt Apoptosen als Folge einer massiv gesteigerten lokalen Zytokinausschüttung durch die aktivierten Lymphozyten zeigen. Da die lymphozellulären Infiltrate atypisch aussehen können, ist eine sorgfältige Unterscheidung von Leberinfiltraten bei Lymphom oder lymphatischer Leukämie nötig. Die Hälfte der Patienten hat eine Splenomegalie, jedoch sind eine vergrößerte Leber oder ein Ikterus selten. Die Erkrankung heilt in wenigen Wochen spontan aus, ein Erschöpfungszustand kann noch mehrere Monate nach der Erkrankung fortbestehen.
In Abhängigkeit vom Zustand des Immunsystems kann die EBV-Infektion jedoch einige schwerwiegende Komplikationen verursachen: Patienten mit einer X-chromosomalen lymphoproliferativen Erkrankung (XLD) infolge einer Mutation im SH2D1A-Gen können tödlich verlaufende EBV-Infektionen mit ausgedehnten Lebernekrosen erleiden. Eine andere seltene Komplikation der EBV-Infektion bei schwerem Immundefekt ist die lymphomatoide Granulomatose, bei der es in zahlreichen Organen einschließlich der Leber zu multiplen Granulomen kommt.36 Eine lymphoproliferative Erkrankung mit Immunoblasten-Infiltration der Leber kann als weitere Komplikation bei HIV-Infektion auftreten. Bei genetisch prädisponierten Patienten kann es nach EBV-Infektion infolge überschießender Immunaktivierung auch zu einem Hämophagozytose-Syndrom kommen.9
Erwähnt werden muss auch noch die sogenannte Posttransplantation-Lymphoproliferationskrankheit (PTLD) nach Organtransplantation. Dabei kommt es zu einer Organinfiltration durch aktivierte Lymphozyten, die von benigner polyklonaler Lymphozytenproliferation bis zum echten B-Zelllymphom reichen kann.10 Eine PTLD wird häufiger bei Transplantation von Kindern beobachtet. Eine Risikokonstellation ist die Transplantation eines EBV-positiven Organs in einen EBV-negativen Empfänger, der unter Immunsuppression eine EBV-Primärinfektion entwickelt.
Die Behandlung der EBV-Infektion ist im Wesentlichen supportiv, da sie in der Regel spontan ausheilt. Kortikosteroide können die Symptome mildern, werden aber wegen genereller Vorbehalte gegen eine Immunsuppression bei Virusinfektion nicht empfohlen. Bei kritischen Komplikationen wie einem drohenden Leberversagen können sie aber lebensrettend sein. Aciclovir hemmt die DNA-Polymerase des Epstein-Barr-Virus und eine Behandlung damit kann die Ausscheidung des Virus verkürzen, zeigt aber selbst bei schweren Verläufen der akuten EBV-Infektion keinen fassbaren klinischen Vorteil. Aciclovir wirkt auch nicht auf die latente EBV-Infektion und spielt deshalb bei der Behandlung der EBV-assoziierten lymphoproliferativen Erkrankungen keine Rolle. Hierzu müssen Zytostatika, B-Zellantikörper und falls möglich auch ein Zurückfahren der Immunsuppression eingesetzt werden.
Humanes Herpesvirus 8 (HHV8)
HHV8 hat das Potential zur malignen Transformation. Zwar kann die Primärinfektion bei Kindern und Patienten mit Immundefekt zu akutem Fieber mit Hautausschlag führen, die eigentlichen HHV8-assoziierten Erkrankungen treten jedoch erst mehrere Jahre später auf. Es handelt sich um das Kaposi-Sarkom, den multizentrischen Morbus Castleman, das Body-Cavity-Lymphom, eine Knochenmarkaplasie oder ein malignes Myelom. Ein Kaposi-Sarkom der Leber ist in der Regel Teil einer ausgedehnten kutanen viszeralen Erkrankung bei fortgeschrittener HIV-Infektion. Ein fulminantes Auftreten eines Kaposi-Sarkoms ist auch wenige Wochen nach Lebertransplantation beobachtet worden.11 Makroskopisch finden sich dunkelrote Tumoren von 0,5 bis 2 cm an der Haut, der Leberkapsel und im Parenchym. Histologisch zeigt sich ein Netzwerk aus spindelförmigen Tumorzellen und erweiterten Blutgefäßen mit dünner Wand sowie dazwischen Clustern aus intrazytoplasmatischen, eosinophilen Einschlüssen.
Hepatosplenomegalie, Fieber und Gewichtsabnahme sind mögliche Hinweise auf einen multizentrischen Morbus Castleman, eine angiofollikuläre Lymphknoten Hyperplasie. Histologisch bestehen vergrößerte Lymphknoten mit vermehrten Lymphfollikeln, die die normale Lymphknotenstruktur zerstören. Die Keimzentren sind regressiv verändert. In der interfollikulären Zone finden sich zahlreiche endotheliale Venolen und gelegentlich senkrecht in die Follikel eintretende hyalinisierte Gefäße. Der Morbus Castleman ist selbst noch kein Lymphom, wird aber als Vorstufe dazu angesehen. Über eine gesteigerte Inteleukin-6-Bildung unterstützen sich Morbus Castleman und Kaposi-Sarkom gegenseitig im Wachstum, so dass die beiden Läsionen nebeneinander im gleichen Lymphknoten gefunden werden können.12
Pleuraergüsse und Aszites mit zahlreichen Plasmazell-ähnlichen Lymphozyten sind der typische Befund bei einem HHV8-assoziierten Body-Cavity-Lymphom, das aber auch solide Tumoren und in der Leber eine diffuse sinusoidale Akkumulation von B-Lymphozyten verursachen kann.
Bei der Therapie der HHV8-assoziierten Läsionen steht eine Reduktion der Immunsuppression im Vordergrund, die im Falle einer HIV-Infektion durch antiretrovirale Therapie bzw. bei Organtransplantation auch durch Umstellung der Immunsuppression auf antiproliferative m-TOR (Mammalian Target of Rapamycin) Hemmer möglich ist.13 Chemotherapie mit liposomalen Anthracyclinen oder Paclitaxel sind weitere effektive Behandlungsoptionen bei Kaposi-Sarkom14, und Rituximab ist bei Morbus Castleman bzw. HHV8-assoziiertem Lymphom wirksam. Verschiedene Virustatika wie Valganciclovir, Cidofovir, Foscarnet oder Adefovir, nicht jedoch Aciclovir, hemmen in vitro die HHV8-Replikation und können die oropharyngale Ausscheidung von HHV8 reduzieren.
Fazit
Herpesviren sind neben den eigentlichen Hepatitisviren eine wichtige Ursache viraler Lebererkrankungen. Sie persistieren in inaktiver Form in einer Latenzphase, aus der sie unter bestimmten Umständen reaktiviert werden können. Neben der direkten Infektion von Leberzellen können Sie das Immunsystem deregulieren und dadurch auch immunvermittelte Leberschäden verursachen. Gamma-Herpesviren (EBV, HHV-8) sind zudem eine wichtige Ursache maligner Erkrankungen insbesondere unter Immunsuppression.
1 N. Finström, K. Bergsten, H. Ström, et al. Analysis of varicella-zoster virus and herpes simplex virus in various clinical samples by the use of different PCR assays. J Virol Meth 2009; 150: 193-96
2 W.K. Al-Hoamoudi. Severe autoimmune hepatitis triggered by varicella zoster infection. World J Gastroenterol 2009; 15: 1004-06
3 R.R. Razonable, R.A. Brown, M.J. Espy, et al. The clinical use of various blood compartments for cytomegalovirus (CMV) DNA quantitation in transplant recipients with CMV disease. Transplantation 2002; 73: 968-73
4 M.Y. Stoeckle. The spectrum of human herpesvirus 6 infection: from roseola infantum to adult disease. Annu Rev Med 2000; 51: 423-430
5 D.H. Dockrell, C.V. Paya. Human herpesvirus-6 and -7 in transplantation. Rev Med Virol 2001; 11: 23-36
6 S. Pischke, J. Gösling J, I. Engelmann, J. Schlue, B. Wölk, E. Jäckel, et al. High intrahepatic HHV-6 virus loads but neither CMV nor EBV are associated with decreased graft survival after diagnosis of graft hepatitis. J Hepatol. 2012; 56: 1063-69
7 C. Deback, F. Agbalika, C. Scieux, et al. Detection of human herpesviruses HHV-6, HHV-7and HHV-8 in whole blood by real-time PCR using the new CMV, HHV-6, 7, 8 R-gene kit. J Virol Methods 2008; 149: 285-91
8 E. De Clercq, L. Naesens, L. De Bolle, et al. Antiviral agents against human herpesviruses HHV-6, HHV-7 and HHV-8. Rev Med Virol 2001; 11: 381-95
9 X.C.Han,
Q. Ye, W.Y.Zhang, Y.M.Tang, X.J. Xu, T. Zhang. Cytokine
profiles as novel diagnostic markers of Ep-stein-Barr
virus-associated hemophagocytic lympho-
histiocytosis in children.
J Crit Care. 2017; 39: 72-77
10 D.W. Hanto. Classification of Epstein-Barr virus associated posttransplant lymphoproliferative diseases: Implications for understanding their pathogenesis and developing rational treatment strategies. Annu Rev Med 1995; 36: 381-94
11 P. Piselli, G. Busnach, F. Citterio, et al. Risk of Kaposi sarcoma after solid-organ transplantation: multicenter study in 4,767 recipients in Italy, 1970-2006. Transpl Proc 2009; 41: 1227-30
12 K.N. Naresh, A.J. Rice, M. Bower. Lymphnodes involved by multicentric Castleman disease among HIV-positive individuals are often involved by Kaposi sarcoma. Am J Surg Pathol. 2008; 32: 1006-12
13 P. Barozzi, G. riva, D. vallerini, et al. Indirect antitumor effects of mammalian target of rapamycin inhibitors against Kaposi sarcoma in transplant patients. Transplantation 2009; 88: 597-98
14 R. Di Trolio, G. Di Lorenzo, M. Delfino, S. De Placido. Role of pegylated liposomal doxorubicin (PLD) in systemic Kaposi’s sarcoma: a systematic review. Int J Immunopathol Pharmacol 2006; 19: 253-63





